Актуальность. Ревматические заболевания остаются актуальной проблемой современной медицины по причине высоких показателей первичной заболеваемости и распространенности (свыше 15 млн на территории РФ), высоких процентов потери трудоспособности и получения инвалидности [1]. Анкилозирующий спондилит (АС) классифицируется как «классическое» иммуновоспалительное ревматическое заболевание позвоночника. Распространенность АС в популяции составляет от 0,1 до 1,8% среди взрослого населения [2; 3]. В то же время появляется все больше экспериментальных данных о связи хронической иммуновоспалительной реакции с другой социально значимой медицинской проблемой – сердечно–сосудистыми заболеваниями [2]. При этом высокая социальная и экономическая значимость АС, в отличие от других ревматических заболеваний, дополняется дебютом в молодом возрасте, прогредиентным течением заболевания, приводящим к ранней инвалидизации, необходимостью длительного постоянного приема лекарственных средств, таких как нестероидные противовоспалительные препараты (НПВП), синтетические базисные препараты и генно–инженерные биологические препараты (ГИБП) [4].
НПВП являются препаратами первой линии у больных АС (уровень доказательности В), в то же время, по мнению многих исследователей, продемонстрировано негативное влияние данной группы препаратов на сердечно–сосудистую систему (ССС), в том числе на уровень артериального давления (АД) [4; 5]. По данным отечественной и зарубежной литературы, влияние сульфасалазина как базисного противовоспалительного препарата периферической формы АС (уровень доказательности В) на ССС неоднозначно, в некоторых работах показано снижение риска сердечно–сосудистых осложнений за счет противовоспалительного действия препарата, в других исследованиях либо вообще отсутствует информация, либо имеются единичные работы, демонстрирующие негативное влияние сульфасалазина на ССС [6; 7]. В лечении АС последние годы активно применяется терапия моноклональными антителами к фактору некроза опухоли–α (ФНО–α) (уровень доказательности В), которая благоприятно влияет на ССС (доказано снижение сердечно–сосудистых осложнений, инфаркта миокарда, мозгового инсульта на 30, 41 и 43% соответственно) [4; 8]. Изучение проблемы кардиоваскулярной патологии при АС, по данным литературы, показало отсутствие единого положения, что требует дальнейшего изучения данной проблематики.
Цель. Изучить влияние различных схем противовоспалительной терапии АС на структурно–функциональное состояние ССС по данным эхокардиографического исследования.
Материалы и методы исследования. В проспективном исследовании приняло участие 108 мужчин в возрасте от 20 до 50 лет с верифицированным диагнозом АС низкой и умеренной активности по индексу BASDAI (Bath AS Disease Activity Index) и длительностью заболевания не более 10 лет. Обязательным критерием включения в исследование являлось применение противовоспалительной терапии (1 группа – диклофенак; 2 группа – диклофенак и сульфасалазин; 3 группа – диклофенак и инфликсимаб) в адекватных дозах, не менее последних 6 месяцев до начала исследования. Кроме того, применение указанных препаратов должно было сопровождаться выраженным положительным эффектом: регресс большинства клинических проявлений, снижение величины индекса BASDAI на 50% и более, индексов BASFI, BASMI на 20% и более, положительная динамика лабораторных показателей. Были определены критерии исключения из исследования: высокая и очень высокая клинико-лабораторная активность АС, оцененная по Батскому индексу, и уровень С-реактивного белка (СРБ) в крови более 1,0 мг/л; длительность АС более 10 лет; возраст менее 20 и более 50 лет; пол женский; наличие осложнений (вторичный системный амилоидоз; аортальный порок сердца; нарушение ритма сердца; контрактура периферических суставов) и внескелетных проявлений АС (увеит; воспалительные заболевания кишечника (болезнь Крона, язвенный колит); псориаз; IgA-нефропатия; нарушение проводимости сердца и аортит); тяжелая сопутствующая соматическая патология, в том числе эндокринные заболевания, пороки сердца, хроническая обструктивная болезнь легких, туберкулез любой локализации, болезни печени и почек; функциональные нарушения АС III и IV класса (сохранено либо ограничено самообслуживание, ограничены непрофессиональная и профессиональная деятельность); отказ от подписания информированного согласия на исследование и использование биологического материала в медицинских и научных целях.
Всем пациентам проводилось комплексное лабораторное и инструментальное исследование, а также исследование структурно–функциональных параметров ССС (эхокардиография, доплерэхокардиография).
Эхокардиографическое исследование (Эхо-КГ) проводилось на эхокардиографе «Phillips HD 11» (США) в М– и В–режимах через стандартные доступы [9]. Определяли следующие параметры: конечный диастолический (КДД, см) и систолический (КСД, см) диаметры левого желудочка (ЛЖ); толщина задней стенки ЛЖ (ТЗСЛЖд, см) и межжелудочковой перегородки (ТМЖПд, см) в диастолу. Рассчитывался индекс относительной толщины стенки ЛЖ: (ОТС ЛЖ) = (ТЗСЛЖд + ТМЖПд) / КДД.
Массу миокарда ЛЖ (ММЛЖ, г) определяли по формуле R. Devereux: ММЛЖ = 1,04x [(ТЗСЛЖд + ТМЖПд +КДД) 3 - (КДД) 3]-13,6.
Индекс ММЛЖ (ИНММ, г/м2) рассчитывали по отношению к площади поверхности тела. ИММЛЖ равный 115 г/м2 принимался за верхнюю границу нормативного диапазона.
Определяли геометрические типы ЛЖ: нормальная геометрия ЛЖ при ОТС ЛЖ ≤ 0,42, ИММЛЖ ≤ 115 г/м2; концентрическое ремоделирование – ОТС ЛЖ ≥ 0,42, ИММЛЖ < 115 г/м2; концентрическая гипертрофия – ОТС ЛЖ ≥ 0,42, ИММЛЖ > 115 г/м2; эксцентрическая гипертрофия – ОТС ЛЖ < 0,42, ИММЛЖ > 115 г/м2.
У всех исследуемых измеряли конечный систолический (КСО, мл) и диастолический (КДО, мл) объемы ЛЖ, ударный (УО, мл) и минутный (МО, л/мин) объемы ЛЖ, фракцию изгнания (ФИ, %) и степень укорочения ЛЖ (% ΔS, %).
В импульсно–волновом доплеровском режиме из верхушечного доступа проводился анализ следующих параметров кровотока в диастолу: Vmax Peak Е, м/с – пиковая скорость раннего диастолического наполнения; Vmax Peak А, м/с – пиковая скорость предсердного (позднего) диастолического наполнения; Е/А – отношение скоростей Vmax Peak Е\ Vmax Peak А; DT, мс – время замедления потока в фазу раннего наполнения; IVRT, мс – время изоволюмического расслабления [9].
Статистическая обработка полученных данных проводилась с помощью программы SPSS for Windows (версия 15) с использованием методов вариационной статистики, характер распределения данных оценивали с использованием критериев Колмогорова – Смирнова. В связи с преимущественно нормальным распределением переменных все статистические расчеты проводились при использовании параметрических методов, результаты исследования были представлены в виде M±m. Статистическую значимость по значениям показателей среди изучаемых групп оценивали по непарному двухвыборочному t-критерию Стьюдента. Статистическую значимость между выборочными долями исследовали по точному критерию Фишера. Статистическую значимость динамики показателей определяли при помощи t-критерия Стьюдента для зависимых групп. Корреляционная взаимосвязь количественных признаков определялась с помощью коэффициента корреляции Пирсона. Статистическая значимость различий устанавливалась при р<0,05 и ниже (р<0,01; р<0,001).
Результаты. Все три группы, сформированные по принципу назначаемой противовоспалительной терапии, были сопоставимы по степени и характеру выявленных при Эхо–КГ патологических изменений структур сердца, ни в одном из случаев не было выявлено нарушений локальной сократимости миокарда (участки а–, гипо, дискинезии стенок), внутрисердечных тромбов, патологического количества жидкости в полости перикарда, повышенного систолического давления в устье легочной артерии, врожденных пороков сердца (за исключением малых аномалий развития сердца, таких как дополнительные хорды левого желудочка). Проведенное эхокардиографическое исследование показало отсутствие в исследуемой выборке пациентов с патологией аорты (восходящего отдела, дуги, доступной для осмотра части нисходящего отдела аорты) и клапанов сердца. Полученные нами данные согласуются с результатами других исследователей, изучающих АС, которые продемонстрировали низкую частоту поражения аорты, проводящей системы и клапанного аппарата сердца у больных АС [4; 10].
При анализе структурно–геометрических характеристик обращают на себя внимание толщина стенок миокарда ЛЖ: по ТМЖПд средние значения во всех трех группах превышали референсные для постановки гипертрофии ЛЖ, в то же время по ТЗСЛЖд значения в 1-й и 2-й группах статистически значимо превышали аналогичный показатель в 3-й группе (p <0,05). В отношении ТМЖПд и КДД в 3-й группе также можно обратить внимание на тенденцию средних значений к более нормативному диапазону по сравнению с 1-й и 2-й группами, что интегрально отражается в статистически значимом более низком значении ОТС ЛЖ, ММЛЖ и ИНМЛЖ (p <0,05) (табл. 1).
Таблица 1
Данные эхокардиографического исследования у больных АС, M±SD
|
Показатель |
1-я группа (n=41) |
2-я группа (n=39) |
3-я группа (n=28) |
|
ТМЖПд, см |
1,05±0,13 |
1,06±0,14 |
0,99±0,14* |
|
ТЗСЛЖд, см |
1,02±0,13 |
1,03±0,11 |
1,01±0,10 |
|
КДД, см |
4,6±0,13 |
4,62±0,09 |
4,65±0,11 |
|
КСД, см |
2,9±0,08 |
2,88±0,09 |
2,79±0,12 |
|
КСО, мл |
34,3±2,24 |
34,1±2,94 |
30,5±1,96 |
|
КДО, мл |
102,1±4,15 |
101,5±5,55 |
105,4±6,7 |
|
ОТС ЛЖ |
0,45±0,04 |
0,45±0,05 |
0,42±0,02* |
|
УО, мл |
73,2±10,62 |
71,8±8,46 |
67,1±9,76 |
|
МО, л/мин |
5,44±0,51 |
5,2±0,78 |
4,9±0,42 |
|
УИ, мл/м2 |
37,4±2,28 |
38,1±2,11 |
36,8±1,43 |
|
СИ, л/мин/м2 |
2,99±0,49 |
2,85±0,24 |
2,79±0,19 |
|
ФИ ЛЖ, % (по Simpson) |
66,6±3,96 |
66,8±5,02 |
68,1±4,77 |
|
ММЛЖ, г |
238,3±9,49 |
241,5±12,84 |
232,3±8,45* |
|
ИММЛЖ, г/м2 |
120,8±4,81 |
122,3±7,72 |
117,8±3,97* |
Примечание: * - p<0,05, в сравнении с аналогичными значениями 1 и 2 групп, непарный двухвыборочный t-критерий Стьюдента.
При анализе типов геометрической конфигурации сердца (рис. 1) удалось установить наличие статистически значимого превышения количества исследуемых с нормальной конфигурацией сердца в 3-й группе по сравнению со 2-й группой (p=0,019). В 1-й группе количество пациентов с признаками ремоделирования или гипертрофии стенок сердца составило 68% (30/41), во 2-й группе – 77% (30/39), а в 3-й группе – 46% (13/28), а признаки только гипертрофии в 1-й группе - 54% (22/41), во 2-й группе – 62% (24/39), а в 3-й группе – 36% (10/28). Профиль типов геометрии сердца в 1-й и 2-й группе совпадал, в обеих группах на первом месте по частоте встречаемости оказалась концентрическая гипертрофия, на втором - эксцентрическая гипертрофия.
При анализе полученных параметров, таких как глобальная сократительная способность ЛЖ (УО, ФИ, МИ, СИ), нарушений систолической функции левого желудочка у больных АС выявлено не было. Полученные результаты согласуются с данными литературы [6; 7], которые продемонстрировали низкую частоту встречаемости нарушений систолической и диастолической функций желудочков сердца у больных АС, при этом отмечена прямая корреляционная взаимосвязь этих нарушений с длительностью основного заболевания (более 15 лет). Проведен корреляционный анализ параметров систолической функции ЛЖ и основных клинико–лабораторных (индексы BASDAI и MASES, СОЭ, СРБ в крови, липидограмма крови и др.) показателей АС, на основании которого не удалось установить статистически значимые связи (p>0,05). Вышеуказанные данные согласуются с мнением экспертов Международной группы по изучению спондилоартритов (ASAS), которые отмечают, что поражение сердца при АС встречается очень редко (<1%), как правило, на поздней стадии болезни, протекает субклинически, без корреляционной взаимосвязи с поражением опорно–двигательного аппарата и не поддается коррекции противовоспалительной терапией основного заболевания [8; 11].
Анализ параметров диастолической функции ЛЖ сердца, с учетом отсутствия единых подходов в диагностике данных нарушений, проводился на основании критериев рабочей группы ESC по данным доплер-Эхо-КГ [8]. К основным критериям диастолической дисфункции ЛЖ сердца относятся пиковая скорость раннего диастолического наполнения менее 0,53 м/с, пиковая скорость позднего диастолического наполнения более 0,70 м/с, уменьшение отношения Vmax Peak E / Vmax Peak А<1, DT ЛЖ ниже 220 мс, время изоволюмического расслабления больше 100 мс.
Анализ диастолической функции ЛЖ у больных АС (табл. 2) на разной противовоспалительной терапии продемонстрировал во 2-й группе ниже показатели пиковой скорости раннего диастолического наполнения ЛЖ и отношения Vmax Peak Е/ Vmax Peak А (p<0,05) по сравнению с данными показателями в 1-й и 3-й группах. В то же время максимальная скорость позднего диастолического наполнения в 3-й группе в среднем на 78% (p<0,01) и 88% (p<0,01) оказалась ниже в сравнении с 1-й и 2-й группами соответственно. Статистически значимая разница между группами определялась по отношению Е/А (p<0,05).
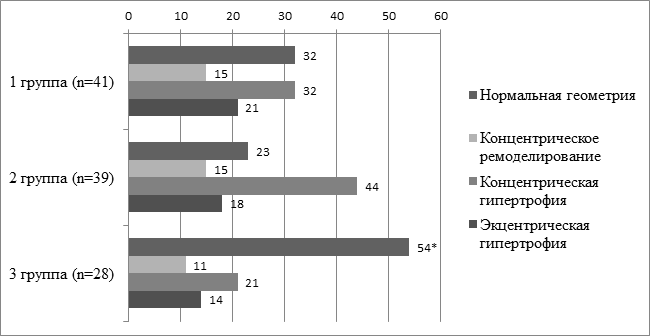
Рис. 1. Типы геометрии ЛЖ у больных АС, %
Примечание: * - p<0,05 в сравнении со 2-й группой, двусторонний критерий Фишера
Таблица 2
Данные эхокардиографического исследования у больных АС, M±SD
|
Показатель |
1-я группа (n=41) |
2-я группа (n=39) |
3-я группа (n=28) |
|
Vmax Peak E ЛЖ, м/с |
0,71±0,08 |
0,66±0,04^ |
0,74±0,06 |
|
Vmax Peak A ЛЖ, м/с |
0,67±0,04 |
0,75±0,05 |
0,59±0,09** |
|
Е/А ЛЖ, у.е. |
0,95±0,07 |
0,88±0,04^ |
1,12±0,06* |
|
IVRT ЛЖ, мс |
101,08±4,97 |
103,17±3,94 |
98,74±2,94 |
|
DT ЛЖ, мс |
226,07±14,11 |
232,49±12,94 |
218,45±12,57 |
Примечание: * - p<0,05, ** - p<0,01, в сравнении с аналогичными значениями 1 и 2 групп, непарный двухвыборочный t-критерий Стьюдента; ^ - p<0,05, в сравнении с аналогичными значениями 1 и 3 групп, непарный двухвыборочный t-критерий Стьюдента.
Нарушение диастолической функции ЛЖ было выявлено у 32,4% (35/108) больных АС (рис. 2). При этом в 3-й группе процент отклонений по данным пиковой скорости позднего диастолического наполнения был значительно ниже (p<0,01), чем в других группах.
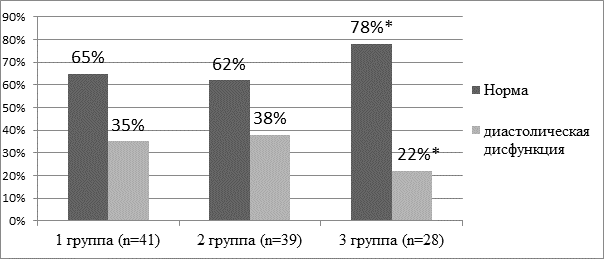
Рис. 2. Процент нарушений параметров диастолы ЛЖ сердца у больных АС, %
Примечание: * - p<0,01 в сравнении с аналогичными значениями 1 и 2 групп, непарный двухвыборочный t-критерий Стьюдента
Заключение. По данным эхокардиографического исследования у больных АС с низкой и умеренной активностью по индексу BASDAI и длительностью заболевания не более 10 лет серьёзных нарушений систолической функции ЛЖ выявлено не было. При этом на постоянном приеме противовоспалительной терапии в виде комбинации НПВП и сульфасалазина были установлены нарушения диастолической функции ЛЖ по 1 типу замедленной релаксации и гипертрофия миокарда ЛЖ преимущественно концентрического типа.
По данным ряда крупных эпидемиологических исследований, в частности Тайского регистра больных АС, длительный и регулярный прием НПВП при АС доказал снижение сердечно–сосудистого риска [7; 8; 11; 12]. Также продемонстрировано благоприятное влияние терапии ГИБП на ССС, связанное с их выраженным противовоспалительным эффектом. Многочисленные исследования показали высокую эффективность сульфасалазина в подавлении симптоматики периферического артрита, но при этом снижение риска сердечно–сосудистых осложнений на фоне лечения данным препаратом не доказано (исследование QUEST-RA 4363 пациентов из 48 клиник 15 стран). В качестве общей детерминанты между АС и различными изменениями ССС можно рассматривать хроническую прогредиентно текущую иммуновоспалительную реакцию, уровень которой во многом определяется эффективностью противовоспалительной терапии.
Библиографическая ссылка
Бобрикова Д.А., Малых И.А., Евенко А.Ю., Кнауб Н.В. ВЛИЯНИЕ РАЗЛИЧНЫХ СХЕМ ПРОТИВОВОСПАЛИТЕЛЬНОЙ ТЕРАПИИ АНКИЛОЗИРУЮЩЕГО СПОНДИЛИТА НА СТРУКТУРНО¬–ФУНКЦИОННАЛЬНОЕ СОСТОЯНИЕ СЕРДЕЧНО–СОСУДИСТОЙ СИСТЕМЫ // Современные проблемы науки и образования. 2018. № 5. ;URL: https://science-education.ru/ru/article/view?id=28128 (дата обращения: 15.02.2026).



