Глиомы относятся к наиболее распространенным инвазивным первичным опухолям мозга у взрослых пациентов и характеризуются высокими уровнями смертности и рецидивирования после хирургического удаления. Этот вид опухолей встречается с частотой приблизительно 5 пациентов в год на 100 000 человек в мире. Глиомы поражают головной и спинной мозг и возникают в результате онкотрансформации глиальных клеток [1]. Приблизительно 70% всех глиом относятся к злокачественным. Лишь 20% пациентов с данным заболеванием преодолевают 5-летний рубеж выживаемости [2]. За некоторыми исключениями, по показателям распространенности и смертности от опухолевых заболеваний гендерные различия во всем мире проявляются независимо от расы или возраста. Онкологические заболевания, которые затрагивают как мужчин, так и женщин во всех локализациях и органных системах, часто характеризуются коэффициентами мужской и женской заболеваемости, которые соотносятся от примерно от 1,5:1 до 3:1 [3]. Мужчины не только чаще болеют онкологическими заболеваниями, они также часто проявляют более плохие (по сравнению с женщинами) ответы на терапию по показателям как общей, так и бессобытийной выживаемости [4]. Поэтому изучение гендерных особенностей в течении онкологических заболеваний поможет выявить фундаментальные различия в основных механизмах инициирования, прогрессии опухолей и возможного терапевтического ответа. Благодаря подобного рода исследованиям могут быть выделены четкие связи между гендерными различиями и конкретными онкогенными механизмами или молекулярными подтипами рака, а также связь между гендерными различиями и предполагаемыми ответами на терапевтические воздействия при лечении опухолей. Поэтому целью настоящего исследования послужило исследование гендерных особенностей в показателях транскрипционной активности некоторых генетических локусов глиом головного мозга для определения потенциальных молекулярных и клеточных механизмов/мишеней, через которые гендерные различия пациентов влияют на биологию и особенности клинических проявлений онкологических заболеваний.
Материалы и методы
В исследовании были использованы операционные биоптаты опухолевых тканей головного мозга, прилегающих к ним перифокальных участков (5 мм от опухоли) и не малигнизированных (условная норма) тканей, взятых в процессе операционного вмешательства у 21 пациента (12 мужчин и 9 женщин) в возрасте 36-67 лет, поступивших на лечение в ФГБУ «РНИОИ» МЗ РФ в 2017–2018 гг. Каждое исследование было одобрено этическим комитетом ФГБУ «РНИОИ»; было получено добровольное информированное согласие каждого пациента на включение его в данное исследование.
Последовательности праймеров, использованных в данном исследовании
|
№ |
Название генетического локуса |
Последовательности праймеров 5’®3’ |
||
|
Forward |
Reverse |
|||
|
1 |
EGFR |
AGGACGGGGACCAGACAA |
CTGCGTACTTCCAGACCAGG |
|
|
2 |
SMAD4 |
GGATACGTGGACCCTTCTGG |
ATGTGCAACCTTGCTCTCTCA |
|
|
3 |
SMAD7 |
GCAGACTGTCCAGATGCTGTG |
AAGAAGTTGGGAATCTGAAAGCC |
|
|
4 |
SMO |
CTGAAGGCTGCACGAATGAG |
CTTGGGGTTGTCTGTCCGAA |
|
|
5 |
NOTCH1 |
CCTGCCTGTCTGAGGTCAATG |
AGTCGCACTTGTACCCGTTG |
|
|
6 |
NOTCH2 |
AATGTTACAGCAGCCCTTGC |
AATTAACCCCTGACGTGCCT |
|
|
7 |
HBP1 |
TGGGCATTCACAAGGGCTATG |
AGTCAACTTCAGTACAGACTCGC |
|
|
8 |
HIF1A |
CCATGCCCCAGATTCAGGAT |
GGACTATTAGGCTCAGGTGAACT |
|
|
9 |
EGLIN1 |
AGACTGGGATGCCAAGGTAAG |
CAATGTCAGCAAACTGGGCT |
|
|
10 |
EGLIN3 |
TCATAGCAGATGTGGAGCCC |
GCATATCTGGTTGCGTAAGAGG |
|
|
11 |
KDM1A |
GCTACACGGCTTCAGGATGT |
GGGTACAGAGAACTGCGTCG |
|
|
12 |
KDM 1B |
GTGTGAACAAGTATCTGCTCG |
AATGTCAAGCCCTTCTGCCA |
|
|
13 |
MSI1 |
GGCTGTGGTTCGAGGGAC |
CTGGGAGTCGAACCTGGAG |
|
|
14 |
MSI2 |
GCAGACCCAGCAAGTGTAGA |
CGAGGAAATGCAACTTTGGGG |
|
|
15 |
TET1 |
GGAAAACAAGAGGCCCCAGA |
ACTTGGGGCCATTTACTGGT |
|
|
16 |
PSMC4* |
CGCTCACGCATTTCGAGC |
CAGGTGGGCCATACATGAGG |
|
|
17 |
RPL0* |
GAGGAAACTCTGCATTCTCGC |
CTGCAGACAGACACTGGCA |
|
|
18 |
TBP* |
GTGCCCGAAACGCCGAA |
GTGGTTCGTGGCTCTCTTATCC |
|
*Референсные гены.
Для транспортировки в лабораторию и хранения образцы мгновенно замораживали в жидком азоте без использования криотранспортных РНК-сред. Максимальное время от момента взятия образца до его заморозки в жидком азоте составляло не более 20 с. Фрагменты тканей гомогенизировали в фарфоровых ступках в лизирующем растворе, содержащем 4 М гуанидин тиоцианат, 25 мМ цитрат натрия, 0,5% саркозил и 0,1 М 2-меркаптоэтанол в соответствии с методом P. Chomczynski и N. Sacchi. Полученные образцы суммарной РНК обрабатывали препаратами ДНК-азы для удаления следов геномной ДНК. [5] С использованием коммерческих наборов Reverta-L («Интерлабсервис», Россия) проводили синтез кДНК. Величины относительной экспрессии 15 генетических локусов: EGFR, SMAD4, SMAD7, SMO, NOTCH1, NOTCH2, HBP1, HIF1A, EGLN1, EGLIN3, KDM1B, KDM1A, MSI1, MSI2, TET1 (таблица) определяли методом RT-qPCR. После серии предварительных экспериментов в качестве референсных использовали гены PSMC, TBP и RPLO. С помощью программы geNorm оценивалась стабильность экспрессии при подборе референсных генов. С использованием референсных последовательностей NCBI GenBank и программы Primer-BLAST осуществлялся дизайн специфичных олигонуклеотидных праймеров [6].
С использованием пакета прикладных статистических программ Microsoft Excel 2013 (Microsoft Corporation, США) и Statistica 8.0 (StatSoft Inc., США) осуществляли статистический анализ результатов. С помощью непараметрического критерия Манна-Уитни и с использованием коэффициента корреляции Спирмена оценивали достоверность отличий и проводили корреляционный анализ полученных результатов. При пороговом уровне p<0,05 отвергали нулевую статистическую гипотезу об отсутствии различий.
Результаты исследования и их обсуждение
В рамках проведенного нами исследования, с точки зрения возможной специфики гендерных различий в паттернах экспрессии, исследованные генетические локусы можно условно разделить на две группы. Группа № 1 – в этой группе изменения в показателях экспрессии генетических локусов в тканях глиом головного мозга у пациентов мужского и женского пола носили разнонаправленный характер. То есть если у пациентов мужского пола наблюдалось увеличение относительной экспрессии некоторых исследованных генетических локусов в тканях глиом, то у пациенток женского пола в аналогичных тканях наблюдалось уменьшение транскрипционной активности того же локуса, а объединенная выборка пациентов мужского и женского пола давала результирующую величину экспрессии данного локуса, приблизительно равную показателям контроля (т.е. не опухолевой ткани). К первой группе исследованных генетических локусов в рамках проведенного нами исследования относятся локусы EGFR и KDM1B (рисунок). Различия в уровнях экспрессии гена EGFR в опухолевой ткани между пациентами мужского и женского пола отличались приблизительно в 2,5 раза (у мужчин этот показатель больше) и были статистически достоверны для уровня значимости p=0,0058.
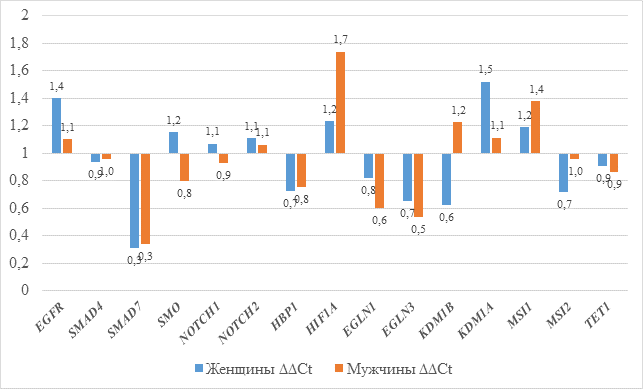
Паттерны относительной экспрессии генов в опухолевой ткани (относительно нормальной) у пациентов женского и мужского пола (n=21)
Уровень экспрессии локуса KDM1B у пациентов мужского пола превышал аналогичный показатель у пациентов женского пола приблизительно в 3 раза. Данные различия также были статистически достоверны для уровня значимости p=0,0042. Это свидетельствует о том, что для опухолевых тканей мозга (глиом) пациентов мужского пола препараты, таргетирующие рецепторы EGFR, будут в среднем (но не для каждого отдельно взятого пациента) эффективнее аналогичных препаратов, используемых для лечения пациентов женского пола. Для использования алкилирующих препаратов при лечении глиом (например, темозоломид) можно сделать противоположный вывод: применение алкилирующих агентов при лечении глиом будет намного эффективнее у пациентов женского пола. Вторая группа исследованных локусов включает в себя те локусы, транскрипционная активность которых в опухолевой ткани статистически достоверно (или на уровне тенденции) отличается от контрольных показателей однонаправленно как у пациентов мужского, так и женского пола. В рамках проведенного нами исследования к таким локусам можно отнести SMAD7, HIF1A, EGLN1, EGLN3. К третьей группе исследованных нами генетических локусов нужно отнести те локусы, транскрипционная активность которых в тканях глиом не отличалась в различных гендерных группах: SMAD4, SMO, NOTCH1, NOTCH2, HBP1, KDM1A, MSI1, MSI2 и TET1 (рисунок). С точки зрения потенциального использования того или иного локуса в качестве маркера прогрессии или малигнизации, а также мишени для терапевтических воздействий, потенциально пригодными можно считать локусы, транскрипционная активность которых достоверно отличается от контрольных показателей. В рамках нашего исследования, в пределах выборки пациентов мужского пола к таким генетическим локусам относятся: SMAD7 (p=0,000047), EGLN1 и EGLN3 (p=0,00085 и p=0,036 соответственно). У пациентов женского пола к таким генетическим локусам относится только генетический локус EGLN1 (p<0,004). При этом необходимо отметить, что в рамках проведенного нами исследования показатели вариабельности для показателей транскрипционной активности исследованных нами генетических локусов (средние квадратические отклонения или d2) в среднем для показателей нормальной ткани у мужчин превышали аналогичные показатели рядов данных для пациентов женского пола в 9 раз, а для опухолевой ткани – в 22 раза. При использовании F-теста статистически достоверные различия (для уровня p=0,031) по показателям вариабельности рядов между нормальными тканями пациентов разного пола (мужчины/женщины) были получены для локусов NOTCH2, HBP1, EGLN3 и KDM1B. Аналогичный анализ по опухолевым тканям (глиома) показал, что различия по вариабельности рядов данных между пациентами мужского и женского пола наблюдались для локусов EGFR, SMAD4 и NOTCH1. При этом для локуса SMAD4 показатели вариабельности данных были меньше у пациентов мужского пола.
Белок, кодируемый этим геном, представляет собой ядерный белок, который связывает E3 ubiquitin ligase SMURF2. После связывания этот комплекс транслоцируется в цитоплазму, где он взаимодействует с TGF-бета-рецептором типа-1 (TGFBR1), что приводит к деградации как кодируемого этим геном белка, так и TGFBR1. Экспрессия этого гена индуцируется TGFBR1. Вариации этого гена являются причиной восприимчивости к колоректальному раку 3-го типа (CRCS3). Для этого гена были найдены несколько вариантов транскрипции, кодирующих различные изоформы. В рамках проведенного нами исследования транскрипционная активность гена SMAD7 в тканях глиом как мужчин, так и женщин была ниже показателей не опухолевых тканей приблизительно в 2,5 раза, а также в объединенной выборке пациентов мужского и женского пола. Однако отклонение транскрипционной активности гена SMAD7 от показателей контроля в тканях глиом мужчин было статистически достоверным для уровня p=0,000041, в то время как для пациентов женского пола этот показатель составлял всего лишь p=0,156317809, что свидетельствует о значительно большей неоднородности показателей у пациентов женского пола.
Терапевтическое таргетирование рецептора эпидермального фактора роста (EGFR) показано при лечении онкологических заболеваний, и применение многих фармацевтических препаратов для этих целей одобрено отдельно или в сочетании с химиотерапией для лечения колоректального рака, немелкоклеточного рака легкого и рака поджелудочной железы, но не для глиом [7]. Утвержденными препаратами являются в основном тирозинкиназные ингибиторы (TKI), мешающие сигнальной трансдукции рецептора, или моноклональные антитела, таргетирующие этот рецептор на поверхности клетки, чтобы препятствовать связыванию им лиганда. В рамках настоящего исследования нами было установлено, что экспрессия гена EGFR в глиомах пациентов женского и мужского пола статистически достоверно различается (рисунок): в глиомах пациентов мужского пола экспрессия гена EGFR имеет тенденцию к увеличению, а в глиомах пациентов женского пола – к подавлению экспрессии. Гендерные различия статистически достоверны для уровня p=0,0075. Таким образом, имеющие место гендерные различия в уровнях экспрессии гена EGFR в тканях глиом могут быть положены в основу формирования групп риска терапевтических воздействий при лечении данного заболевания.
Ген лизин-специфической деметилазы-1 (KDM1, также известная как LSD1, AOF2 или BHC110) кодирует флавин-зависимую моно-аминоксидазу, которая может деметилировать моно- и диметилированные лизины, в частности гистон H3, лизины 4, 9, 27 и 36 [8]. KDM1 высоко-консервативен у эукариот и необходим для осуществления многих физиологических функций. KDM1 сверхэкспрессируется при разных типах рака, включая нейробластомы [9], раки простаты, молочной железы и толстой кишки [10].
Результаты исследований показывают, что аберрантная экспрессия гена KDM1 происходит во время прогрессирования глиомы с наибольшей экспрессией в глиомах с высоким уровнем дифференцировки. Фармакологическое ингибирование активности KDM1 или нокдаун его экспрессии через siRNA в модельных условиях уменьшает пролиферацию клеток глиом. Ингибиторы KDM1 способствуют апоптозу клеток глиом путем активации сигнального пути p53. В рамках настоящего исследования (рисунок) нами установлено разнонаправленное изменение транскрипционной активности гена KDM1B в глиомах у пациентов женского и мужского пола: у пациентов мужского пола транскрипционная активность гена KDM1B увеличивалась, а у пациентов женского пола – уменьшалась приблизительно в 2 раза. Различия в экспрессии этого генетического локуса были статистически достоверны для уровня p=0,027. В рамках проведенного нами исследования статистически значимых и достоверных различий в уровнях транскрипционной активности исследованных нами генетических локусов в зависимости от уровня дифференцировки клеток (Grade) обнаружить не удалось. С точки зрения кросс-корреляции исследованных локусов у пациентов мужского и женского пола можно сделать вывод о значительных различиях этого показателя для пациентов мужского и женского пола: если для пациентов мужского пола малигнизация тканей мозга служит десинхронизирующим фактором, то для пациентов женского пола – синхронизирующим.
Таким образом, результаты исследования выявили системные различия в процессах малигнизации тканей мозга у пациентов мужского и женского пола, которые необходимо учитывать при организации лечебного процесса (химиотерапия) и формировании групп риска пациентов.
Библиографическая ссылка
Кит О.И., Пушкин А.А., Росторгуев Э.Е., Поркшеян Д.Х., Франциянц Е.М., Кузнецова Н.С., Черкиев И.У., Водолажский Д.И. ГЕНДЕРНЫЕ ОСОБЕННОСТИ ЭКСПРЕССИИ ГЕНЕТИЧЕСКИХ ЛОКУСОВ В ТКАНЯХ ГЛИОМ // Современные проблемы науки и образования. 2018. № 5. ;URL: https://science-education.ru/ru/article/view?id=28068 (дата обращения: 15.02.2026).
DOI: https://doi.org/10.17513/spno.28068



