Характерным трендом реального времени является стабильное увеличение возраста женщин, планирующих беременность [1]. Несмотря на достижения в изучении этиопатогенеза, морфологии, способов диагностики и лечения гинекологической патологии [2], миома матки (MM) сохраняет весомые риски для репродуктивного здоровья женщины. Достижения в эндоскопии представляют возможности для минимально инвазивного и органосохраняющего лечения ММ [3]. Для профилактики спаечного процесса в малом тазу после миомэктомии, широко применяются антиадгезивные барьеры [4]. Внедренные клинические протоколы, регламентирующие тактику антирецидивной терапии ММ после лапароскопической миомэктомии, высокотехнологичные подходы по сохранению или восстановлению фертильности у женщин с ММ - множество вопросов остаются актуальными и требуют решения.
Переоценить значимость прегравидарной подготовки невозможно [5]. Прегравидарное и преконцепционное консультирование женщин, страдающих ММ, имеющих рубец на матке после органосохраняющего лечения, является предметом изучения отечественных и зарубежных исследователей. Менеджмент женщин, планирующих беременность при наличии ММ, требует персонифицированного подхода с учетом возраста женщины, паритета, наличия сопутствующей гинекологической и общесоматической патологии. Сохраняют остроту и дискуссионность предпочтение лапароскопического или лапаротомического доступа, объём хирургического лечения, возможность эндоскопического восстановления целостности матки путем наложения швов, подбор антирецидивной терапии ММ в перспективе планируемой беременности.
Также остаются неизученными особенности микробиоты матки, способной влиять на репродуктивный потенциал женщины. В России имеются исследования, в которых с целью оптимизации оперативного лечения ММ предлагается оценивать микробный спектр удаленных миоматозных узлов и их ложа [6]. Известно, что миоматозный узел и его ложе, неизмененный миометрий могут быть контаминированы, например, неклостридиальными анаэробными бактериями. Однако рекомендаций по обязательной интраоперационной диагностике флоры удаленных миоматозный узлов и их ложа у женщин, планирующих беременность, нет.
Цель исследования – оценить роль микробиоты ложа миомы матки в тканевой регенерации миометрия после органосохраняющего лечения миомы матки.
Материал и методы
Проведено проспективное нерандомизированное контролируемое когортное исследование женщин с миомой матки (ММ), у которых после лапароскопического органосохраняющего лечения ММ, проведения персонифицированной прегравидарной подготовки спонтанно в естественном менструальном цикле наступила и прогрессировала беременность (n=150).
Интраоперационно из ложа удаленного миоматозного узла забирался материал для идентификации микроорганизмов, использовался времяпролетный масс-анализатор (MALDI-TOF MS, Bruker (Германия) с применением системы Microflex LT (BrukerDaltonics, Германия), прибор автоматизированного микробиологического посева WASP (Copan, Италия), автоматический бактериологический анализатор VITEK 2 (BioMerieux, Франция), анализатор антибиотикограмм диско-диффузного метода «АДАЖИО» (BioRad, Франция). Материал доставлялся в лабораторию в одноразовых пластиковых контейнерах фирмы Copan с жидкой транспортной средой, которая обеспечивала жизнеспособность возбудителей до 72 часов.
Непосредственно после хирургического лечения ММ индивидуально подбиралась и назначалась антирецидивная терапия ММ. Исходя из наличия «свежего» рубца на матке после миомэктомии, с целью контрацепции и тканевой регенерации миометрия были индивидуально подобраны и назначены комбинированные оральные контрацептивы (КОК) длительностью не менее 12 месяцев.
Анализ полученных данных основывался на применении статистических пакетов Statistica 12.0, Microsoft Excel 2013. Описательная статистика включала среднее значение (M), стандартное отклонение (SD), медиану (Ме), минимальное (Min) и максимальное (Maх) значение.
Для оценки значимости различий исходов исходя из полученных данных определялся критерий Хи-квадрат (χ2). Критерием оценки силы связи между фактором риска и исходом являлись критерии φ, V Крамера и К Чупрова [7]. При числе наблюдений менее 10 определялся критерий Хи-квадрат с поправкой Йейтса. Достоверность различий (р) оценивалась по t-критерию (Стьюдента).
Для определения порогового значения изучаемых параметров, определения направленности (риска) исхода (осложнений гестации) выполнялось построение ROC-кривой и определение оптимальной точки отсечения (optimal cut-off point).
Результаты и обсуждение
Средний возраст женщин составил 29,05±0,33 (Ме=28) года. Длительность заболеванием ММ 3,03±0,22 (Ме=4) года. Возраст, в котором впервые была диагностирована ММ - 25,91±0,22 (Ме=26) года и 25,23±0,22 (Ме=26) года. Оказалось, что до включения в настоящее исследование ни одна женщин не получала полноценной терапии ММ. Патогномоничный для ММ болевой синдром был диагностирован у 27,33% (n=41) женщин, нарушение трофики миоматозного узла – у 12% (n=18), нарушение функции соседних органов - у 10% (n=15) женщин, менструально-овариальной функции - у 84% (n=126) женщин.
Количество удаленных на одну женщину миоматозных узлов составило при субсерозно-интерстициальной локализации 1,2±0,04, при интерстициальной - 1,16±0,06. Размер наибольшего удаленного миоматозного узла составлял 150 мм. Локализация миоматозных узлов в области сосудистых пучков матки, шеечно-перешеечная локализация, например, и клинически незначимый размер ММ в ряде случаев не позволяли выполнить миомэктомию. Размер миоматозных узлов, оставшихся после органосохраняющего хирургического лечения ММ, составлял 15,81±2,68 мм. Общее число оставшихся миоматозных узлов варьировало от 1 до 5.
Представлял значительный интерес микробный состав отделяемого из ложа удалённого миоматозного узла (таблица, рис. 1). Согласно рабочей гипотезе, при субсерозной и субсерозно-интерстициальной локализации миоматозного узла микрофлора не должна выявляться. В результате проведенного исследования было установлено, что согласно используемым нами методам исследования только у 16% женщин микрофлора отсутствовала. У наибольшего количества женщин выявлялся один (27,73%) или два (37,73%) возбудителя. Количество женщин, у которых в миоматозных узлах было выявлено три возбудителя, было сопоставимо с теми, у кого возбудитель не был идентифицирован: 14,67% vs. 16%. У 4,67% (n=7) женщин было выделено четыре возбудителя.
Наиболее часто выявлялись Peptococcus sp. и Pepto-streptococcus sp. (рис. 2). Bacteroides sp., Fusobacterium sp., Eubacterium sp. Выявлялись значительно реже. E. coli была выявлена только однократно, у одной женщины с интерстициально-субсерозной локализацией узла.
Преимущественно определялся минимальный титр выделенных микроорганизмов (101-3КОЕ). Тем не менее согласно рекомендациям клинического фармаколога 34% (n=51) женщине потребовалось назначение антибактериальной терапии. Полученный результат продемонстрировал риск недостаточного обследования женщины, которой производится миомэктомия без интраоперационного забора материала для идентификации микробиоты ложа удаленного миоматозного узла.
Микробиота, выделенная из ложа уделенного миоматозного узла
|
Вид микроорганизма |
Количество выделенных микроорганизмов |
Всего (n/%) |
|||
|
Один n=41 (27,73%) |
Два n=56 (37,73%) |
Три n=22 (14,67%) |
Три и более n=7 (4,67%) |
||
|
Peptococcus sp. |
21 |
27 |
9 |
2 |
59 (39,33%) |
|
Pepto-streptococcus sp. |
16 |
24 |
8 |
1 |
49 (32,67%) |
|
Bacteroides sp. |
2 |
2 |
2 |
1 |
7 (4,67%) |
|
Fusobacterium sp. |
1 |
1 |
1 |
0 |
3 (2%) |
|
Eubacterium sp. |
1 |
2 |
2 |
2 |
7 (4,67%) |
|
E. coli |
0 |
0 |
0 |
1 |
1 (0,67%) |
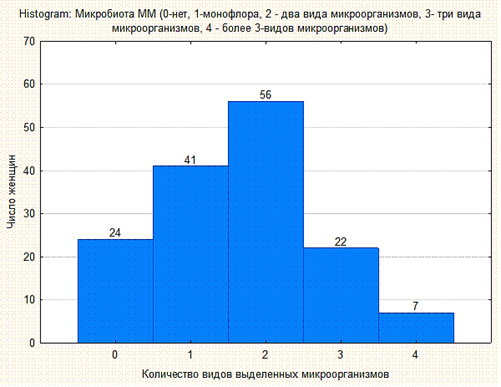
Рис. 1. Количество женщин с различным числом микроорганизмов, выделенных из удаленного миоматозного узла
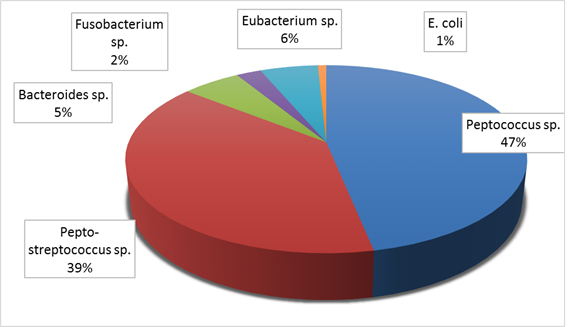
Рис. 2. Частота выявления отдельных микроорганизмов в удаленном миоматозном узле
Дизайн настоящего исследования не позволил установить этиопатогенетические пути контаминации миоматозного узла и его ложа. До настоящего времени микробиота женского организма остается предметом изучения и острой дискуссии. Крайне сложно утверждать, является ли наличие микроорганизмов следствием длительной персистенции инфекции в миометрии, каков ее вклад в развитие миомы матки, нарушение фертильности или их комбинации. Учитывая безупречное соблюдение всех современных норм асептики и антисептики при хирургическом лечении миомы матки, трудно допустить возможность данной контаминации вследствие оперативного вмешательства. Выявление микроорганизмов в удаленном миоматозном узле и его ложе требуют дальнейшего изучения совместно с микробиологами, фармакологами, что, вероятно, повысит эффективность терапии миомы матки и обусловленного с ней нарушения фертильности женщины.
При оценке возраста рубца после миомэктомии и прекращения приёма КОК выяснилось, что его средние значения составляли 15,93±1,8 месяца (Ме=16,0, Min-Max=12-22 месяца).
Число потенциально фертильных менструальных циклов после отмены КОК в среднем составило 3,58±1,83 (Ме=3,0, Min-Max=1-8).
При оценке исхода беременности и родов у женщин, учитывая наличие выделенных в миоматозном ложе микроорганизмов, получены следующие данные.
На основании ROC-анализа установлено, что в I триместре беременности начавшийся самопроизвольный выкидыш ассоциирован с возрастом рубца на матке после миомэктомии, точка отсечения соответствовала 12 месяцам, с точкой отсечения максимального размера удалённого миоматозного узла 100 мм.
Во II триместре беременности начавшийся самопроизвольный выкидыш также сопряжен с возрастом рубца на матке после миомэктомии, точка отсечения составляла 15 месяцев. При оценке связи между максимальным размером удалённого при миомэктомии миоматозного узла и риском начавшегося самопроизвольного выкидыша во II триместре беременности установленная точка отсечения соответствовала 60 мм.
В III триместре беременности доля женщин с угрожающими преждевременными родами (ПР) составила 22,67%. При оценке связи риска угрожающих ПР в III триместре беременности с максимальным размером удалённого миоматозного узла выяснилось, что точка отсечения соответствовала 70 мм.
Частота преждевременного разрыва плодных оболочек (ПРПО) составила 2,67%, срок беременности - 37,5±0,29 недели. Установлено, что у всех женщин с ПРПО при выполнении миомэктомии было выделено 3 и более видов микроорганизмов в ложе миоматозного узла. Вероятно, несмотря на проведенную антибактериальную терапию в послеоперационном периоде, полной элиминации патогенной микробной флоры в матке не произошло, что могло быть причиной инфицирования плодовых оболочек и их преждевременного разрыва.
В настоящем исследовании, несмотря на общепринятые показания к родоразрешению женщин после органосохраняющего лечения ММ путем кесарева сечения в случае вскрытия полости матки и/или осложнённого течения послеоперационного периода, наличием видеопротоколов выполненной лапароскопической миомэктомии, протоколов операции, отражающих локализацию, размеров узлов, способа восстановления миометрия, только у 54% (n=81) женщин родоразрешение было произведено путем кесарева сечения. Субсерозная или субсерозно-интерстициальная ММ с локализацией по передней стенке матки, зрелость шейки матки не менее 8 баллов по шкале Бишопа при начале родовой деятельности позволяли вести роды через естественные родовые пути с постоянным контролем кардиотокографии плода и сократительной активности матки.
При родоразрешении, потребовавшем лапаротомии и кесарева сечения, рубец на матке после миомэктомии в виде незначительного дефекта миометрия визуально определялся только у женщин у 8%. Таким образом, риски несостоятельности рубца на матке после лапароскопической миомэктомии, потребовавшие родоразрешения путем операции кесарева сечения, были завышены, представляют повод для сомнений и дискуссии.
На основании анализа с применением четырёхпольных таблиц была установлена сильная связь между отсутствием проведения прегравидарной подготовки и рубцовой деформацией миометрия в области лапароскопической миомэктомии: критерий Хи-квадрат с поправкой Йейтса=91.536 (p<0,01), критерии оценки силы связи между фактором риска и исходом=0,709 (сильная связь).
При оценке связи между количеством микроорганизмов, выделенных из ложа удаленного при миомэктомии миоматозного узла, и наличием дефекта миометрия, визуализируемого при кесаревом сечении, была установлена достоверная связь, точка отсечения = 4. Таким образом, наличие более трёх микроорганизмов, выделенных из ложа удалённого миоматозного узла, несмотря на проводимые прегравидарные и преконцепционные лечебные мероприятия, ассоциировано с нарушением тканевой регенерации в области миомэктомии, которое сохранится до последующей беременности и может явиться причиной дефекта миометрия.
Заключение. В настоящем исследовании доказана необходимость прегравидарных подходов у женщин, требующих выполнения миомэктомии. Идентификация микробиоты ложа удаленного миоматозного узла сопоставима по значимости с необходимостью тщательного восстановления целостности матки, с профилактикой несостоятельности рубца на матке и/или спаечного процесса в малом тазу после миомэктомии.
Микробиота ложа миоматозного узла является крайне неизученным вопросом, учитывая реальные риски для неполноценной тканевой регенерации после миомэктомии у женщин, планирующих беременность. Отсутствие представлений о микробном составе отделяемого из ложа миоматозного узла при миомэктомии не позволяет индивидуально определять необходимость проведения антибактериальной терапии и персонифицированного выбора фармакологических препаратов. Эмпирическая антибактериальная терапия крайне не желательна, так как представляет риски дисбиоза на локальном и организменном уровнях, при отсутствии миокрофлоры - вредоносна. Таким образом, диагностика микробиоты ложа миоматозного узла должна выполняться рутинно, быть обязательной при миомэктомии у женщин, планирующих беременность.
Библиографическая ссылка
Хорольский В.А., Новикова В.А. РОЛЬ МИКРОБИОТЫ ЛОЖА МИОМЫ МАТКИ В РЕГЕНЕРАЦИИ МИОМЕТРИЯ И ОСЛОЖНЕНИЯХ ГЕСТАЦИИ ПОСЛЕ МИОМЭКТОМИИ // Современные проблемы науки и образования. 2018. № 4. ;URL: https://science-education.ru/ru/article/view?id=27818 (дата обращения: 12.02.2026).



