В патогенезе осложнений дентальной имплантации важную роль играет реакция на неё иммунной системы [1]. Имплантация вызывает состояние вторичного иммунодефицита, определяемое в первую очередь на организменном уровне [2]. T.J. Giusto, D.J. Conover (2015) проведены исследования, доказывающие генерализованные нарушения функции клеточного и гуморального иммунитета при имплантации [3; 4]. Активность иммунокомпетентных клеток определяет не только предупреждение развития гнойно-некротических изменений тканей, но и процессы эпителизации, ангиогенеза, образования интимных связей имплантата с окружающими тканями [5]. Эти клетки являются регуляторами процессов регенерации. При этом имеются только единичные исследования, посвященные местным факторам иммунной защиты [6-8]. Мониторинговые исследования по изучению сравнительной характеристики местного иммунного статуса при дентальной имплантации практически отсутствуют, а имеющиеся работы выполнены преимущественно в эксперименте на животных [9-11], что определило выбор направления наших исследований.
Цель настоящего исследования заключается в мониторинге изменений локального иммунного гомеостаза слизистой оболочки рта в динамике интеграции имплантатов после дентальной имплантации.
Материал и методы. Исследование проведено в период с 1991 по 2016 год с учётом положений Хельсинкской декларации (с информированного согласия пациентов или, в случае недееспособности, опекунов (2000)), с позволения этического комитета ФГАОУ ВО «Дальневосточный федеральный университет». Все пациенты осмотрены в соответствии с протоколами заполнения медицинских карт стоматологических больных формы № 043/у. По результатам клинического осмотра при необходимости по клиническим показаниям производили забор материала СОР у мужчин, распределённых с учётом возрастных групп, принятых ВОЗ от 16.01.2016. Анализ материала больных проведён с учётом возрастной динамики и длительности сопутствующего заболевания в анамнезе. В обследовании участвовали 123 мужчины в возрастных группах от 20 до 85 лет, имеющие локальные и генерализованные дефекты зубных рядов на фоне атрофии челюстей, с экстирпацией зубов, или потерявших зубы после травм челюстно-лицевой области. В контрольную группу были включены пациенты с частичной адентией без атрофии челюстей после травм (табл. 1).
Таблица 1
Распределение пациентов с патологией
|
Группа контроля |
Молодой возраст |
Средний возраст |
Пожилой возраст |
Старческий возраст |
Долголетие |
|
20-44 лет |
18-44 года |
45-59 лет |
60-74 лет |
75-90 лет |
Старше 90 лет |
|
11 |
23 |
45 |
28 |
14 |
1 |
|
Итого: |
122 |
||||
В качестве контроля исследована СОР мужчин без сопутствующей патологии, утративших в результате травмы один или несколько зубов сразу после травмы, или в период проведения имплантации, так как у женщин показатели СОР имеют зависимость от циркадных ритмов [12].
Всем больным по клиническим показаниям были проведены одно и двухэтапные операции дентальной имплантации. Нами были использованы системы различных имплантатов, которые имеют регистрацию в РФ (Astra Tech, Nobel Bio Care, Bego Semados, Conmet, Alfa Bio, OnewayBiomed), с соблюдением хирургических протоколов операций, утвержденных производителем. Имплантаты применяли для классической двухэтапной и одноэтапной методики имплантации. На современном этапе согласно рекомендациям ВОЗ применяли преимущественно винтовые имплантаты. Морфологические исследования проводили непосредственно после удаления зубов или их корней, имплантации и микрохирургических пародонтологических операций, до и после установки имплантатов способом иссечения фрагментов слизистой оболочки, покрывающей десну объемом 0,5-1 мм3. Забор материала производился во время хирургической или в ранние сроки после травматической экстирпации зубов, при установке имплантатов и формирователей десны, всего изучено 362 среза. Также материал забирали во время подготовки пациента к установке имплантатов (при коррекции атрофии челюстей) и в случае отторжения имплантатов (4 случая за период с 2011 по 2015 г.) для получения полной характеристики взаимодействия эффекторных иммуноцитов в слизистой оболочке рта.
Анализ биопсий проведён с использованием рутинных методик (классического окрашивания гематоксилином и эозином, по Ван Гизону, Victoria blue, по Браше и толуидиновым синим), а также фазовоконтрастной микроскопии. Основными методами морфологических исследований явились иммуногистохимические, с фенотипированием иммуноцитов на основе кластеров дифференцировки (Cluster of Differentiation – CD) - T-лимфоцитов CD4/8, CD34, клеток Лангерганса СD68, интерстициальных макрофагов СD163, тучных клеток CD203a. Интенсивность пролиферативной активности в эпителиальной пластинке оценивалась по индексу митотических ядер с помощью выявления локализации маркера Ki-67 и подсчётом количества митозов на 100 клеток. Апоптоз изучен Тunel методом для световой микроскопии, а для изучения апоптических процессов при подготовке рта и при имплантации получена характеристика локализации р53. Также исследован ассоциированный с проапоптическими факторами маркер ранней клеточной дифференцировки р63. Для статистической обработки результатов использовали специальный пакет прилагаемых компьютерных программ к микроскопу фирмы Olympus Bx52.
Результаты и обсуждение
Мониторинг состояния локального иммунного гомеостаза и пролиферации у пациентов на фоне дентальной имплантации позволил установить, что у пациентов старших возрастных групп наблюдаются изменения характера ороговения: с одной стороны, развивался гиперкератоз, носивший, как правило, защитный характер, с другой - появлялись признаки атрофии и уменьшение рогового слоя в области жевательной поверхности десны и со стороны преддверия рта. Как и в исследованиях Woo S.B., Lin D. [13], наблюдалось нарушение гистоархитектоники слизистой оболочки при гиперкератозе у пациентов старших возрастных групп, что свидетельствовало о нарушениях процессов дифференцировки, а при развитии атрофии – процесса десквамации эпителия. При этом уменьшается пролиферативная активность кератиноцитов, уменьшается плотность микроциркуляторного русла в собственной пластинке слизистой оболочки (рис. 1).
.  а
а 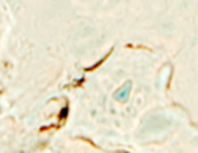 б
б 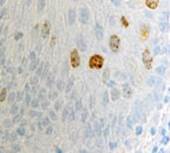 в
в
 г
г 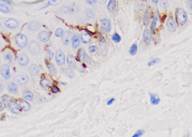 д
д 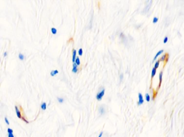 е
е
Рис. 1. Слизистая оболочка десны человека: а - безъядерные эпителиоциты у пациентов до 40 лет; б - эпителиоциты у пациентов старше 40 лет; в, г - выявление локализации Ki67;
д - CD68, е - CD34. Микрофото, ув. 200
Безъядерные эпителиальные клетки, идентифицирующиеся в группах до 40 лет, свидетельствуют о нормальных процессах дифференцировки, кератинизации и слущивания. В возрастной группе старше 40 лет увеличивается количество эпителиоцитов, находящихся в состоянии паракератоза, в то время как регенераторный потенциал лучше выражен в группе до 40 лет. Он снижается с возрастом, о чём свидетельствует наличие единичных пролиферирующих клеток в базальном слое эпителия в группах у пациентов старше 40 лет. Антигенпрезентирующие клетки идентифицируются в камбиальных слоях эпителия – базальном и шиповатом, что говорит о высоких барьерных свойствах эпителия. Локализация CD34 показала наличие кровеносных капилляров, максимальное количество которых в поле зрения достигало трёх. Вокруг сосудов отсутствовала инфильтрация лейкоцитов.
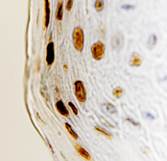
Апоптозирующие клетки идентифицируются исключительно в поверхностных слоях, в то время как проапоптические факторы локализуются в шиповатом слое, что свидетельствует о репрессии в геноме локусов, отвечающих за пролиферацию. Макрофаги CD68 выявляются как в эпителиальном слое, преимущественно в базальном слое, так и в прилежащей к эпителию собственной пластинке соединительной ткани (рис. 2).
 а
а 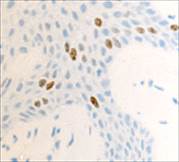 б
б 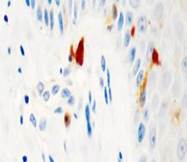 в
в
 г
г  д
д
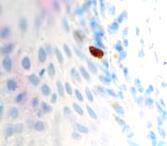
Рис. 2. Слизистая оболочка рта: а - Tunel-позитивные клетки, б - р53; в - CD163, г - CD4, д - CD8. Микрофото, ув. 200
Соотношение идентифицирующихся эффекторных иммуноцитов CD4 и CD8 (3:1) показало, что локальный иммунный гомеостаз соответствует показателям у здоровых лиц, принятым, по данным большинства исследователей, в качестве возрастной нормы. Расположение специфических Т-супрессоров, способных подавлять иммунный ответ вне зависимости от антигена, в шиповатых слоях эпителия соответствует одной из их главных функций – регуляции клеточной пролиферации.
По анализу результатов морфологического исследования биоптатов слизистой оболочки рта у больных контрольной группы была составлена модель, отражающая нормальное состояние локального иммунного гомеостаза у пациентов без сопутствующей патологии (табл. 2).
Таблица 2
Исходные показатели иммунного гомеостаза слизистой оболочки рта в возрастном аспекте без сопутствующей патологии при обращении и в начале лечения
|
Возраст, лет |
Кол-во клеток в поле зрения (M±m) |
МИ |
||||
|
CD163+ |
CD4+/8+ |
CD68+ |
CD203а+ |
CD34 |
||
|
18-34 |
1,59±0,45 |
1,51±0,12 |
1,09±0,22 |
1,37±0,11 |
1,13±0,07 |
5,47±0,21 |
|
35–59 |
1,39±0,12 |
1,50±0,14 |
1,47±0,08 |
1,34±0,11 |
1,41±0,10 |
9,95±0,51 |
|
59-74 |
1,31±0,07 |
1,31±0,12 |
0,81±0,05 |
1,56±0,14 |
0,91±0,07 |
3,57±0,23 |
|
75-90 |
1,15±0,09 |
1,26±0,05 |
0,75±0,03 |
1,42±0,06 |
0,76±0,03 |
2,89±0,17 |
|
Более 90 лет |
0,71±0,03 |
0,92±0,07 |
0,65±0,02 |
0,96±0,06 |
0,55±0,03 |
2,61±0,15 |
* Различия данных в возрастных группах являются статистически значимыми (p<0,01).
Примечание. Приведены исходные данные в момент обращения (над чертой) и в начале лечения (под чертой).
Данные таблицы для лучшей наглядности отражены в диаграммах для сравнения количественных показателей с единицей площади (рис. 3, 4). Указана динамика количественных и качественных изменений слизистой оболочки, отражающая мониторинг иммуноцитов и пролиферативной активности в возрастном аспекте.
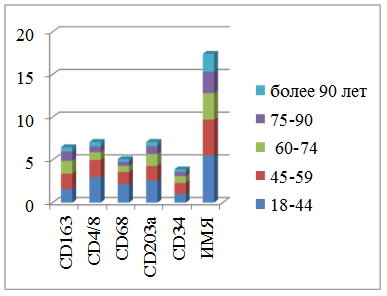
Рис. 3. Показатели иммунного гомеостаза (ИГ) слизистой оболочки рта. Различия данных в возрастных группах являются статистически значимыми (p<0,01)
Как и в работах других авторов, морфологический анализ при исследовании слизистой оболочки рта показал, что у пациентов без сопутствующей соматической, онкологической, эндокринной и стоматологической патологии, в условиях сохранных зубных рядов, пласт эпителиоцитов представлен 24–27 слоями клеток, базальная мембрана эпителия СОР волнистая, что согласуется с данными Bodineau A., Folliguet M., Séguier S. (2009) [14]. Соединительная ткань собственной пластинки слизистой оболочки однородная, представлена плотно скомпонованными коллагеновыми волокнами с незначительным количеством мелких капилляров и редко идентифицирующимися макрофагами и Т-лимфоцитами. В базальных и поверхностных пластах эпителия контакты между клетками плотные, не идентифицируются межклеточные щели. Микроциркуляторное русло (МЦР) представлено немногочисленными капиллярами, выстланными плоским эндотелием, с отсутствующей перикапиллярной инфильтрацией лейкоцитами. Динамика регенераторного потенциала структур слизистой оболочки в возрастном аспекте представлена на рис. 4.
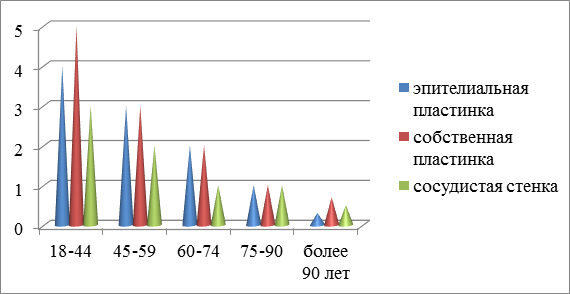
Рис. 4. Динамика регенераторного потенциала структур слизистой оболочки в возрастном аспекте. Различия данных в возрастных группах являются статистически значимыми (p<0,01)
Заключение. В целом в наших наблюдениях, как и у других авторов [15; 16], у пациентов с возрастом отмечается снижение регенераторного потенциала кератиноцитов, уменьшение количества эффекторных иммуноцитов, что свидетельствует об общей тенденции к снижению барьерных свойств эпителиальной пластинки слизистой оболочки рта. Уменьшение количества функционирующих капилляров и снижение плотности МЦР у пожилых и долгожителей является причиной снижения трофического обеспечения тканей пародонта, что ведёт к атрофии костной ткани челюстей [17].
Анализ полученных данных позволил составить дополнения к принятому в челюстно-лицевой хирургии алгоритму клинической диагностики и обследования пациентов. Так, стандартное обследование было дополнено диагностическими мероприятиями для выявления состояния иммунного гомеостаза слизистой оболочки на основе исследования биоптатов слизистой оболочки рта с предварительным применением метода фазово-контрастной микроскопии. При выявлении количественных морфологических признаков изменений показателей иммунного гомеостаза в сравнении с предложенной моделью, отражающей среднестатистические нормальные возрастные показатели пролиферативной активности кератиноцитов и соотношение эффекторных иммуноцитов, а также плотность МЦР в собственной пластинке слизистой рта, следует планировать тактику дальнейших мероприятий с предварительной иммуномодулирующей корректировкой метода лечения.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственных заданий 2014/36 от 03.02.2014 г., 17.5740/2017/6.7 и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.).
Библиографическая ссылка
Рева Г.В., Толмачёв В.Е., Кулаков А.А., Калинин И.О., Красников Ю.А., Индык М.В., Ким А.Р., Восканян О.Г., Рева И.В. ФЕНОТИПИРОВАНИЕ ИММУНОЦИТОВ СЛИЗИСТОЙ ОБОЛОЧКИ РТА В ДИНАМИКЕ ДЕНТАЛЬНОЙ ИМПЛАНТАЦИИ // Современные проблемы науки и образования. 2018. № 2. ;URL: https://science-education.ru/ru/article/view?id=27528 (дата обращения: 01.01.2026).
DOI: https://doi.org/10.17513/spno.27528



