Успехи в современной онкологии позволили достигнуть значимых результатов в лечении рака молочной железы. Полихимиотерапия как компонент лечения обладает гонадотоксичным действием и зачастую ведет к снижению фертильности [1; 2]. Большинство больных с начальными стадиями заболевания имеют относительно благоприятный прогноз и удлиненные сроки выживаемости. Возрастает доля пациенток репродуктивного возраста, которые перенесли онкологическое заболевание и имеют желание продолжать полноценную жизнь. Поэтому поиск особо оптимальных, безопасных и эффективных методов сохранения и восстановления репродуктивной функции у онкобольных остается на сегодняшний день актуальной задачей. Известно, что в токсических осложнениях применения противоопухолевых средств важные роли принадлежат реакциям свободнорадикального окисления, приводящим к оксидативной модификации белков и липидов [3-5]. Регуляцию меняющейся в этом случае в окислительную сторону интрацеллюлярной среды выполняют разные редокс-буферы, наиважнейшим из которых является система глутатионa, принимающая участие в утилизации активных форм кислорода и перекисных соединений. Следовательно, внутриклеточный уровень восстановленной изоформы глутатиона и ферментов, участвующих в его обмене, является маркёром активности оксидативных процессов и, таким образом, устойчивости самой клетки к токсическому повреждению [6]. Ксимедон обладает широким спектром терапевтического действия, в том числе регенераторным, антиоксидантным, апоптозрегулирующим и антиишемическим эффектами [7]. Мексидол также обладает широким спектром терапевтического действия, и прежде всего антиоксидантным и антиишемическим. Ранее показано, что мексидол не уменьшает эффективность противоопухолевой терапии, а ксимедон даже способствует потенцированию антибластомного эффекта комбинации «доксорубицин + паклитаксел» в эксперименте [4; 5; 8]. Однако проявления овариопротекторных свойств ксимедона и мексидола, а также их комбинации при антибластомной химиотерапии остаются неизученными.
Цель исследования – оценка изменений в пероксидации липидов (ПОЛ) и системе глутатиона яичниковой ткани крыс с карциномой Walker-256 под действием дериватов пиримидина и 3-гидроксипиридина – ксимедона и мексидола при антибластомной химиотерапии с использованием схемы «доксорубицин + паклитаксел».
Материал и методы исследования. Исследования выполнялись на 87 самках-крысах линии Вистар весом 150-250 граммов, полученных из питомника НЦБМТ «Столбовая». Подопытных крыс содержали в стандартизированных условиях вивария Мордовского государственного университета с использованием естественного светового режима и стандартной диеты, при свободном доступе к воде и пище. Все процедуры с животными выполнялись согласно правилам «Руководства по уходу и использованию лабораторных животных» (Guide for the care and use of laboratory animals) [9]. Взвесь клеток опухоли Walker-256 (W-256) (1 млн клеток в готовом растворе Хэнкса) вводили подкожно в область хвоста. Было выделено 6 групп животных. Дизайн эксперимента представлен в табл. 1.
Таблица 1
Дизайн эксперимента
|
Группы крыс |
Режим исследования |
|
интактные крысы (n=7) |
клетки опухоли W-256 не вводились и лекарственную терапию не проводили |
|
1-я – животные с опухолевым штаммом W-256 (контроль) (n=12) |
1 млн клеток штамма W-256 инъецировали под кожу в область хвоста |
|
2-я – животные с W-256 с лечением доксорубицином – W-256+Д (n=12) |
1 млн клеток штамма W-256, доксорубицин в дозировке 4 мг/кг внутрибрюшинно однократно на 11-е сутки от момента введения опухоли |
|
3-я – животные с W-256 с лечением доксорубицином и паклитакселом – W-256+Д+П (n=14) |
1 млн клеток штамма W-256, доксорубицин и паклитаксел в дозировках 4 и 6 мг/кг соответственно, внутрибрюшинно однократно на 11-е сутки от момента введения опухоли |
|
4-я – животные с W-256 с лечением доксорубицином, паклитакселом, ксимедоном – W-256+Д+П+К (n=14) |
химиотерапия по аналогии с 3-й группой, ксимедон в дозировке 100 мг/кг ежедневно внутримышечно 10 дней, начиная с 11-х суток опыта |
|
5-я – животные с W-256 с лечением доксорубицином, паклитакселом, мексидолом – W-256+Д+П+М (n=14) |
химиотерапия по аналогии с 3-й группой, мексидол в дозировке 50 мг/кг ежедневно внутримышечно 10 дней, начиная с 11-х суток опыта |
|
6-я – животные с W-256 с лечением доксорубицином, паклитакселом, мексидолом, ксимедоном – W-256+Д+П+М+К (n=14) |
химиотерапия по аналогии с 3-й группой, мексидол и ксимедон в дозировках 50 и 100 мг/кг соответственно, ежедневно внутримышечно 10 дней, начиная с 11-х суток опыта |
Субстанцию ксимедона производства ФГУП НИИ «Кристалл» (Россия) использовали в дозировке 100 мг/кг (6% от LD50) в виде 10% раствора на изотоническом растворе хлористого натрия, официнальную лекарственную форму мексидола («Фармасофт», Россия) – в дозировке 50 мг/кг (6% от LD50) в виде 5% раствора. Следовательно, использованные дозы явились изотоксичными [10; 11]. Исследуемые параметры оценивали на 14-й и 22-й дни эксперимента. С этой целью 6-7 крыс в каждой из групп в указанное время подвергали эвтаназии с применением общей анестезии (тиопентал натрия). Оценку изменений в процессах ПОЛ в гомогенате яичников проводили спектрофотометрическим методом по содержанию диеновых и триеновых конъюгатов (ДК и ТК), оснований Шиффа (ОШ) [12], уровня малонового диальдегида (МДА) (в реакции с тиобарбитуровой кислотой с применением соответствующих реактивов («Агат-Мед», Москва)); оценку изменений в системе глутатиона проводили по концентрации восстановленной изоформы глутатиона (ВИГ) [13], активности глутатионоредуктазы (ГР) [14], глюкозо-6-фосфатдегидрогеназы (ГФДГ) (с применением реактивов фирмы Sentinel, Италия). В процессе статистического анализа полученных результатов вычисляли показатели значений средних арифметических (М), а также стандартных ошибок при вычислении средних арифметических (m). Нормальность распределения устанавливали при помощи теста Колмогорова-Смирнова. В случае соответствия нормальности распределения достоверность выявленных различий сравниваемых величин оценивали при помощи t-критерия Стьюдента. В случае несоответствия данному критерию достоверность выявленных отличий оценивали с помощью U-критерия Манна-Уитни. Различия считались достоверными, если p<0,05.
Результаты исследования и их обсуждение. Показатели ДК и ТК в целом не претерпевали достоверных изменений в динамике липопероксидации при оценке цитостатической овариотоксичности и ее снижении при введении ксимедона и мексидола. На 14-й день эксперимента во 2-й экспериментальной группе (с химиотерапией Д) уровень МДА не различался с таковым у интактных животных, но превышал показатель в контроле на 51,7%. При этом содержание ОШ достоверно превышало исходный уровень интактных крыс на 65,5% (рис.) и на 62,7% - относительно контроля. В 3-й группе (при терапии Д+П) был отмечен достоверный рост концентраций МДА и ОШ на 25,8% и 70,7% соответственно в отношении интактных крыс, и на 53,9% и 67,8% по сравнению с контролем (рисунок).
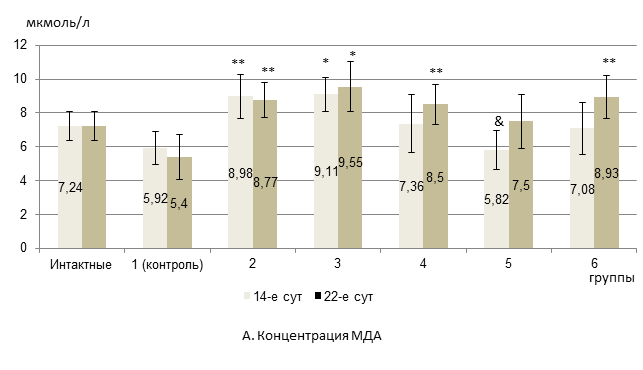
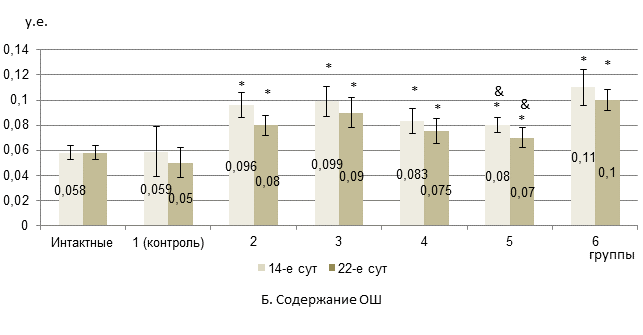
*- достоверные различия в сравнении с интактной группой (р<0,05);
**- достоверные различия в сравнении с группой 1 (контроль) (р<0,05);
&- достоверные различия в сравнении с группой 3 (р<0,05).
Содержание продуктов пероксидации липидов в яичниках крыс с карциномой W-256 под воздействием ксимедона и мексидола при антибластомной химиотерапии по схеме «доксорубицин + паклитаксел» (А-Б)
В 4-й группе (с дополнительным введением ксимедона) уровень МДА был таким же, как у интактных крыс, однако содержание ОШ достоверно превышало исходный показатель на 43% (рис.). В 5-й группе (с дополнительным введением мексидола) отмечалось достоверное падение концентрации МДА на 36% по отношению к 3-й группе при отсутствии различий с исходом. Содержание ОШ также достоверно снижалось на 19,2% по сравнению с 3-й группой. При этом по сравнению с интактными крысами уровень ОШ превышал на 37,9%. У крыс 6-й группы (при сочетании ксимедона и мексидола) отмечалось повышение концентрации ОШ на 89,6% относительно интактных крыс (рис.). При этом уровень МДА не отличался от исходного показателя.
На 22-й день исследований во 2-й экспериментальной группе отмечали повышение уровня ОШ на 37,9% по сравнению с интактными животными (рис.). При этом в сравнении с 14-ми сутками содержание ОШ снижалось на 16,7%. В 3-й группе концентрация МДА и ОШ превышала соответствующие показатели у интактных животных на 31,9% и 55% соответственно, что не отличалось от 14-х суток опыта. В 4-й группе уровень МДА не отличался от исходного показателя, а содержание ОШ достоверно превышало таковое в интактной группе на 29,3%. В 5-й группе концентрация МДА не отличалась от исходного показателя, а содержание ОШ не только превышало таковое в интактной группе на 20,7%, но и достоверно снижалось в сравнении с 3-й группой на 22,2% (рис.). У крыс 6-й группы содержание МДА не различалось с исходным параметром, а ОШ – увеличивалось на 72,4% в сравнении с интактными крысами, не отличаясь от показателя на 14-е сутки опыта. Таким образом, мексидол в отличие от ксимедона способствовал более эффективному торможению накопления продуктов липопероксидации в яичниках, так как достоверно ограничивал рост уровня не только МДА, но и ОШ в сравнении с группой 3 в течение всего исследования.
Концентрация ВИГ в контрольной группе на 14-е сутки эксперимента снижалась на 30,2% на фоне падения активности ГР на 65,9% относительно интактных животных (табл. 2). Во 2-й группе отмечалось лишь снижение активности ГФДГ на 25,2% относительно интактных крыс. В 3-й группе концентрация ВИГ снижалась на 26,6% относительно интактных животных в комбинации со снижением активностей ГР и ГФДГ на 72,3% и 29,13% соответственно. В 5-й и 6-й группах уровень ВИГ достоверно повышался на 20,97% и 14,5% соответственно по отношению к 3-й группе, однако не достигал исходного уровня. При этом в 5-й группе увеличивалась активность ГР в 2 раза относительно 3-й группы, оставаясь ниже исхода, а ГФДГ – на 39,8% (до исходного уровня). В 6-й группе более значимо повышалась только активность ГР – в 3 раза относительно 3-й группы, активность ГФДГ была на 35,1% ниже интактного параметра и не отличалась от уровня 3-й группы. В 4-й группе концентрация ВИГ не отличалась от показателя в 3-й группе и была ниже исхода на 16%. При этом активность ГР возрастала на 92,3% по отношению к 3-й группе, оставаясь ниже исхода, а активность ГФДГ возрастала на 34,3%, достигая исходного уровня (табл. 2).
Таблица 2
Изменение показателей восстановленной изоформы глутатиона, активности глутатионоредуктазы и глюкозо-6-фосфатдегидрогеназы яичниковой ткани крыс с карциномой W-256 под действием ксимедона и мексидола при антибластомной химиотерапии по схеме «доксорубицин + паклитаксел» (M±m)
|
Показатель / Сроки исследования |
Группы животных |
|||||||
|
Интактные |
1 |
2 |
3 |
4 |
5 |
6 |
||
|
ВИГ, ммоль/г ткани |
14-е сутки |
1,69± 0,05 |
1,18± 0,1* |
1,47± 0,09 |
1,24± 0,06* |
1,42± 0,05* |
1,5± 0,06*& |
1,42± 0,03*& |
|
22-е сутки |
1,69± 0,05 |
1,2± 0,07* |
1,3± 0,1* |
1,07± 0,02*▼ |
1,42± 0,04*& |
1,3± 0,05*&▼ |
1,84± 0,08&#▼ |
|
|
ГР, ммоль/ мин•г ткани |
14-е сутки |
0,047± 0,005 |
0,016± 0,002* |
0,048± 0,006** |
0,013± 0,004* |
0,025± 0,001*& |
0,026± 0,002*& |
0,04± 0,003**#& |
|
22-е сутки |
0,047± 0,005 |
0,0128± 0,002* |
0,026± 0,004* |
0,018± 0,002* |
0,027± 0,003*& |
0,025± 0,002*& |
0,028± 0,003*&▼ |
|
|
ГФДГ, мЕ/г ткани |
14-е сутки |
3,33± 0,16 |
3,11± 0,15 |
2,49± 0,15* |
2,36± 0,2* |
3,17± 0,25& |
3,3± 0,18& |
2,16± 0,15*# |
|
22-е сутки |
3,33± 0,16 |
2,22± 0,26* |
2,15± 0,24* |
2,1± 0,3* |
2,87± 0,23 |
3,03± 0,17& |
3,03± 0,2&▼ |
|
Примечания:
*- достоверная разница в сравнении с интактными крысами (р<0,05);
**- достоверная разница в сравнении с группой 1 (контроль) (р<0,05);
&- достоверная разница в сравнении с группой 3 (р<0,05);
#- достоверная разница в сравнении с группами 4 и 5 (р<0,05);
▼- достоверная разница в группе в сравнении с 14-ми суткам (р<0,05).
К 22-му дню исследований в контрольной группе отмечали понижение активности ГФДГ на 33,3% относительно интактных животных, при этом показатели ВИГ и ГР, как на 14-е сутки, оставались ниже исходных значений. Во 2-й группе концентрация ВИГ достоверно снижалась на 23% по отношению к интактным животным, а активности ГР и ГФДГ – на 44,7% и 35,4% соответственно (табл. 2). В 3-й группе отмечалось прогрессирующее снижение уровня ВГ – на 13,7% относительно 14-х суток и 36,7% ниже исходного у интактных животных. Активности ГР и ГФДГ были ниже, чем у интактных крыс, на 61,7% и 36,9% соответственно. В 4-й и 5-й группах концентрация ВИГ достоверно возрастала на 32,7% и 21,5% соответственно, активность ГР достоверно увеличивалась на 50% и 38,9% соответственно относительно 3-й группы, оставаясь ниже исходных показателей. При этом в группе с мексидолом уровень ВИГ был ниже такового на 14-е сутки эксперимента на 13,3%. Активность ГФДГ в 4-й и 5-й группах не отличалась от исхода, а в группе с мексидолом на 44% достоверно превышала соответствующий показатель в 3-й группе (табл. 2). Наиболее эффективно концентрация ВИГ возрастала в 6-й группе – на 71,9% относительно 3-й группы, достигая исходного значения. При этом в сравнении с 14-ми сутками прирост составил 29,6%. Активность ГФДГ увеличивалась на 44,3% по сравнению с 3-й группой, прирост относительно 14-х суток составил 40,3%, достигая уровня интактных животных. Активность ГР увеличивалась на 55,5% по сравнению с 3-й группой, оставаясь при этом ниже исходного показателя. В сравнении с 14-ми сутками активность ГР снизилась на 30%. Следовательно, ксимедон, мексидол и их сочетание уменьшают выраженность функциональной недостаточности глутатионовой системы в яичниковой ткани, повышая ее потенциальные антиоксидантные возможности в условиях антибластомной химиотерапии.
Заключение. Таким образом, препарат мексидол обеспечивал наиболее эффективное торможение активации процессов липопероксидации с развитием наиболее оптимального баланса в системе глутатиона на 14-й день исследования. При последующем наблюдении (на 22-й день опыта) мексидол также эффективнее ксимедона уменьшал содержание продуктов пероксидации липидов в тканях яичников (снижалось содержание как МДА, так и оснований Шиффа, по сравнению с группой крыс с полихимиотерапией) и поддерживал оптимальный баланс в системе глутатиона. Комбинированное введение ксимедона и мексидола не обнаружило преимуществ сравнительно с раздельным использованием этих препаратов в коррекции содержания продуктов пероксидации липидов в тканях яичников, несмотря на более эффективное восстановление содержания восстановленного глутатиона.
Библиографическая ссылка
Сипрова М.В., Сипров А.В., Вашуркина И.М., Макарова М.Ю., Шмырева Н.В. ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ И СИСТЕМЫ ГЛУТАТИОНА В ТКАНЯХ ЯИЧНИКОВ КРЫС С КАРЦИНОМОЙ WALKER-256 ПРИ ИСПОЛЬЗОВАНИИ ПРОИЗВОДНЫХ ПИРИМИДИНА И 3-ГИДРОКСИПИРИДИНА В СОЧЕТАНИИ С ДОКСОРУБИЦИНОМ И ПАКЛИТАКСЕЛОМ // Современные проблемы науки и образования. 2018. № 2. ;URL: https://science-education.ru/ru/article/view?id=27504 (дата обращения: 16.02.2026).



