Во всем мире ежегодно регистрируется порядка 1 миллиона случаев рака толстой кишки и около 715 000 смертей от этого заболевания, что ставит его на 4-е место по показателю смертности [1; 2]. В России с 2006 по 2016 г. значительно увеличилась распространенность рака толстой кишки (на 55% рака ободочной кишки и на 44% рака прямой кишки) [3]. По причине поздней диагностики летальность при раке толстой кишки достигает величины 40% в течение года с момента выявления болезни [3]. Высокие показатели одногодичной летальности свидетельствуют о необходимости поиска предиктивных высокоспецифичных диагностических и прогностических маркеров рака толстой кишки. Интерес исследователей в этом плане привлекли раково-тестикулярные антигены (РТА) - антигены, экспрессируемые клетками опухолей различных гистологических типов, но практически отсутствующие в клетках нормальных тканей [4].
Раково-тестикулярные антигены. Раково-тестикулярные антигены (РТА, Cancer Testis Antigens (СТА)) человека экспрессируются в опухолях различного гистологического происхождения и практически не экспрессируются в нормальных тканях (за исключением семенников и плаценты) [4]. Первый РТА был определен в меланоме и поэтому назван меланомным антигеном - 1 или MAGE-1 [5]. Позже было установлено, что MAGE-1 экспрессируется во многих других злокачественных опухолях. Изучение MAGE-1 позволило идентифицировать порядка 60 генов этого семейства [6]. На сегодняшний день обнаружено 276 РТА, объединённых в 138 семейств, из которых семь (MAGE-А, BAGE, MAGE-B, GAGE, SSX. LAGE1a, LAGE, MAGE-C) являются наиболее изученными [7].
Группа РТА объединяет белки с разным строением, гомология наблюдается в основном внутри семейств. Существует несколько классификаций РТА, первая из них основана на расположении кодирующих их генов в геноме. Согласно этой классификации РТА-гены, расположенные на Х-хромосоме, называют CT-X (cancer-testis Х) генами (MAGE-A, MAGE-B, LAGE, NY-ESO-1, GAGE, SSX и др.), а РТА-гены, расположенные на других хромосомах - non-X CT генами (ACRBP, BAGE, AKAP3, SPO11, BORIS, SYCP1 и др.). Интересно отметить, что на Х-хромосоме локализованы 129 РТА генов (из 276), а на Y-хромосоме только 9 генов, принадлежащих семейству TSPY. В 2008 году Hoffman O. с соавторами [8] на основании исследования экспрессии 153 РТА-генов предложили другую классификацию, согласно которой РТА-гены делят на 3 группы в зависимости от того, в каких органах регистрируется их экспрессия: тестикулярно-ограниченные, тестикулярно-энцефалон ограниченные (testis/brain-restricted) и тестикулярно-селективные.
В группу тестикулярно-ограниченных РТА-генов входит 39 генов, которые экспрессируются только в семенниках и плаценте (MAGE-A1, -B1, LAGE1a). В группу тестикулярно-энцефалон ограниченных РТА-генов входит 14 генов, которые экспрессируются в семенниках и мозге (GAGE1, MAGE-A9, MAGE-C2). К группе тестикулярно-селективных РТА-генов относится 85 генетических локусов, которые, помимо перечисленных выше органов, экспрессируются в некоторых других органах: поджелудочной железе, печени, почках, молочной железе, легких и пищеводе (MAGE-A3, -A4, -A6, -A11, -A12, BAGE, NY-ESO-1). То еть к тестикулярно-селективным относится большая часть non-Х СТ генов, а большинство СТ-Х генов относится к тестикулярно-ограниченным или тестикулярно-энцефалон ограниченным [8]. Следует отметить, что уровни мРНК генов РТА в соматических тканях составляют менее 1% от их экспрессии в семенниках, но значительно увеличиваются в малигнизированных тканях [9], при этом наблюдается определенная специфика в паттернах экспрессии РТА-генов в опухолях различной нозологии [4]. Данные, полученные в работе Водолажского Д.И., Кутилина Д.С. и др. [10], свидетельствуют о низкой транскрипционной активности в опухолевой и нормальной тканях молочной железы РТА локусов MAGEA1, MAGEA2, MAGEB1, GAGE1, MAGEC1 и NY-ESO1, но при этом такие РТА-гены, как MAGEA3, MAGEA4 и GAGE3, селективно гиперэкспрессированы в опухолевой ткани молочной железы. Авторы предлагают использовать данные локусы в качестве предиктивных онкомаркеров и мишеней для иммунотерапии. В исследовании Kanojia D. и др. [11] продемонстрировано, что в 74% образцов опухолей колоректального рака (КРР) присутствовала экспрессия SPAG9 антигена на уровне мРНК и белка. Анализ базы данных BioGPS [12] показал, что для РТА-гена SPAG9, в частности, показатели экспрессии в различных опухолевых и здоровых тканях существенно варьируют (рис. 1).
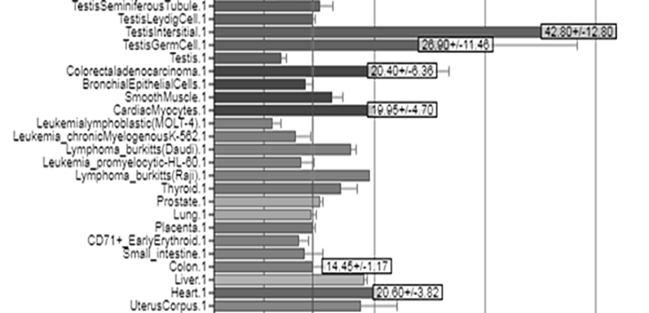
Рис. 1. Экспрессия гена SPAG9 в здоровых и опухолевых тканях [12]
Экспрессия РТА-генов носит тканеспецифический характер, что объясняется наличием сложных эпигенетических механизмов их регуляции. В настоящее время известно, что процесс метилирования отвечает за эктопическую депрессию РТА-генов [4]. В настоящее время большое количество исследований посвящено клиническому потенциалу РTA генов, при этом относительно мало известно об их функциях. Многие из этих функций не связаны с онкогенным процессом, а активация РТА генов связана с деметилированием промоторных участков соответствующих генов при малигнизации [13].
РТА представляют собой пептиды, которые в сочетании с аллоспецифичными HLA 1-го или 2-го класса презентируются иммунной системе, вызывая цитотоксический и гуморальный иммунные ответы [14]. В тканях здорового взрослого человека экспрессирующиеся РТА недоступны для иммунной системы. Например, в семенниках взаимодействию иммунной системы с РТА-белками препятствует наличие гемато-тестикулярного барьера и отсутствие HLA класса I на поверхности герминальных клеток [15]. Таким образом, РТА можно рассматривать как оптимальные опухоль-специфические маркеры. При этом очевидно, что каждый тип ткани - как опухолевой, так и нормальной (основываясь на данных BioGPS[12], рис. 1 и 2) - обладает определенным паттерном экспрессии РТА, и для использования РТА в качестве онкомаркера необходим тщательный анализ баз данных и молекулярно-генетические исследования, которые позволят выделить дифференциально экспрессирующиеся РТА.
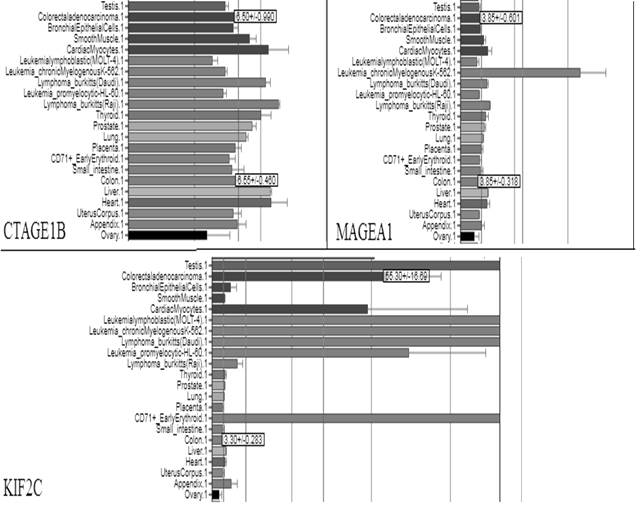
Рис. 2. Экспрессия генов CTAGE1B, MAGEA1 и KIF2C в здоровых и опухолевых тканях [12]
Особенности экспрессии РТА при раке толстой кишки. Экспрессия РТА при раке толстой кишки охарактеризована неполно, а на пациентах российской популяции не проводилась [16]. Первые исследования генов РТА при раке толстой кишки (колоректальном раке, КРР) появились в 1996 г., исследовали экспрессию мРНК MAGEA-1; -2; -3 у 54 больных КРР. Гиперэкспрессия MAGEA-1 была обнаружена в 30% случаев, MAGEA-2 – в 28% и MAGEA-3 – в 20%. Экспрессия мРНК РТА была чаще повышена у больных КРР с наличием метастазов [17]. Это может означать, что более агрессивные или продвинутые формы колоректального рака экспрессируют гены MAGE более сильно, и что они могут даже способствовать метастатическому процессу. Важно отметить, что степень совместной экспрессии генов семейства MAGE или экспрессии по крайней мере одного члена семейства в первичных опухолях не очень широко исследована в сравнении с экспрессией в метастазах КРР в печень, что ограничивает выводы, которые можно извлечь из этих данных [13]. В одном из самых крупных исследований было показано, что в 90 из 250 образцов тканей опухоли толстой кишки по меньшей мере один из трех выше перечисленных генов MAGE-A показывал высокий уровень экспрессии [13].
При изучении экспрессии РТА у 41 больного с первичным КРР и 14 пациентов с метастатическими поражениями печени не было зафиксировано гиперэкспрессии РТА в метастазах по сравнению с первичной опухолью [18]. В другом исследовании D. Perez et al. (2008) изучали корреляцию РТА с прогнозом заболевания у 35 больных КРР. Ретроспективный анализ экспрессии РТА проводили иммуногистохимическим методом с помощью моноклональных антител MA454/MAGE-A1, M3H67/MAGE-A3, 57B/MAGEA4, CT7-33/MAGE-C1, E978/NY-ESО-1. В 40% опухолей обнаружили экспрессию MAGE-A1, MAGE-A3, MAGEA4, MAGE-C1 и NY-ESО-1, в 14% опухолей положительно окрашивались антителами к MAGE-A1, MAGE-A3 и MAGE-A4, 26% опухолей - антителами к MAGE-C1 и 20% - антителами к NY-ESO-1. Также наблюдалась статистически значимая корреляция между экспрессией РТА и риском рецидива заболевания (р=0,027), что говорит о хорошем прогностическом потенциале данного маркера [19].
H.M. Shamtha Kumara и соавт. (2012) исследовали экспрессию генов PLAC1, MAGE-A3, GAGE и CTAG2 у 82 больных КРР, а также иммуногистохимическим методом тестировали экспрессию этих РТА в опухолевой ткани толстой кишки. Экспрессия MAGE-A3 и CTAG2 наблюдалась у 28% и 17% больных соответственно, а PLAC1 был гиперэкспрессирован у 13% пациентов [20]. A. Dakshinamurthy и соавт. изучали частоту и уровень экспрессии 16 РТ-генов Х-хромосомной локализации у 34 больных КРР. 12 РТ-генов в образцах опухолей не экспрессировались, 4 РТ-гена показали низкий уровень транскрипционной активности [21]. В 2010 году группой Z. Chen и сотр. было проведено исследование экспрессии 25 РТА в 288 образцах КРР и метастазах в печень. На основании данных об экспрессии PAGE4, вовлечении лимфатических узлов и отсутствии эмболии в сосудах опухоли была создана регрессионная модель для предсказания метастазов в печень. Уровень предсказания метастазирования в печень на основании этих маркеров составил 87% [17]. M. Li и соавт. изучали профиль экспрессии РТ-генов у 121 больного КРР. Результаты показали гиперэкспрессию мРНК NY-ESO-1 и LAGE-1, что, вероятно, может служить маркером локального метастазирования. У более чем 50% больных экспрессировался по крайней мере один из исследованных РТ-генов, с разной частотой (SCP1 - 1,7% , SSX2 - 2,5%, SSX4 - 2,5%, SSX1 - 5,0%, CT10 - 6,6%, NY-ESO-1 - 9,9%, MAGEA1 - 11,6%, LAGE-1 - 15,7%, MAGEA-4 - 22,3% и MAGEA-3 - 27,3%). При этом окружающие опухоль ткани не экспрессировали РТ-гены [22].
В 2015 году Голышко П.В. и соавт. определяли уровень мРНК 20 РТ - генов в образцах опухоли и периферической крови 98 больных КРР. Среди них мРНК 6 генов семейства MAGEA (MAGEA1-6), мРНК 8 генов семейства GAGE (GAGE1-8), мРНК 3 генов семейства SSX (SSX1, SSX2, SSX4), мРНК генов XAGE1, NY-ESO-1 и MAGE-C1. Авторами показано, что мРНК РТ-генов можно использовать в качестве прогностических показателей. Наличие в крови больного КРР мРНК генов MAGE-C1 и XAGE1 может быть потенциальным маркером более благоприятного течения заболевания. В то же время мРНК MAGE-A1-6 и SSX1-4 генов могут свидетельствовать о неблагоприятном прогнозе [17].
Было обнаружено, что РТА SPAG9 экспрессируется при различных злокачественных новообразованиях, в том числе у 74% пациентов с КРР. Другие РТА OY-TES-1, NY-ESO-1, MAGE-A3, BCP-20, BCP-41, BORIS, CAGE, HAGE и TSP50 также исследовались при КРР (таблица) [13]. AKAP являются специализированными анкерными белками, которые разделяют протеинкиназу A (PKA) и другие ферменты в цитоплазме на специфические субклеточные локализации для выполнения их ферментативных функций. Экспрессия гена AKAP4 при различных стадиях и гистотипах КРР была обнаружена у большинства пациентов (84%). Интересно отметить, что экспрессия гена AKAP4 достоверно ассоциировалась (p <0,026) с поздними стадиями (III и IV) у пациентов с КРР, что указывает на его потенциальную роль в агрессивном поведении опухоли [23].
Особенности экспрессии некоторых раково-тестикулярных генов при раке толстой кишки легли в основу иммунотерапевтических подходов, таких, например, как РТА-пептидные вакцины. Пептидные вакцины хорошо протестированы в клинических испытаниях, что отражает простоту, безопасность и стабильность этого типа вакцин. Однако существует несколько недостатков пептидных вакцин, включая ограничения, связанные с типом МНС; ограниченным количеством идентифицированных эпитопов и нарушением функции дендритных клеток у больных раком. Поэтому дендритные клетки нагружают несколькими РТА-пептидами [24]. РТА семейства MAGE аберрантно экспрессируются в различных типах злокачественных опухолей человека, включая КРР. Саданага и др. (2001) первоначально исследовали дендритно-клеточные вакцины, нагруженные пептидом MAGE-А3 у пациентов с опухолями желудочно-кишечного тракта, в зависимости от гаплотипа HLA (HLA-A2 или A24), включая пациентов с раком толстой кишки. После вакцинации MAGE-3-специфичные ответы цитотоксических лимфоцитов наблюдались у 50% пациентов. Опухолевые маркеры были снижены у 58% пациентов, при этом обнаружено наличие регрессии опухоли у 25% пациентов [25].
В 2012 году был обнаружен новый подкласс специфичных для мейоза РTA, названный mei-РТА (mei-CTA). В метаанализе объединённой выборки данных, полученных группой Feichtinger J.С. и сотр. с помощью технологии микрочипов, ни один из генов meiCT не показал достоверной гиперэкспрессии при КРР. Однако когда массивы данных были проанализированы по отдельности, некоторые гены показали значительное усиление экспрессии при КРР: NUT, CCDC105 и TCTE3 при сравнении опухолевой ткани с нормальной тканью толстой кишки [26].
В некоторых исследованиях отмечается, что, несмотря на повышение экспрессии генов РTA в клеточных линиях КРР, в опухолевой ткани кишки такого эффекта не наблюдается. Например, гены MCAK, TAG-1, TAG-2A, TAG-2B и TAG-2C были гиперэкспрессированы в клеточных линиях КРР, но слабо экспрессировались в ткани толстой кишки [13].
Таким образом, колоректальный рак относится в группе опухолей, имеющих ограниченную экспрессию РТА-генов. Однако надо учитывать возможность наличия подгрупп КРР, которые имеют высокую частоту экспрессии генов РTA [13]. В этой работе мы приводим в качестве примера результаты исследований, подтверждающие возможность использования РTA в качестве потенциальных биомаркеров по крайней мере для определенных когорт КРР. В таблице приведены профили экспрессии генов РTA в ткани или клеточных линиях КРР.
Некоторые РТА-гены, экспрессия которых обнаружена при КРР [13]
|
Название РТА-гена |
% образцов опухолевых тканей с экспрессией данного гена (число протестированных образцов) |
% образцов культур клеток с экспрессией данного гена (число протестированных образцов) |
|
AKAP3 |
83.3% (6) |
30% (10) |
|
BCP-20(FBXO39) |
38.6% (57) |
28.6% (7) |
|
BCP-41(TTLL2) |
29.8% (57) |
- |
|
BORIS |
80% (10) |
75% (4) |
|
CAGE |
74.4% (47) |
50% (4) |
|
HAGE |
16.0% (288) |
- |
|
LAGE-1 |
13.5%(503) |
- |
|
MAGEA1 |
13.0%(484) |
58.3%(12) |
|
MAGEA2 |
18.3% (338) |
35.3% (17) |
|
MAGEA3 |
22.1% (535) |
29.2% (24) |
|
MAGEA4 |
18.9% (419) |
23.5% (17) |
|
MAGEA5 |
6.8% (250) |
- |
|
MAGE-A6 |
27.6% (250) |
40%(5) |
|
TEKT5 |
50% (10) |
9.1% (44) |
|
SPAG9 |
74.3% (78) |
100% (2) |
|
TSP50 |
89.5% (95) |
100% (7) |
Хотя некоторые из цитируемых в работе Sammut J. [13] исследований были ограничены по своему масштабу, очевидно, существует не один ген РTA, который широко экспрессируется в разных группах КРР. Однако, учитывая специфику персонализированной иммунотерапии, возможно, исследование экспрессии РТА в определенной когорте пациентов может быть более полезным, если предполагается, что экспрессия РTA-гена связана с продукцией антигена, который может быть терапевтической мишенью.
Заключение. Исследования экспрессии РТА в опухолях толстой кишки, представленные в данном обзоре, позволяют сделать вывод, что отдельные представители разных семейств РТА (LAGE-1, MAGEA3, MAGEA4, MAGE-A6, SPAG9, TSP50 и др.) обладают большим потенциалом как в диагностике и прогнозировании развития, так и иммунотерапии опухолей кишечника.
Библиографическая ссылка
Кит О.И., Солдатова К.И., Кутилин Д.С., Водолажский Д.И. РАКОВО-ТЕСТИКУЛЯРНЫЕ АНТИГЕНЫ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОЛСТОЙ КИШКИ // Современные проблемы науки и образования. 2018. № 2. ;URL: https://science-education.ru/ru/article/view?id=27449 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.27449



