Рассеянный склероз - хроническое заболевание центральной нервной системы, которое является наиболее распространенным хроническим неврологическим расстройством у молодых людей [1]. В основе его патологии лежит воспалительный процесс, сопровождающийся демиелинизацией. Уже на ранних стадиях заболевания у пациентов с рассеянным склерозом (РС) наблюдается когнитивный дефицит. Для лечения больных с РС за последние три десятилетия использовали разные группы препаратов, обладающих иммуномодулирующим действием [2; 3], что связано с тем, что наиболее важную роль в патогенезе рассеянного склероза отводят аутоиммунным механизмам. При этом данное заболевание сопровождается также нарушением центральной нейромедиации [4; 5], изменение которой не менее важно для определения прогрессирования заболевания. В том числе установлена роль глутамата и норадреналина в патогенезе рассеянного склероза, что было также подтверждено на модели экспериментальном аллергического энцефаломиелита (ЭАЭ). Данная модель наиболее часто используется при изучении рассеянного склероза [6-8]. В модели ЭАЭ было изучено влияние структурного аналога центрального вазодилататора винкамина виндебурнола на экспрессию тирозингидроксилазы, предшественника норадреналина, в Locus coeruleus. Было высказано предположение о том, что препараты, подобные виндебурнолу, активируя норадренергическую медиацию в Locus coeruleus, могут способствовать снижению симптоматики рассеянного склероза [9].
Целью данной работы явилось изучение влияния виндебурнола на гистологические показатели в мозге и неврологический статус крыс в модели экспериментального аллергического энцефаломиелита.
Методы исследования
Эксперименты на животных выполнены с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18 марта 1986 г.). В эксперимент вошли 3-4-месячные самки беспородных крыс. Всех животных делили на 3 группы: 1 - контрольная группа (n=20); 2 - моделирование ЭАЭ (n=30); 3 - после моделирования ЭАЭ подкожно вводили виндебурнол в дозировке 20 мк/кг со дня первых проявлений неврологического дефицита в течение последующих 10 суток (до пика клинических проявлений заболевания). Расчет дозы виндебурнола производили путем вычисления LD50 для данного вида животных с границей доверительного интервала 95%. Материалом для иммунизации животных с целью воспроизведения ЭАЭ служил спинной мозг беспородных белых крыс без неврологической симптоматики с модифицированным полным адьювантом Фрейнда. Реакцию животных на введение препарата оценивали по уровню проявления неврологического дефицита и патоморфологических изменений в головном мозге крыс экспериментальных групп на пике острой фазы заболевания. Для оценки клинической тяжести заболевания использованы следующие стандартные показатели [10], в том числе общие (вес тела, летальность) и показатели неврологического дефицита:
1. Клинический индекс, который вычисляли в баллах по следующим показателям:
0 баллов – нет очевидных клинических проявлений; 1 балл – сниженный тонус хвоста; 2 балла – слабость и легкий паралич задних конечностей, переваливающаяся походка, медленное восстановление положения тела из положения на боку; 3 балла – тяжелый паралич задних конечностей или всех; 4 – тетраплегия (паралич четырех конечностей); 5 – агональное состояние; 6 – смерть.
2. Оценку неврологического дефицита также проводили с использованием метода [11]. Итоговый балл по данному методу формируется как сумма баллов в 3 двигательных тестах, определяющих мышечную силу, цепкость-тягу и равновесие, что позволяет оценить функциональное состояние экстрапирамидной системы. При этом 0 баллов свидетельствует о максимальной выраженности нарушений, а 9 баллов - об их отсутствии. Тяжесть неврологических нарушений фиксировали на видеокамеру.
Для гистологического исследования животных декапитировали под нембуталовым наркозом (35 мг/кг веса), ткань головного мозга животных фиксировали в 10%-ном нейтральном буферированном формалине, заливали в парафин, из тканевых блоков готовили срезы толщиной 6-8 микрон, окрашивали гематоксилином и эозином. Окрашенные срезы исследовали под световым микроскопом с возможностью фоторегистрации. Секции мозга оценивали независимо для определения центров воспаления слепым методом, без информации о характере обработки животного до умерщвления. Образцы для каждого животного подготавливали идентичным образом и определяли степень воспалительной инфильтрации [12]. Обработку фотографий проводили с помощью программы ImageJ (National Institutes of Health (NIH) http:/rsb.info.nih.gov/ij/).
Статистическую обработку результатов исследования проводили с использованием пакета программ Statistica 8.0.
Результаты исследования
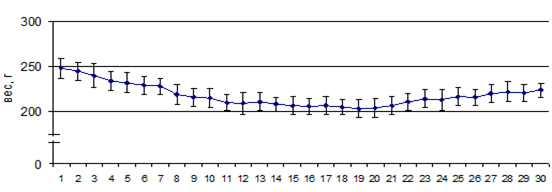
На первом этапе исследования оценивали продолжительность латентного, клинического периодов, а также общее число заболевших и тяжело больных крыс (в % от числа крыс в группе), средний клинический индекс на пике заболевания и средний кумулятивный индекс болезни. Было иммунизировано 30 крыс, у 14 из которых выявлены были неврологические нарушения, т.е. развивался ЭАЭ. Процент выживаемости среди заболевших крыс составил 86%. Продолжительность латентного периода у заболевших животных в среднем составила 6,5 суток. В этот период животные не теряли массу. До иммунизации средний вес крыс составлял 248 г, к 7-м суткам после иммунизации вес заболевших животных незначительно снизился (до 227 г). С 8-х суток после иммунизации у заболевших крыс наблюдали достоверное снижение веса (р<0,05), который постепенно увеличивался в период ремиссии заболевания (с 21 суток после иммунизации). К концу эксперимента вес животных был ниже, чем в 1-й день иммунизации (рис. 1). В острую стадию заболевания у животных наблюдали недержание мочи и неврологические нарушения двигательных функций. Клинический индекс на пике заболевания (7-20 сутки) составил 2,4±0,2 балла.
 Дни эксперимента
Дни эксперимента
Рис. 1. Динамика веса заболевших крыс
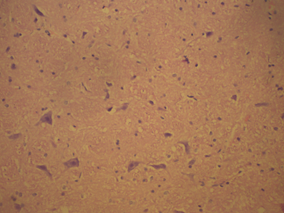
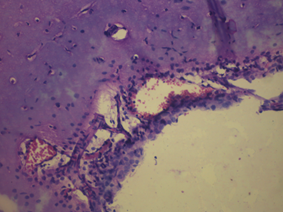
В контрольной группе крыс показатели неврологического статуса были в норме. В том числе в тесте на мышечную силу крысы удерживались на проволочном экране более 15 с: в среднем 24,7 с. В тесте на равновесие с использованием деревянного стержня животные удерживались более 30 с (в среднем 47,2 с), а в тесте на цепкость-тягу животные демонстрировали способность подтягивать 1 или 2 задние лапки. Время до момента падения этих животных в среднем составило 18,7 с. По данной неврологической шкале крысы контрольной группы получили 8,7±0,3 балла. В контрольной группе крыс в коре больших полушарий и стволовых структурах головного мозга отмечали слабо выраженный перицеллюлярный и периваскулярный отек, нейроциты и структура нервных волокон были сохранены. Незначительный перицеллюлярный и периваскулярный отек является нормой для здорового мозга (рис. 2).
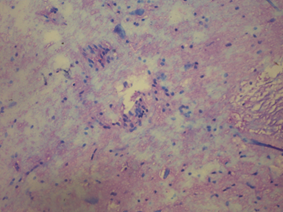
При оценке неврологического дефицита на пике заболевания крыс в модели ЭАЭ установлено, что в тесте на мышечную силу крысы данной группы удерживались на проволочном экране в среднем не более 6,7 с. Большинство животных в модели ЭАЭ стремились удержать равновесие путем захвата конечностями проволочного экрана с двух сторон. В тесте на равновесие с использованием деревянного стержня животные в модели ЭАЭ удерживали равновесие менее 30 с (в среднем 11,3 с). В тесте на цепкость-тягу крысы в модели ЭАЭ смогли удержаться на веревке в среднем 3,6 с. 29% заболевших крыс после помещения их на веревку не могли удержаться на ней: сразу падали. Сумма баллов по данной шкале у крыс в модели ЭАЭ составила 3,8 балла. Таким образом, иммунизация крыс приводила к развитию выраженной неврологической симптоматики. При этом у крыс в модели ЭАЭ в коре больших полушарий нейроциты были сохранены, отмечалась очаговая периваскулярная инфильтрация лимфоцитами, выраженный периваскулярный и перицеллюлярный отек, а также мелкие очаги дезорганизации нервных волокон.
|
|
|
|
а |
б |
Рис. 2. Морфология ткани мозга крысы контрольной группы: а) слабо выраженная периваскулярная лимфоцитарная инфильтрация в мозге; б) умеренный перицеллюлярный отек. Гематоксилин и миозин об. 40. ок. 10
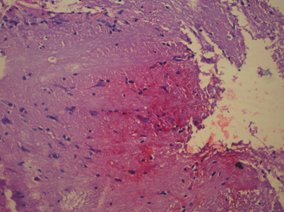
В стволовых структурах у крыс в модели ЭАЭ выявлены нейроциты с выраженными дистрофическими изменениями, некоторые вакуолизированы, диффузно периваскулярный и перицеллюлярный отек, на всем протяжении отмечали крупные очаги дезорганизации нервных волокон и умеренную диффузную периваскулярную лимфоцитарную инфильтрацию, в части сосудов установлен лейкостаз (рис. 3).
Процент выживаемости крыс 3-й группы составил 100%; динамика их веса в процессе развития заболевания представлена на рисунке 4. В острую стадию заболевания у животных не было признаков недержания мочи, но неврологические нарушения двигательных функций сохранялись, но в меньшей степени относительно 2-й группы животных. Клинический индекс на пике заболевания (7-20 сутки) у крыс 3-й группы составил 1,3±0,1 балла: им был характерен низкий тонус хвоста и признаки слабости и легкого паралича задних конечностей, у ряда животных выявлена переваливающаяся походка, медленное восстановление положения тела из положения на боку. Но в отличие от крыс 2-й группы (модель ЭАЭ) тяжелого паралича конечностей у них не наблюдали.
В тесте на мышечную силу крысы 3-й группы удерживались на проволочном экране в среднем 16,4±0,7 с, что на 34% (р<0,05) было ниже, чем в контрольной группе. В тесте на равновесие животные 3-й группы демонстрировали увеличение времени удержания на деревянном стержне (в среднем до 23,4 с) относительно крыс 2-й группы. В тесте на цепкость-тягу животные 3-й группы в среднем удерживались на горизонтальной веревке 12,3 с, что на 34% (р<0,05) было ниже, чем в контрольной группе. Суммарно по неврологической шкале животные 3-й группы получили 5,4 балла.
|
|
|
|
а |
б |
|
|
|
|
в |
г |
Рис. 3. Морфологические изменения в ткани мозга крыс в модели ЭАЭ: а) очаги деструкции нервной ткани без пролиферации глиальных элементов; б) оболочка головного мозга с отеком, полнокровием и очаговой лимфоцитарной инфильтрацией; в) полнокровие сосудов с лейкостазом; г) очаги геморрагического пропитывания нервной ткани. Гематоксилин и миозин об. 40. ок. 10.
Дни эксперимента 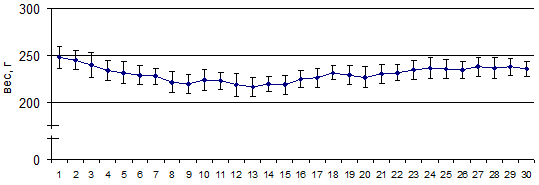
Рис. 4. Динамика веса крыс при введении виндебурнола в модели ЭАЭ
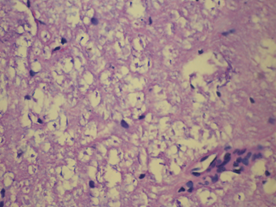
У крыс 3-й группы были выявлены также очаги деструкции нервных волокон с пролиферацией клеток нейроглии, дистрофические изменения нейроцитов с кариолизисом ядер, на некоторых участках обнаружена деструкция нервных волокон (рис. 5).
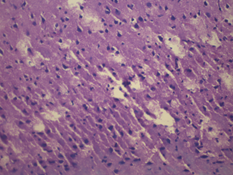 а
а
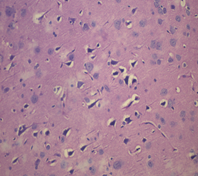 б
б
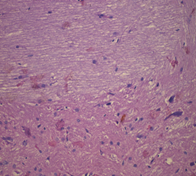 в
в
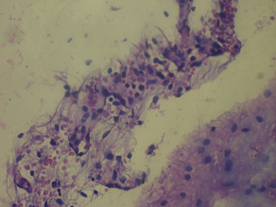
Рис. 5. Морфологические изменения ткани мозга крыс в модели ЭАЭ и введения виндебурнола: а) очаги деструкции нервных волокон с пролиферацией клеток нейроглии; б) дистрофические изменения нейроцитов с кариолизисом ядер; в) участки деструкции нервных волокон. Гематоксилин и миозин об. 40. ок. 10
Относительно крыс 2-й группы у иммунизированных животных с введением виндебурнола не установлена очаговая периваскулярная инфильтрация лимфоцитами, периваскулярный и перицеллюлярный отек, также лейкостаз сосудов. Следовательно, введение виндебурнола снижает данные проявления ЭАЭ.
Заключение
Работы, посвященные изучению эффектов виндебурнола в модели ЭАЭ, немногочисленны. Установленные изменения неврологического статуса и морфологической картины в мозге у крыс с развившимся ЭАЭ и при введении виндебурнола можно объяснить его влиянием на норадренергическую нейромедиацию. Снижение уровня норадренергического уровня ЦНС и деструктивные изменения нейронов в Locus Coeruleus были описаны как в модели ЭАЭ, так и у пациентов с хроническим рассеянным склерозом [7]. При этом повреждение Locus Coeruleus способствует усилению симптомов при экспериментальном аутоиммунном энцефалите, тогда как повышение уровней норадреналина или его предшественников в этой структуре мозга смягчает течение заболевания [13]. Согласно данным литературы лечение мышей с экспериментальным аутоиммунным энцефалитом с помощью виндамина виндебурнола, способствующего повышению уровня норадреналина и его метаболизма в Locus Coeruleus, приводит к снижению симптомов данного заболевания [8]. Таким образом, выявлены индикаторы, хотя и немногочисленные, показывающие, что уровень норадреналина в Locus Coeruleus в модели рассеянного склероза снижен, а стимуляция его метаболизма при введении виндебурнола может улучшить симптомы данного заболевания. Это косвенно подтверждают и результаты морфологических исследований в мозге крыс, которым вводили виндебурнол в модели ЭАЭ.
Библиографическая ссылка
Карантыш Г.В., Гафиятуллина Г.Ш., Менджерицкий А.М., Прокофьев В.Н., Жукова М.В., Макаров В.А. ВЛИЯНИЕ ВИНДЕБУРНОЛА НА НЕВРОЛОГИЧЕСКИЙ СТАТУС И МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ГОЛОВНОМ МОЗГЕ КРЫС В МОДЕЛИ ЭКСПЕРИМЕНТАЛЬНОГО АЛЛЕРГИЧЕСКОГО ЭНЦЕФАЛОМИЕЛИТА // Современные проблемы науки и образования. 2018. № 1. ;URL: https://science-education.ru/ru/article/view?id=27398 (дата обращения: 12.02.2026).