Ядрышко – это динамичная органелла клетки, и его структура отражает уровни трех основных процессов, связанных с биогенезом рибосом: синтез прерибосомальной рибонуклеиновой кислоты (преРНК), процессинг и миграцию рибонуклеопротеидных частиц в нуклеоплазму [1]. Одним из замечательных свойств ядрышек является их высокая пластичность, которая проявляется в изменении размеров, морфологии и локализации в ядре при реакции на многие внешние стрессовые воздействия, а также при адаптации к неблагоприятным факторам [2; 3]. По данным некоторых авторов, ядрышко можно рассматривать в качестве центральной фигуры, координирующей клеточный ответ на стрессовые воздействия [4]. Так, по данным Чучковой Н.Н. и соавт. (2016), экспериментальная алиментарная гиперхолестеринемия у крыс сопровождалась реактивной перестройкой нуклеолярного аппарата клеток печени (увеличивалось число мелких и плотных ядрышек), что свидетельствует о снижении синтетической активности гепатоцитов [5]. Солин А.В. и соавт. (2016) показали, что при адаптации к длительному стрессу, вызванному ограничением движения, в клетках печени крыс наблюдалось возрастание количества ядрышек [6]. Многие авторы также отмечали увеличение числа, площади ядрышек и ядрышко-ядерного соотношения при репаративной регенерации печени, в частности при экспериментальном циррозе и других патологиях [7; 8].
В литературе имеется небольшое количество работ, посвященных морфологии ядрышка клеток печени при гипотермии. Капрелянц А.С. и соавт. (1985) в гепатоцитах, подвергнутых гипотермии, отмечали перемещение ядрышка на периферию ядра, к его мембране, что данные авторы объясняют увеличением ядерно-цитоплазматических отношений и усилением регуляторного влияния ядра на цитоплазму [9]. По данным других авторов, под влиянием низкой температуры (2 часа при 0-4 °С) в печени крыс происходила дегрануляция ядрышек, а через 10 часов после помещения животных снова в нормальные температурные условия ультраструктура ядрышек восстанавливалась [10]. Молодых О.П. (2001) при электронной микроскопии в ядрышках клеток печени при холодовом стрессе отмечала явления сегрегации гранулярного и фибриллярного компонентов, которая отражает низкий уровень синтеза рибосомной РНК и, как следствие, низкий уровень метаболизма в целом [11]. Исследований ядрышковых организаторов клеток печени методом серебрения при воздействии холодом в литературе нами не обнаружено.
Целью исследования являлась оценка морфофункциональной активности ядрышковых организаторов гепатоцитов крысы при экспериментальном холодовом стрессе и в постгипотермическом периоде.
Материал и методы исследования
Исследование выполнено на 20 белых крысах линии Wistar. Гипотермию моделировали путем помещения животных, находящихся в индивидуальных клетках, в воду температурой 5 °С, при температуре окружающего воздуха 7 °С. Критерием прекращения эксперимента служило достижение животными ректальной температуры 20-25 °С, что соответствовало глубокой степени гипотермии. Время экспозиции было индивидуальным и в среднем составляло 40 ± 5 мин. В ходе эксперимента животные были разделены на 4 группы. Животные 1-й группы (n = 5) умерщвлялись сразу после прекращения охлаждения, животные 2-й группы (n = 5) выводились из эксперимента через 2 суток после прекращения охлаждения, печень животных 3-й группы (n = 5) исследовали через 5 суток после прекращения охлаждения, и животных 4-й группы (n = 5) изучали через 14 дней после прекращения воздействия гипотермии.
Использование крыс в экспериментах осуществляли в соответствии с Европейской конвенцией по охране позвоночных животных, используемых в эксперименте, и директивами -86/609/EEC [12]. Обезболивание и умерщвление животных проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Материал фиксировали в 10%-ном нейтральном формалине, забуференном по Лилли. Проводку материала осуществляли по изопропиловому спирту с помощью автомата проводки карусельного типа TISSUE-TEK VIPTM6 (Sakkura, Япония), заливали в парафин при помощи станции парафиновой заливки TISSUE-TEK TEC 5 (Sakkura, Япония). Гистологические срезы толщиной 4-7 мкм получали с использованием полуавтоматического роторного микротома Accu-Cut SRM (Sakkura, Япония). Окрашивали срезы гематоксилином и эозином в автомате для автоматической окраски микропрепаратов TISSUE-TEK Prisma (Sakkura, Япония) и заключали препараты под пленку в автомате для автоматического заключения микропрепаратов TISSUE-TEK Film (Sakkura, Япония). На окрашенных гематоксилином и эозином гистологических препаратах высчитывали число гепатоцитов в 5 полях зрения при увеличении х400 и индекс альтерации (процент некротизированных гепатоцитов).
Выявление ядрышковых организаторов осуществляли по двухступенчатому методу Daskal Y. et al., в нашей модификации [13; 14]. При увеличении х1000 под масляной иммерсией микроскопа высчитывали число ядрышек, суммарную площадь аргирофильных гранул (AgNORs) на 1 ядро, площадь одного ядрышкового организатора и ядрышко-ядерное соотношение (Ядр/яд) в относительных единицах (отн. ед.). Морфометрические измерения проводили с помощью аппаратно-программного комплекса, состоящего из программного обеспечения для морфометрического анализа ВидеоТест-Морфология 5.2, цифровой камеры VIDI CAM (Россия), адаптированной к световому микроскопу Nikon Eclipse E200 (Япония), и персонального компьютера. У каждого животного исследовали не менее 25-30 ядер гепатоцитов.
Статистическую обработку материала проводили при помощи статистического пакета Statistica 6.0. Если при проверке статистических гипотез распределение данных было нормальным, то применяли методы параметрической статистики (t-test Стьюдента), а если полученные данные не соответствовали критериям нормального распределения (критерий Шапиро-Уилка W = 0,89, p < 0,01), то применяли методы непараметрической статистики: тест Kолмогорова-Смирнова или U-тест Манна-Уитни. Данные считали достоверными при р < 0,05.
Результаты исследования и их обсуждение
При окраске гистологических срезов печени экспериментальных животных ядрышковые организаторы четко выявлялись в виде черных гранул (АgNORs) на желтоватом фоне нуклеоплазмы ядра. Непосредственно после гипотермии среднее число AgNORs составило 1,2±0,1 на 1 ядро. Средняя площадь AgNORs составила 2,7±0,2 мкм2 на 1 ядро. Средняя площадь 1 AgNORs составила 2,1±0,1 мкм2. Ядр/яд соотношение составило 0,11±0,01 отн. ед. (таблица) (рис. 1а).
Морфофункциональная характеристика ядрышковых организаторов гепатоцитов в зависимости от срока проведения экспериментальной глубокой гипотермии (M±m)
|
Параметры гепатоцитов |
Срок эксперимента |
|||
|
Сразу после гипотермии |
Через 2 дня |
Через 5 дней |
Через 14 дней |
|
|
Число AgNORs на 1 ядро |
1,2±0,1* |
2,35±0,1* |
3,4±0,1* |
2,0±0,1* |
|
Площадь AgNORs на 1 ядро (мкм2) |
2,7±0,2* |
5,6±0,2* |
8,7±0,2* |
4,2±0,2* |
|
Площадь 1 AgNORs (мкм2) |
2,1±0,1 |
2,2±0,1* |
2,6±0,1* |
2,1±0,1* |
|
Ядр/Яд соотношение (отн. ед) |
0,11±0,01* |
0,15±0,004* |
0,16±0,004 |
0,11±0,004* |
Примечание: * - данные достоверны при p < 0,05.
Нами были построены гистограммы, характеризующие распределение клеточных элементов печени по площади AgNORs на 1 ядро. Анализ гистограммы, характеризующей распределение AgNORs сразу после гипотермии показал, что гепатоциты с площадью AgNORs от 1 до 1,99 мкм2 составили 25,4%, от 2 до 2,99 мкм2 – 38,6%, от 3 до 3,99 мкм2 – 25,4%, от 4 до 4,99 мкм2 – 2,6% и от 5 до 5,99 мкм2 – 8%. Гистограмма имеет сдвиг влево и высокий пик в области клеток с площадью AgNORs от 2 до 2,99 мкм2 на 1 ядро (рис. 2). Через 2 дня после проведения гипотермии среднее число AgNORs составило 2,35±0,1 на 1 ядро. Средняя площадь AgNORs составила 5,6±0,2 мкм2 на 1 ядро. Средняя площадь 1 AgNORs составила 2,2±0,1 мкм2. Ядр/яд соотношение составило 0,15±0,004 отн. ед. (таблица) (рис. 1б).
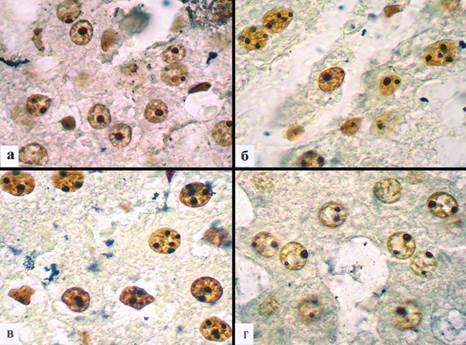
Рис. 1. Ядрышковые организаторы в ядрах гепатоцитов при холодовом стрессе: а – единичные AgNORs сразу после прекращения воздействия гипотермии; б – начало увеличения числа AgNORs на 2-е сутки эксперимента; в – дальнейшее возрастание количества AgNORs на 5-е сутки эксперимента; г – уменьшение содержания AgNORs на 14-е сутки эксперимента. Окраска AgNOR по Боброву И.П. Увеличение х 1000
Анализ гистограммы, характеризующей распределение клеточных элементов печени по площади AgNORs, через 2 дня после гипотермии показал, что гепатоциты с площадью AgNORs от 1 до 1,99 мкм2 составили 0%, от 2 до 2,99 мкм2 – 5,3%, от 3 до 3,99 мкм2 – 16,5%, от 4 до 4,99 мкм2 – 18,8%, от 5 до 5,99 мкм2 – 22,6%, от 6 до 6,99 мкм2 – 9,8%, от 7 до 7,99 мкм2 – 16,5%, от 8 до 8,99 мкм2 – 4,5%, от 9 до 9,99 мкм2 – 5,3%, от 10 до 10,99 мкм2 – 0%, от 11 до 11,99 мкм2 – 0% и от 12 до 12,99 мкм2 – 0,7%. При рассмотрении гистограммы отмечается широкая гетерогенность клеток по площади AgNORs на 1 ядро. В то же время уменьшается количество клеток печени, содержащих AgNORs c площадью от 1 до 3 мкм2. Наиболее высокий пик отмечается в области клонов клеток, содержащих от 5 до 5,99 мкм2 на 1 ядро. При этом на данном сроке эксперимента появляются новые клоны с площадью AgNORs от 6 до 6,99 мкм2 – 9,8%, от 7 до 7,99 мкм2 – 16,5%, от 8 до 8,99 мкм2 – 4,5% и от 12 до 12,99 мкм2 – 0,7% (рис. 3).
Через 5 дней после проведения гипотермии среднее число AgNORs составило 3,4±0,1 на 1 ядро. Средняя площадь AgNORs составила 8,7±0,2 мкм2 на 1 ядро. Средняя площадь 1 AgNORs составила 2,6±0,1 мкм2. Ядр/яд соотношение составило 0,16±0,004 отн. ед. (таблица) (рис. 1в).
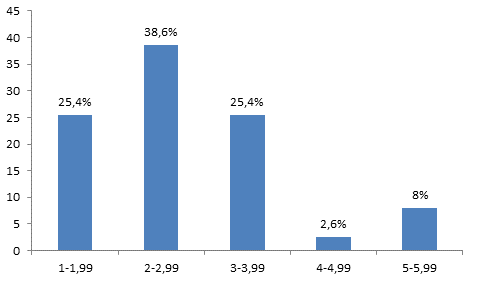
Рис. 2. Гистограмма, характеризующая распределение клеток печени по площади AgNORs на 1 ядро сразу после гипотермии. По оси абсцисс – площадь AgNORs (мкм2) на 1 ядро; по оси ординат процентное содержание клеток
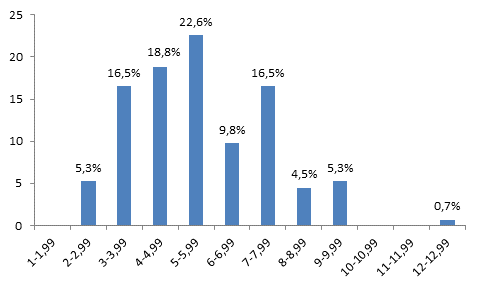
Рис. 3. Гистограмма, характеризующая распределение клеток печени по площади AgNORs на 1 ядро через 2 дня после гипотермии. По оси абсцисс – площадь AgNORs (мкм2) на 1 ядро; по оси ординат процентное содержание клеток
Анализ гистограммы, характеризующей распределение клеточных элементов печени по площади AgNORs, через 5 дней после гипотермии показал, что гепатоциты с площадью AgNORs от 1 до 1,99 мкм2 составили 0%, от 2 до 2,99 мкм2 – 0%, от 3 до 3,99 мкм2 – 0%, от 4 до 4,99 мкм2 – 2,6%, от 5 до 5,99 мкм2 – 6,4%, от 6 до 6,99 мкм2 – 11,5%, от 7 до 7,99 мкм2 – 11,5%, от 8 до 8,99 мкм2 – 27,1%, от 9 до 9,99 мкм2 – 19,2%, от 10 до 10,99 мкм2 – 10,2%, от 11 до 11,99 мкм2 – 5,1% и от 12 до 12,99 мкм2 – 0%, от 13 до 13,99 мкм2 – 2,6% и от 14 до 14,99 мкм2 – 3,8%. При рассмотрении гистограммы видно, что отсутствуют клетки печени c площадью AgNORs от 1 до 3,99 мкм2. Наиболее высокий пик отмечается в области клеток, содержащих от 8 до 8,99 мкм2 на 1 ядро. При этом на данном сроке эксперимента возрастает число клеточных клонов с площадью AgNORs от 8 до 8,99 мкм2 до 27,1%, от 9 до 9,99 мкм2 до 19,2%, от 10 до 10,99 мкм2 до 10,2% и от 11 до 11,99 мкм2 до 5,17%. При этом появляются новые клоны с площадью AgNORs от 13 до 13,99 мкм2 – 2,6% и от 14 до 14,99 мкм2 – 3,8% (рис. 4).
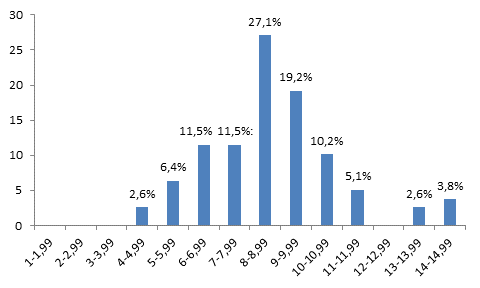
Рис. 4. Гистограмма, характеризующая распределение клеток печени по площади AgNORs на 1 ядро через 5 дней после гипотермии. По оси абсцисс – площадь AgNORs (мкм2) на 1 ядро; по оси ординат процентное содержание клеток
На 14-й день после гипотермии среднее число AgNORs составило 2,0±0,1 на 1 ядро. Средняя площадь AgNORs составила 4,2±0,2 мкм2 на 1 ядро. Средняя площадь 1 AgNORs составила 2,1±0,1 мкм2. Ядр/яд соотношение составило 0,11±0,004 отн. ед. (таблица) (рис. 1г). Анализ гистограммы, характеризующей распределение клеточных элементов по площади AgNORs на 1 ядро, на 14-й день эксперимента показал, что гепатоциты с площадью AgNORs от 1 до 1,99 мкм2 составили 1,4%, от 2 до 2,99 мкм2 – 22,9%, от 3 до 3,99 мкм2 – 32,9%, от 4 до 4,99 мкм2 – 18,6%, от 5 до 5,99 мкм2 – 10%, от 6 до 6,99 мкм2 – 5,7%, от 7 до 7,99 мкм2 – 7,1%, от 8 до 8,99 мкм2 – 0%, от 9 до 9,99 мкм2 – 1,4%, от 10 до 10,99 мкм2 – 0%, от 11 до 11,99 мкм2 – 0%, от 12 до 12,99 мкм2 – 0%, от 13 до 13,99 мкм2 – 0% и от 14 до 14,99 мкм2 – 0%. При анализе гистограммы видно, что отсутствуют клетки печени c площадью AgNORs от 10 до 14,99 мкм2. Наиболее высокий пик отмечается в области клеточных клонов, содержащих от 3 до 3,99 мкм2 на 1 ядро (32,9%). При этом на данном сроке эксперимента возрастает число клонов с небольшой площадью AgNORs от 1 до 4,99 мкм2 (рис. 5).
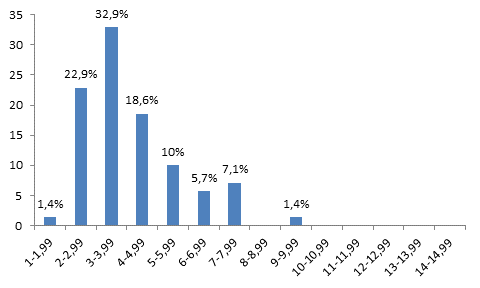
Рис. 5. Гистограмма, характеризующая распределение клеток печени по площади AgNORs на 1 ядро через 14 дней после гипотермии. По оси абсцисс – площадь AgNORs (мкм2) на 1 ядро; по оси ординат процентное содержание клеток
Заключение
Таким образом, результаты проведенного исследования показали, что холодовой стресс оказывает выраженное воздействие на активность ядрышкового аппарата клеточных элементов печени. Сразу после гипотермии в клетках печени экспериментальных животных отмечали уменьшение морфофункциональной активности AgNOR, что может быть связано с повреждающим действием холодового фактора на нуклеолярный аппарат. Далее на 2-й день эксперимента (в период регенерации) наблюдали широкую гетерогенность морфофункциональной активности AgNOR, что, вероятно, было обусловлено процессом образования новых ядрышек. На 5-й день (в период адаптации) количественные и морфометрические параметры AgNOR были наиболее высоки, что является следствием гипертрофии нуклеол, и затем на 14-й день эксперимента морфофункциональная активность ядрышковых организаторов значительно уменьшалась. Таким образом, нуклеолярный аппарат печеночных клеток подвергается повреждению при холодовом воздействии, но в постгипотермическом периоде (в период адаптации) отмечаются явления гипертрофии и амплификации ядрышек, что приводит к нормализации рибосомного синтеза и регенерации гепатоцитов.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта №16-34-60054 мол_а_дк.
Библиографическая ссылка
Бобров И.П., Лычева Н.А., Крючкова Н.Г., Лепилов А.В., Шахматов И.И., Долгатов А.Ю., Осипова А.В., Красова А.А. МОРФОФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ЯДРЫШКОВЫХ ОРГАНИЗАТОРОВ КЛЕТОК ПЕЧЕНИ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ХОЛОДОВОМ СТРЕССЕ И В ПОСТГИПОТЕРМИЧЕСКОМ ПЕРИОДЕ // Современные проблемы науки и образования. 2018. № 1. ;URL: https://science-education.ru/ru/article/view?id=27366 (дата обращения: 16.02.2026).
DOI: https://doi.org/10.17513/spno.27366



