Сочетанная травма таза и бедра относится к одним из наиболее тяжелых повреждений тазового пояса как в гуманитарной, так и в ветеринарной медицине [1; 2]. Наиболее часто для лечения подобных травм, сопровождающихся нарушением целостности и нестабильностью тазового кольца, используют погружной остеосинтез накостными пластинами или внутрикостными стержнями [2; 3]. Применение погружного остеосинтеза в раннем посттравматическом периоде обеспечивает стабильную фиксацию и сокращение периода консолидации отломков, однако увеличивает риск инфекционного воспалительного процесса. Погружной остеосинтез отломков бедренной кости снижает частоту развития асептического некроза ее головки; тем не менее данная патология развивается более чем в 20% случаев [3]. В гуманитарной медицине известны немногочисленные работы, посвященные обоснованию одномоментной радикальной реконструкции костей таза и тазовой конечности с использованием устройств для чрескостного остеосинтеза [4; 5]. Однако экспериментальное изучение особенностей репаративного морфогенеза при лечении сочетанных повреждений костей таза и бедра в данных условиях не проводилось.
Целью исследования явилось экспериментально-морфологическое обоснование эффективности одномоментной реконструкции при сочетанной травме таза и бедра с применением управляемого чрескостного остеосинтеза.
Материалы и методы исследования
Эксперимент проведен на 12 животных (беспородные собаки в возрасте 1,7±0,4 года, вес 17±1,3 кг). Животных содержали в виварии с индивидуальными маркированными боксами площадью 3 м2 при свободном доступе к питьевой воде и получении стандартного сбалансированного корма 2 раза в сутки. Все манипуляции производились в соответствии с положениями Европейской конвенции по защите позвоночных животных и требованиями Минздрава России к работе экспериментально-биологических клиник.
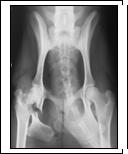
Сочетанные переломы тазовых и бедренных костей моделировали в операционной под общим наркозом (5%-ный раствор тиопентала натрия внутривенно). Последовательно производили дорсальные доступы к телу и ветви седалищной кости и шейке бедренной кости, после чего осуществляли их поперечную остеотомию (рис. 1а). Затем выполняли репозицию и чрескостный остеосинтез поврежденных структур скелета по оригинальным разработанным методикам (рис. 1б) [6].
|
|
|
|
|
|
а |
б |
в |
г |
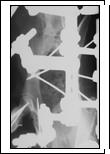
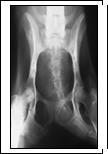
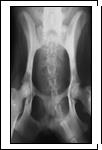
Рис. 1. Рентгеновский снимок таза, прямая проекция: а - получение экспериментальной модели сочетанных переломов тела и ветви седалищной кости, шейки бедра; б - чрескостный остеосинтез таза и бедра, срок эксперимента 14 суток; в - срок эксперимента 35 суток (окончание периода фиксации); г - срок эксперимента 65 суток
(30 суток после демонтажа аппарата)
Рентгенографию осуществляли с помощью стационарного рентгеновского аппарата Premium Vet (Sedecal, Испания) в дорсо-вентральной и латеральной проекциях через 14, 28, 35 суток в периоде фиксации аппаратом, а также через 30, 90 и 180 суток после его демонтажа. В указанные сроки животных выводили из эксперимента путем внутривенного введения 5%-ного раствора тиопентала натрия.
Ипсилатеральные седалищные кости и тазобедренные суставы вычленяли и фиксировали в течение 14 суток в 10%-ном нейтральном формалине. Гистологическую обработку костных блоков производили по стандартным методикам [7]. Часть блоков декальцинировали в смеси соляной и муравьиной кислот, обезвоживали и заливали в целлоидин. Гистотопографические срезы толщиной 10-15 мкм окрашивали гематоксилином и эозином, а также по Ван Гизону. Гистологические препараты исследовали в стереомикроскопах AxioScope.A1, Stemi 2000-С с использованием цифровой камеры AxioCam ICc 5 и программного обеспечения Zen blue (Carl Zeiss MicroImaging GmbH, Германия).
Часть костных блоков обезвоживали и уплотняли в эпоксидных смолах для электронно-микроскопических исследований. Исследование минерального состава суставной выстилки и подлежащей костной пластинки выполняли методом рентгеновского электронно-зондового микроанализа (РЭМА) с применением энергодисперсионного спектрометра INСА Energy 200 (Oxford Instruments Analytical, Великобритания), смонтированного на сканирующем электронном микроскопе JSM-840 (JEOL, Япония). В образцах оценивали массовое содержание химических элементов кальция (Caw, %), фосфора (Pw, %), магния (Mgw, %) и серы (Sw, %). В качестве контроля использовали аналогичным образом подготовленные фрагменты проксимальных эпиметафизов бедренных костей трех интактных животных.
Статистический анализ полученных данных был выполнен с использованием программы AtteStat 13.1 (надстройка программного продукта Microsoft Excel, свидетельство № 2002611109 от 28.06.2002, Россия). Проверка гипотезы о статистической значимости межгрупповых различий производилась с применением непараметрических критериев Вилкоксона и Манна-Уитни для независимых выборок при уровне значимости р ≤ 0,01.
Результаты исследования и их обсуждение
Опороспособность тазовой конечности на стороне повреждения восстанавливалась на 2-5-е сутки после операции и сохранялась на протяжении всего эксперимента. Рентгенографически сращение отломков костей таза и бедра характеризовалось снижением плотности теней корковых пластинок в зоне перелома на протяжении 3-5 мм и развитием слабо выраженной периостальной реакции на 14-е сутки после операции (рис. 1б). К концу периода фиксации аппаратом на 35-е сутки после операции зоны повреждения были перекрыты тенями средней и высокой интенсивности (рис. 1в). Через 30-180 суток после демонтажа аппарата структура и плотность теней регенератов приближалась к таковым материнской кости (рис. 1г).
В результате гистологического исследования было установлено, что через 14 суток фиксации аппаратом диастазы между отломками тазовой и бедренной костей заполняла рыхлая волокнистая соединительная ткань с высокой клеточной плотностью, богатая полнокровными синусоидными капиллярами. В её составе преобладали фибробластоподобные клетки, определялись элементы моноцитарно-макрофагального ряда.
Через 28-35 суток фиксации аппаратом в зонах повреждения седалищной кости формировалось интермедиарное соединительнотканно-хрящевое сращение отломков, в средней части которого определялись щелевидные полости и очаги кровоизлияний. При заживлении перелома шейки бедренной кости, в двух наблюдениях сращение отломков было соединительнотканно-хрящевым, в других случаях наблюдали полное костное сращение, сформированное мелкопетлистой сетью грубоволокнистых трабекул. В межтрабекулярных промежутках располагалась фиброретикулярная ткань либо красный костный мозг. Расширенные просветы сосудов гемомикроциркуляторного русла артериального типа заполняла плазма, синусоидного типа – эритроциты.
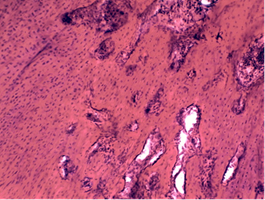
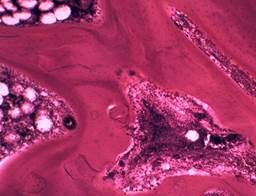
Через 65 суток послеоперационного периода (30 суток после демонтажа аппарата) формировалось костно-соединительнотканно-хрящевое сращение отломков седалищной кости (рис. 2 а, б). Костные отделы регенерата разделяла фиброзно-хрящевая прослойка с многочисленными очагами интрамембранозной и эндохондральной оссификации (рис. 2г). Массивные новообразованные трабекулы подвергались активному остеобластно-остеокластному ремоделированию. Частично кальцифицированный хрящевой матрикс зоны сращения отломков был инвазирован многочисленными сосудистыми комплексами.
В области перелома шейки бедренной кости наблюдали полное костное сращение отломков (рис. 2в), что соответствовало срокам консолидации изолированных переломов таза [8; 9]. Сеть пластинчатых трабекул новообразованного участка кости содержала красный костный мозг с включениями адипоцитов (рис. 2д), гиперемией синусоидов и запустением сосудов артериального типа.
|
|
|
|
|
а |
б |
в |
|
|
|
|
|
г |
д |
|
Рис. 2. Сращение отломков седалищной и бедренной костей через 30 суток после демонтажа аппарата. Гистотопографические препараты: а – тело седалищной кости, б – ветвь седалищной кости, в – проксимальный эпиметафиз бедренной кости. Микрофото: г – очаги эндохондральной и интрамембранозной оссификации в зоне сращения перелома ветви седалищной кости; д – губчатое костное вещество отломка в зоне сращения перелома шейки бедренной кости. А-в –целлоидиновые срезы, окраска по Ван Гизону; об. 0,65, ок. 10. Г, д – целлоидиновые срезы, окраска гематоксилином и эозином; об. 10, ок. 10
В отдаленные сроки эксперимента, через 125 и 215 суток после операции (90 и 180 суток после демонтажа аппарата), интермедиарное сращение отломков седалищной и бедренной костей было сформировано губчатым костным веществом, ограниченным компактной пластинкой. Межтрабекулярные промежутки заполнял красный костный мозг с включением адипоцитов, отмечали нормализацию кровенаполнения сосудов микроциркуляторного русла. Плотность губчатого костного вещества головки бедренной кости визуально не отличалась от таковой интактных животных, некротически измененные и ишемизированные участки не обнаруживались.
На данном этапе эксперимента (125-215 суток после операции) субхондральная компактная пластинка головки бедренной кости включала многочисленные полости, содержащие обильно васкуляризированную рыхлую волокнистую соединительную ткань. В гиалиновом хряще суставной выстилки отмечали очаговую дезорганизацию волокнистого компонента, гипохромное окрашивание матрикса и снижение клеточной плотности хондроцитов поверхностной зоны. Колоночная организация средней зоны не претерпевала выраженных изменений, однако линия базофильного раздела была многоконтурной, зона кальцифицированного хряща сужалась. Дистрофические изменения суставной выстилки соответствовали макро- и микроскопически выявляемым признакам I стадии развития остеоартроза по шкалам OARSI и Outerbridge [10; 11]. В то же время хондропатия была менее выраженной в сравнении с последствиями внутрисуставных переломов, когда даже в условиях стабильной внешней фиксации отломков развивался остеоартроз II-III стадии [12].
Исследование методом РЭМА выявило тенденцию к увеличению весового содержания минерального компонента в суставной выстилке головки бедренной кости животных опытной группы в периоде 125-215 суток после операции (таблица).
Содержание остеотропных химических элементов в суставной выстилке
и субхондральной пластинке головки бедренной кости собак через 4-7 месяцев
после моделирования перелома
|
Концентрация Участок анализа |
Интактная конечность (М± SD) |
Оперированная конечность (М± SD) |
||||||
|
Mgw% |
Pw% |
Sw% |
Caw% |
Mgw% |
Pw% |
Sw% |
Caw% |
|
|
Гиалиновый хрящ |
0,02 ± 0,013 |
0,30 ± 0,060 |
0,22 ± 0,090 |
0,23 ± 0,094 |
0,06 ± 0,045* |
0,62 ± 0,392 |
0,35 ± 0,211 |
0,30 ± 0,084 |
|
Поверхностная зона |
0,02 ± 0,011 |
0,39 ± 0,165 |
0,16 ± 0,102 |
0,13 ± 0,042 |
0,04 ± 0,021* |
0,43 ± 0,276 |
0,27 ± 0,181 |
0,25 ± 0,112* |
|
Средняя зона |
0,02 ± 0,014 |
0,32 ± 0,104 |
0,20 ± 0,096 |
0,20 ± 0,115 |
0,07 ± 0,040* |
0,50 ± 0,221 |
0,47 ± 0,133* |
0,36 ± 0,157* |
|
Глубокая зона |
0,02 ± 0,023 |
0,41 ± 0,148 |
0,24 ± 0,112 |
0,36 ± 0,190 |
0,07 ± 0,016* |
0,54 ± 0,235 |
0,39 ± 0,153 |
0,41 ± 0,096 |
|
Субхондральная кость |
0,20 ± 0,023 |
8,4 ± 1,09 |
0,08 ± 0,050 |
17,4 ± 1,78 |
0,12 ± 0,048 |
7,0 ± 1,38 |
0,19 ± 0,141 |
14,8 ± 3,11 |
Примечание: *– межгрупповые различия со значениями показателя в суставной выстилке интактных животных значимы при р < 0,01.
В интактном гиалиновом хряще наблюдалось равномерное распределение магния и градиентное – от поверхностной к глубокой зоне – увеличение массовой доли фосфора, серы и кальция. Через 4-7 месяцев после операции было выявлено статистически значимое 3-кратное возрастание Mgw% в каждой из зон суставного хряща, 2,3-кратный прирост Sw% в его средней зоне и почти двукратное увеличение Caw% в поверхностной и средней зонах. В субхондральной костной пластинке, напротив, была отмечена тенденция к снижению массового содержания остеотропных элементов магния, кальция и фосфора и увеличению содержания серы в послеоперационном периоде (таблица). Полученные данные соотносились с морфологически подтвержденным процессом ее ремоделирования что, по мнению К.С. Десятниченко с соавт. [13], является причиной увеличения минерализации матрикса суставного гиалинового хряща.
Заключение
Проведенные исследования позволили установить, что консолидация множественных переломов таза и бедра в условиях чрескостного остеосинтеза у экспериментальных животных происходит по вторичному типу с формированием первичного фиброзно-хрящевого сращения отломков на 28-35-е сутки внешней фиксации аппаратом. Активизация интрамембранозного и эндохондрального остеогенеза в периоде после демонтажа стабилизирующего устройства завершается восстановлением органотипического строения костей в периоде 4-7 месяцев после травмы. При этом полное костное сращение отломков бедренной кости формируется к 35-65-м суткам послеоперационного периода, а репаративный процесс при заживлении множественных переломов седалищной кости характеризуется более замедленным течением. На момент окончания эксперимента в головке бедренной кости не выявлены признаки остеонекроза, однако развиваются типичные дистрофические изменения суставной выстилки и субхондральной костной пластинки, соответствующие I стадии остеоартроза.
Библиографическая ссылка
Силантьева Т.А., Краснов В.В. МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ПРОЦЕССА ЗАЖИВЛЕНИЯ КОСТЕЙ ТАЗА И БЕДРА ПРИ ИХ СОЧЕТАННОЙ ТРАВМЕ И ОДНОМОМЕНТНОЙ РЕКОНСТРУКЦИИ МЕТОДОМ ЧРЕСКОСТНОГО ОСТЕОСИНТЕЗА // Современные проблемы науки и образования. 2017. № 6. ;URL: https://science-education.ru/ru/article/view?id=27297 (дата обращения: 15.02.2026).