Распространенность метаболического синдрома (МС) в настоящее время очень высока, и заболеваемость продолжает расти. Актуальность проблемы МС определяется как его высокой распространенностью, так и многообразием клинических проявлений, негативным влиянием на сердечно-сосудистую систему и функцию почек. Зачастую именно поражение почек определяет прогноз больных с МС [1; 2]. Известно, что комбинация хронической болезни почек (ХБП) и МС является фактором высокого сердечно-сосудистого риска, в том числе и фатальных сердечно-сосудистых событий [3]. При этом МС является одним из состояний, при которых может наблюдаться «бессимптомный» вариант ХБП [4]. Таким образом, проблема маркеров раннего поражения почек в рамках ведения больных МС приобретает особое значение.
Немалую роль в прогрессировании гломерулярных поражений почек играет нарушение функции эндотелия. Так, одним из факторов прогрессирования хронической болезни почек является нарушение зависимой от эндотелия вазодилатации [5]. Выраженная дисфункция эндотелия является независимым предиктором сердечно-сосудистых осложнений и смертности от них [6].
В настоящее время существуют две точки зрения на причину эндотелиопатии при МС.
Ряд авторов считают, что дисфункция эндотелия вторична по отношению к имеющейся инсулинорезистентности, т.е. является следствием тех факторов, которые характеризуют состояние ИР: гипергликемии, артериальной гипертонии, дислипидемии [7; 8]. Другие исследователи считают, что дисфункция эндотелия является не следствием, а причиной развития инсулинорезистентности, полагая, что в случае первичного дефекта эндотелиальных клеток трансэндотелиальный транспорт инсулина нарушается и, следовательно, может развиться инсулинорезистентность, которая в таком случае будет вторична по отношению к дисфункции эндотелия [9].
Микроальбуминурия (МАУ), являясь маркером клубочковой гиперфильтрации, ассоциирована с эндотелиальной дисфункцией и является признаком ее манифестации [10; 11]. Также можно определить МАУ и как интегральный маркер кардиоренальных взаимоотношений [12], т.к., являясь важнейшим ранним признаком поражения почек, отражающим начальные стадии патологии сосудов, МАУ неизменно коррелирует с увеличением сердечно-сосудистой заболеваемости и смертности [7].
В литературе имеются упоминания о результатах исследований, посвященных зависимости МАУ с МС и компонентами МС. По этим данным отмечается зависимость вероятности возникновения МАУ от числа компонентов МС [13]. Ряд авторов указывают на ассоциацию МАУ и резистентности к инсулину [14; 15].
Целью исследования явилось определение ранних маркеров поражения почек у больных с метаболическим синдромом и оценка взаимоотношения между показателями раннего поражения почек и нарушением функции эндотелия.
Материалы и методы
Исследование было проведено на базе 3-го кардиологического отделения Республиканской клинической больницы Республики Дагестан (г. Махачкала). Основную группу составили 82 пациента с метаболическим синдромом, страдающие артериальной гипертензией и ожирением, 42 (51,2%) мужчины и 40 (48.8%) женщин, в возрасте 54,0 [51,0; 56,0] лет. Из исследования исключались пациенты с сахарным диабетом (СД) 1-го и 2-го типов, с заболеваниями почек в анамнезе, скоростью клубочковой фильтрации ниже 60 мл/мин/м2 и вторичными формами артериальной гипертензии. В качестве контрольной группы наблюдались 35 практически здоровых лиц, 16 (45,8%) мужчин и 19 (54,2%) женщин, в возрасте 52,5 [47,0; 54,0] лет. Группы были сравнимы по полу и возрасту (p>0,05).
Диагноз МС в соответствии с критериями согласительного документа рабочей группы международных профессиональных сообществ 2009 г. устанавливался при условии наличия трех из нижеперечисленных признаков: абдоминальное ожирение (окружность талии для европеоидов ≥94 см у мужчин и ≥80 см – у женщин); повышенный уровень триглицеридов (>1,7 ммоль/л) или нормальный уровень триглицеридов при соответствующей терапии; холестерин липопротеидов высокой плотности у мужчин <1,03 ммоль/л; у женщин - <1,3 ммоль/л или нормальный уровень при наличии соответствующей терапии, артериальное давление не ниже 135/85 мм рт. ст.; уровень или гипотензивная терапия, глюкозы плазмы натощак >5,6 ммоль/л или терапия гипергликемии.
При включении больных в исследование учитывалась классификация хронической болезни почек согласно национальным рекомендациям 2012 г.: скорость клубочковой фильтрации выше 110 мл/мин/м2 – стадия 1 (повышенная); выше 90, но ниже 111 мл/мин/1,73 м2 – стадия 1 (оптимальная); выше 60, но ниже 90 мл/мин/1,73 м2 – стадия 2 (незначительно сниженная); выше 45, но ниже 60 мл/мин/1,73 м2 – стадия 3а (умеренно сниженная); выше 30, но ниже 45 мл/мин/1,73 м2 – стадия 3б (существенно сниженная); ниже 30 мл/мин/1,73 м2 – стадия 4 (значительно сниженная).
Всем пациентам в начале исследования проводили общеклиническое обследование, измерение офисного артериального давления (АД) по Короткову, суточное мониторирование АД (СМАД), эхокардиографию (Эхокг), ультразвуковое дуплексное сканирование сонных артерий с определением толщины комплекса интима-медиа (ТКИМ) сонных артерий. Уровни липидов, креатинина, глюкозы плазмы крови определяли стандартными биохимическими методами. Уровень экскреции альбумина с мочой определяли в разовой порции методом непрямого твердофазного иммуноферментного анализа - ELISA (enzyme linnked immunosorbent assay) с использованием иммуноферментных наборов на 96 тестов фирмы ORGENTEC (Австрия). Содержание ЭТ-1 в сыворотке крови больных и пациентов контрольной группы выявили методом иммуноферментного анализа с использованием коммерческих тест-наборов «Эндотелин 1–21» (Biomedica Medizinprodukte GmbH&co, Австрия) в медицинском центре «Гепар» г. Махачкала. Для оценки степени резистентности к инсулину использовали малую модель гомеостаза с определением индекса инсулинорезистентности (ИР) (НОМА-1К). Использовались значения глюкозы и инсулина сыворотки крови натощак. За пороговое значение ИР принимали IR-НОМА, равный 2,77. Фильтрационную функцию почек оценивали по скорости клубочковой фильтрации, которую определяли расчетным методом по формуле CKD-EPI с учетом возраста, пола, этнической принадлежности пациентов и уровня эндогенного креатинина крови.
Статистическая обработка полученных в ходе исследования результатов проводилась с помощью программы Statistica for Windows 6.1 (StatSoft Inc.). Качественные признаки описывались с помощью абсолютных и относительных (%) показателей. Количественные – с помощью медианы (Ме) и квартилей (Ме [25-й; 75-й процентили]). Статистическая достоверность различий между группами определялась методом Манна-Уитни; уровень достоверности был принят как достаточный при p<0,05. При проведении корреляционного анализа применялся коэффициент ранговой корреляции Спирмена - (R).
Результаты и обсуждение
Уровень тощаковой глюкозы согласно критериям включения не превышал 5,6 ммоль/л и в среднем составил 5,3 [5,1; 5,6] ммоль/л. Однако у всех больных отмечалась резистентность к инсулину, индекс инсулинорезистентности IR-HOMA составил 4,6 [3,4; 5,0]. В контрольную группу лица с резистентностью к инсулину не включались, IR-HOMA -1,7 [1,6; 2,0].
Абдоминальное ожирение отмечалось у всех больных, обхват талии у женщин составил 111,8 [110,0; 115,0] см, у мужчин – 116,4 [115,0; 119,0] см, ИМТ в среднем 35,0 [32,5; 36,5]. Также у всех пациентов наблюдалась артериальная гипертензия: уровень систолического давления в среднем достигал 155,0 [149,0; 160,0] мм рт. ст., диастолического - 90,0 [90,0; 95,0] мм рт. ст. Повышенный уровень холестерина был выявлен у 62 (75,6%) пациентов, в среднем уровень холестерина составил 6,4 [6,0; 6,7] ммоль/л, липопротеидов низкой плотности - 4,0 [3,7; 5,7]. У 58 (70,3%) больных отмечался повышенный уровень триглицеридов, в среднем 2,5 [1,8; 2,6] ммоль/л.
Из 82 исследуемых пациентов у 42 (51,2%) было выявлено превышение толщины комплекса интима-медиа сонных артерий, составившее 1,2 [1,0; 1,3] см. Толщина межжелудочковой перегородки превышала нормальные физиологические значения у 48 (58,5%) и в среднем составила 1,1 [1,0; 1,2] см.
Соответственно целям работы из исследования исключались пациенты со скоростью клубочковой фильтрации ниже 60 мл/мин/1,73 м2. У 14 (17,1%) была выявлена гиперфильтрация, оптимальная фильтрация – у 32 (39,0%), незначительно сниженная скорость клубочковой фильтрации - у 36 (43,9%) (рисунок). Уровень креатинина в среднем составил 82,0 [78,0; 87,0] ммоль/л.
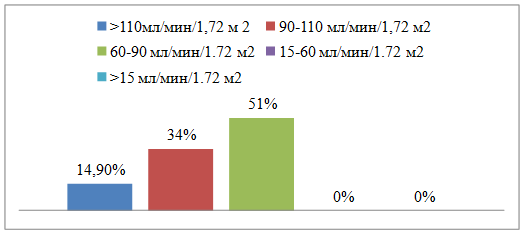
Результаты расчета СКФ по формуле CKD-EPI
Однако в то же время у больных метаболическим синдромом было выявлено статистически достоверное превышение выделения альбумина с мочой в разовой порции по сравнению с контрольной группой (25,6 [15,6; 30,9] мкг/мл и 9,3 [6,4; 13,4] мкг/мл соответственно; p<0,001).
Также на основании повышения уровня эндотелина-1 у больных основной группы по сравнению с контрольной (5,9[3,6; 10,1] фмоль/мл и 3,4 [2,4; 4,0] фмоль/мл соответственно; p=0,012) можно отметить развитие у больных основной группы эндотелиальной дисфункции (таблица).
Показатели уровня ЭТ-1 и МэА у обследуемых пациентов в сравнении с контрольной группой
Примечание: *- p=0,01 и **-p=0,001, по сравнению с контрольной группой.
|
ИССЛЕДУЕМАЯ ГРУППА |
КОНТРОЛЬНАЯ ГРУППА |
|
|
ЭТ-1 (фмоль/мл) |
5,9 [3,6; 10,1] |
3,4 [2,4; 4,0] |
|
МЭА (мкг/мл) |
25,6 [15,6; 30,9] |
9,3 [6,4; 13,4] |
При проведении корреляционного анализа выявлена прямая корреляция уровня МЭА и ЭТ-1 (R=0,47; p=0,005).
Также выявлена прямая корреляция уровня МЭА с IR-HOMA (R=0,69; p<0,008), толщиной межжелудочковой перегородки (R=0,80; p<0,001), с ТКИМ (R=0,49; p<0,007) и систолическим артериальным давлением (R=0,45; p=0,026).
Подобные зависимости отмечены и для уровня ЭТ-1: IR-HOMA (R=0,77; p<0,001), с толщиной межжелудочковой перегородки (R=0,65; p=0,001), с ТКИМ (R=0,40; p<0,035) и систолическим артериальным давлением (R=0,43; p=0,038).
Выводы
1. У больных с метаболическим синдромом могут быть нарушения функционального состояния почек и эндотелия, на ранних стадиях проявляющиеся изменением скорости клубочковой фильтрации, повышением уровня мочевой экскреции альбумина и увеличением концентрации эндотелина-1 в крови.
2. Прямая корреляция уровня экскреции альбумина с мочой и уровня эндотелина-1, а также совпадение корреляционных взаимоотношений этих показателей с рядом клинико-лабораторных показателей метаболического синдрома позволяют считать повышение уровня экскреции альбумина с мочой одним из маркеров эндотелиальной дисфункции.
Библиографическая ссылка
Бейбалаева А.Т., Маммаев С.Н., Каримова А.М. ВЗАИМОСВЯЗЬ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПОЧЕК С УРОВНЕМ ЭНДОТЕЛИНА-1 У БОЛЬНЫХ МЕТАБОЛИЧЕСКИМ СИНДРОМОМ // Современные проблемы науки и образования. 2017. № 6. ;URL: https://science-education.ru/ru/article/view?id=27254 (дата обращения: 15.02.2026).



