Глиальные опухоли являются наиболее распространенной первичной опухолью головного мозга у взрослого населения, о чем свидетельствуют официальные зарубежные реестры по эпидемиологии опухолей центральной нервной системы и литературные данные [1-3]. Данная группа характеризуется общим происхождением, агрессивным течением, выраженным инвазивным ростом, быстрым прогрессированием заболевания, а также высоким процентом рецидивирования и склонностью к малигнизации [1; 4; 5]. Согласно классификации Всемирной организации здравоохранения (WHO), среди глиальных опухолей выделяют четыре степени злокачественности, от I степени (наименее злокачественные) до IV (наиболее злокачественные), степени III и IV относятся к высокозлокачественным глиальным опухолям [3]. Глиома IV степени злокачественности также известна как глиобластома, являющаяся наиболее распространенной и малигнизированной среди других глиом [1; 6]. Как правило, по статистике, такие пациенты из-за грубого неврологического дефицита и низкого качества жизни оказываются инвалидами и нуждающимися в посторонней помощи. Медиана продолжительности жизни больных с анапластической астроцитомой (III степень злокачественности) на фоне проводимого стандартного комплексного лечения составляет порядка 30 месяцев, тогда как данный показатель у пациентов с глиобластомой (IV степень злокачественности) варьирует от 12 до 14 месяцев [7-9]. Представленная распространенность глиальных опухолей и продолжительность жизни больных с данной патологией, достигнутая стандартным комбинированным лечением, включающим резекцию опухоли, лучевую терапию и химиотерапию темозоломидом, диктует необходимость поиска дополнительных методов комплексного лечения больных с указанной нозологией.
Возможность только хирургического лечения в виде радикального удаления глиальной опухоли, несмотря на применение соответствующей микрохирургической техники, имеет ряд ограничений: отсутствие четких границ со здоровой тканью мозга, физиологическая значимость пораженных зон и инфильтрация опухолевыми клетками перифокальной зоны прилежащего головного мозга. При назначении адъювантного лечения, такого как химио- и лучевая терапия, следует принимать во внимание низкую чувствительность глиом к данным методам [4; 10; 11].
Согласно данным литературы, на сегодняшний день одним из наиболее успешных направлений в лечении высокозлокачественных глиом является применение иммунотерапии в дополнение к стандартным методам лечения [12-14]. Существует несколько иммунотерапевтических подходов, включающих как неспецифический, так и антигенспецифический вариант иммунотерапии. Примерами неспецифического варианта иммунотерапии могут служить применение цитокинов (IL-2, IFN-a), лимфокин-активированных киллерных (ЛАК) клеток и полиадъювантов, тогда как примерами антигенспецифического варианта является использование антигенспецифических цитотоксических Т-клеток, полученных при активации лимфоцитов ex vivo в присутствии опухолевых антигенов, а также различные протоколы иммунизации опухолевыми антигенами, на основе пептидов, дендритных и опухолевых клеток. Предполагается, что сочетание представленных вариантов между собой повышает эффективность иммунотерапии. Результаты одного из исследований, основанного на применении антигенспецифических цитотоксических Т-лимфоцитов совместно с курсом интерлейкина-2, показали увеличение продолжительности жизни у больных с высокозлокачественными глиальными опухолями [5]. Однако в дальнейшем у пациентов наблюдалось рецидивирование опухоли, что говорит об уместном поддержании противоопухолевого иммунитета по завершении курса комбинированной иммунотерапии. В дополнение к вышеприведенному выводу наличие рецидива указывает на присутствие оставшихся опухолевых клеток после окончания курса комбинированной иммунотерапии. Представленные заключения подталкивают к поиску более эффективных методов генерации цитотоксических лимфоцитов.
В результате этого большой интерес представляет применение дендритных клеток как основного источника клеток, презентирующих опухолевый антиген. Данное свойство обусловлено наличием большого количества факторов, определяющих их эффективность: сочетание макропиноцитоза и особенности продукции антигена (АГ), направленная миграция в лимфоидные органы, увеличение поверхности ДК за счет образования цитоплазматических отростков в процессе созревания, высокое содержание комплексов гистосовместимости (МНС-АГ), экспрессия более широкого набора молекул адгезии и костимуляции, секреция различных цитокинов [7; 13; 14]. Как следствие, все эти факторы позволяют ДК быть более активными в индукции иммунного ответа на чужеродные АГ. Помимо основного качества, демонстрируется способность ДК к подавлению опухолевого роста в результате рестимулирования лимфоцитов и повышения их противоопухолевой активности. В свою очередь, немаловажным фактом является описание безопасности и хорошей переносимости вакцинотерапии, что подтверждается в исследованиях различных авторов [5; 8]. В данных источниках зарегистрированы только два клинических случая с проявлением воспалительной реакции как побочного эффекта: у пациента с большой остаточной опухолью после хирургического лечения и при выполнении кожной аллергической пробы для диагностики гиперчувствительности замедленного типа. На основании вышеперечисленного вакцинотерапия с использованием дендритных клеток представляет собой многообещающий метод иммунотерапии, позволяющий увеличить длительность безрецидивного периода и общей продолжительности жизни.
Исходя из этого целью нашего исследования являлась оценка безопасности и эффективности комбинированной иммунотерапии (КИТ) по новому протоколу лечения, с применением аутологичных дендритных клеток.
Материал и методы. Наше исследование было выполнено на базе клиники нейрохирургии Новосибирского НИИТО в период с 2006 по 2013 год, которое заключалось в применении методов комбинированной иммунотерапии, состоящей из двух этапов: локорегиональное введение цитотоксических лимфоцитов (ЦТЛ) в ложе удалённой опухоли и последующая 5-6-кратная инъекция противоопухолевой вакциной на основе ИФН-альфа индуцированных дендритных клеток, которые использовались не только как антигенпрезентирующие клетки, но и как клетки, потенциально обладающие прямой цитотоксической активностью на опухолевые клетки. Пациенты были разделены на опытную и контрольную группы, состоящие из 49 и 51 пациента соответственно. Группа исследования, помимо стандартного комплексного лечения, включающего резекцию опухоли, химио- и лучевую терапию, получала комбинированную иммунотерапию состоящую из вышеперечисленных этапов. Предоперационная подготовка включала в себя ряд параклинических и инструментальных методов исследований с обязательным выполнением МРТ головного мозга с контрастным усилением и с последующим послеоперационным МРТ-контролем. В течение данного этапа у пациентов основной группы осуществлялся забор крови в объеме 300 мл для получения мононуклеарных клеток. В это же время, с целью снятия перифокального отёка и нивелирования неврологического дефицита, назначались синтетические глюкокортикостероиды (ГКС) в дозе от 16 до 32 мг/сут., с непосредственным продолжением гормональной терапии после оперативного вмешательства. Следующим этапом после проведенного регламентированного дообследования было хирургическое лечение, целью которого являлось максимально возможное удаление опухоли. Во время последнего хирургического лечения выполнялся забор опухолевой ткани для определения морфологической составляющей новообразования и получении суспензии опухолевых клеток для проведения КИТ. Сроки операции варьировали от 1 до 3 дней с момента поступления. Далее выполнялся первый этап комбинированной иммунотерапии, который заключался во введении цитотоксических лимфоцитов (ЦТЛ) в ложе удаленной опухоли через установленный во время операции катетер, генерированных путем культивирования мононуклеарных клеток крови больного с дендритными клетками, нагруженными опухолевым антигеном, в присутствии рекомбинантного ИЛ-2, в виде двух процедур с интервалом 48 ч. Последующий этап комбинированной иммунотерапии выполнялся в условиях Научно-исследовательского института фундаментальной и клинической иммунологии в виде 5-6-кратной инъекции противоопухолевой вакцины на основе ИФН-альфа индуцированных дендритных клеток.
Результаты и обсуждение. В результате сравнения кривых выживаемости больных контрольной и опытной группы были получены статистически достоверные отличия медиан выживаемости: 12 и 26 месяцев соответственно (p=0,013). При разделении общей массы пациентов на подгруппы, соответствующие гистологической принадлежности оперированных образований, достоверные различия получены для больных глиобластомами (ГБ): медиана выживаемости в группе без иммунотерапии (ИТ) составляла 11 месяцев против 15 месяцев у пациентов, получивших КИТ (p=0,03) (рис. 1). Тем временем у больных анапластической астроцитомой кривые выживаемости различались недостоверно p=0,263 [15].
Обоснованием срока проведенного исследования является длительный подбор пациентов с учетом схожести нижеперечисленных параметров. Исходя из этого, были проанализированы группы больных ГБ по возрасту, полу, объёму выполненного стандартного комплексного лечения, включающего хирургическую резекцию, химио- и лучевую терапии, дозам полученной противоотёчной гормональной терапии и индексу качества жизни по шкале Карновского, где достоверных различий получено не было. Достоверные различия (p=0,007) получены по критерию наличия продолженного роста опухолей: в группе КИТ 18 из 27 больных оперированы по поводу рецидива опухоли, в то время как в группе без ИТ аналогичный показатель составлял 9 из 30 (рис. 2) [15].
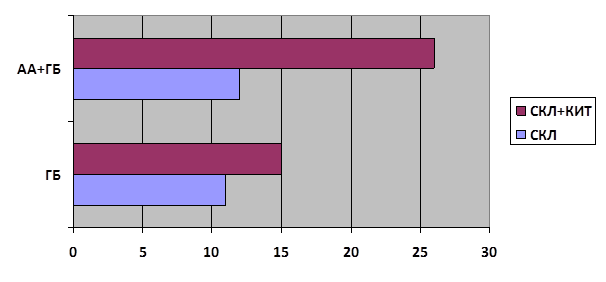
Рис. 1. Общая продолжительность жизни пациентов
*СКЛ – стандартное комплексное лечение; КИТ – комбинированная иммунотерапия;
АА – анапластическая астроцитома; ГБ – глиобластома
В дальнейшем было решено определить, оказывает ли влияние данный фактор на кривые выживаемости. Для этого были оценены показатели продолжительности жизни относительно времени последней проведённой операции, были получены различия в медианах в 5 и 7 месяцев, носившие характер отчётливого тренда p=0,066 [15].
Дискуссия. Иммунная система является основным барьером на пути возникновения злокачественных опухолей, а активация специфического и неспецифического иммунного ответа предполагает возможность воздействия на опухолевый процесс, тем самым демонстрируя вероятность эффективного пути борьбы с онкологическими заболеваниями. Основываясь на фактах, указывающих, что иммунодефицитные состояния приводят к повышению частоты появления онкологического процесса, поскольку опухоли часто вырабатывают иммуносупрессирующие факторы для преодоления ограничений, накладываемых на их рост иммунной системой, и основываясь также на положительных результатах иммунотерапии злокачественных опухолей, полученных на экспериментальных моделях и в клинических исследованиях как с опухолями ЦНС, так и другой локализации, есть надежда на благоприятный исход в развитии иммунного ответа против опухоли. Таким образом, на сегодняшний день проблема лечения глиальных опухолей остаётся по-прежнему актуальной в нейрохирургии.
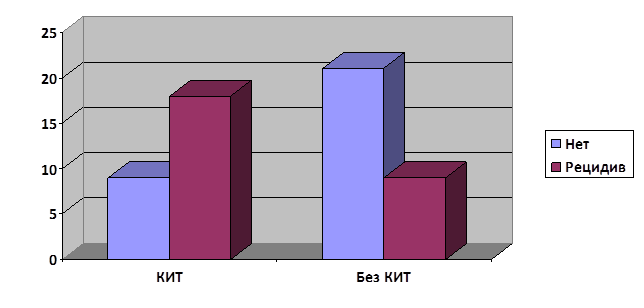
Рис. 2. Показатель продолженного роста в подгруппах пациентов
В период с 1999 по 2006 год в клинике нейрохирургии Новосибирского НИИТО уже была показана эффективность и безопасность КИТ с использованием лимфакин-активированных клеток (ЛАК). Однако невысокая эффективность при клиническом исследовании ЛАК-терапии, серотерапии глиальных опухолей, а также современные знания в иммунологии повлияли на возникновение новой методики, основанной на применении основных антиген-представляющих клеток, из которых высокоэффективными являются дендритные клетки. Последние способны экспрессировать в необходимом количестве костимулирующие молекулы, требующиеся для активации противоопухолевого иммунного ответа. Существуют литературные данные, что Т-клетки могут активироваться только, когда антиген представлен ДК [6; 7]. Данные клетки способны приблизиться к опухолевым клеткам, изолировать антигены опухоли и активировать Т-киллеры (CD8), минуя поддержку Т-хелперов (CD4). В связи с этим в новом исследовании мы решили модифицировать протокол ИТ, добавив ИФН-альфа индуцированные дендритные клетки, обладающие цитотоксической активностью.
Выводы. Результаты проведенного исследования показали, что данная методика является безопасным методом лечения, обладая определённой эффективностью, которая проявляется в увеличении сроков выживаемости у больных злокачественными глиомами, что позволяет заключить, что КИТ является оправданным методом адъювантной терапии указанной патологии.
Библиографическая ссылка
Короткая Н.А., Мишинов С.В., Ступак В.В., Тыринова Т.В., Леплина О.Ю., Останин А.А., Черных Е.Р. КОМБИНИРОВАННАЯ ИММУНОТЕРАПИЯ В ЛЕЧЕНИИ ГЛИАЛЬНЫХ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА // Современные проблемы науки и образования. 2017. № 6. ;URL: https://science-education.ru/ru/article/view?id=27066 (дата обращения: 13.03.2026).



