Проблему лечения острого холецистита на протяжении последних десятилетий следует считать во многом решенной. В последние годы повсеместно отмечены заметные успехи, что в первую очередь выражается в снижении летальности при хирургическом лечении данного заболевания [1-3].
В настоящее время вряд ли у кого возникает сомнение относительно целесообразности выполнения холецистэктомии при остром деструктивном воспалении желчного пузыря, особенно на фоне желчнокаменной болезни. Решенным следует считать вопрос о целесообразности использования для холецистэктомии мини-инвазивных вмешательств [4; 5]. В этом аспекте ведутся лишь разработки по модификации способов. Одним из них является мини-лапароскопическая хирургия, определяющая уменьшение диаметра рабочих инструментов, другим – хирургия единого лапароскопического доступа. Обе технологии позволяют уменьшить травматизацию тканей брюшной стенки. На сегодняшний день «модным» направлением такого рода лечения является гибридная мини-лапароскопически-ассистированная хирургия, в которой ассоциированы мини-лапароскопия и хирургия через естественные отверстия [6-9].
Следует признать, что в настоящее время резко ограничены противопоказания к лапароскопической холецистэктомии. Даже при самых тяжелых патологических изменениях в желчном пузыре и прилежащих к нему органах в большинстве случаев ее удается произвести.
Однако до сих пор остаются нерешенными вопросы, связанные с поражением органов, которые топографо-анатомически или функционально связаны с желчным пузырем. Безусловно, в первую очередь речь идет о печени. Известно, что при остром холецистите возникает ее поражение, но характер, продолжительность и степень его выраженности изучены явно недостаточно [10; 11].
Целью работы явилось изучение патогенетических особенностей острого повреждения печени на основании исследования ряда ее функциональных показателей у больных с разными формами острого деструктивного холецистита.
Материалы и методы исследования. Исследования клинико-лабораторного характера проведены у 95 больных острым холециститом. Всем пациентам осуществлялась лапароскопическая холецистэктомия, после которой выделены 2 группы. В первой группе, принятой за группу сравнения, у 45 больных интраоперационно (затем морфологически) диагностирован острый катаральный холецистит, во второй у 50 пациентов – острый деструктивный: флегмонозный (n=28) или гангренозный (n=22) холецистит.
В анализируемых группах пациенты были распределены по гендерным признакам, давности и причинам возникновения заболевания, общему состоянию и наличию сопутствующей патологии. В обеих группах преобладали пациенты в возрасте 41-60 лет. Средний возраст больных основной группы – 54,19±7,85 года, группы сравнения – 57,26±8,79 года.
При гендерной характеристике выявлено, что в обеих группах преобладают женщины (93 и 96% соответственно). При оценке общего состояния пациентов на момент госпитализации установлено, что чаще встречалось состояние средней степени тяжести, реже – тяжелое.
Сразу же при поступлении всем больным проведено ультразвуковое исследование (УЗИ) органов брюшной полости и фиброгастродуоденоскопия (ФГДС), по данным которых у больных обеих групп была выявлена сопутствующая патология со стороны желудочно-кишечного тракта. Наиболее часто диагностировали хронический гастрит (68–80%), панкреатит (17,7–22%), уплотнение печени (57,8–56%). Кроме этого, по данным УЗИ и ФГДС, в меньшем проценте случаев выявлены гепатомегалия, гипертензия желчевыводящих путей, холангит, дуодено-гастральный рефлюкс.
У пациентов при поступлении, в процессе лечения и при выписке из стационара изучен ряд клинико-лабораторных и биохимических показателей крови для оценки синдрома эндогенной интоксикации (ЭИ), интенсивности процесса перекисного окисления липидов (ПОЛ) и фосфолипазной активности.
Уровень эндотоксемии оценивали по содержанию молекул средней массы (МСМ) в сыворотке крови спектрофотометрически на спектрофотометре СФ-46 (длина волны 250 и 280 нм) [12].
Показатели диеновых (ДК) и триеновых конъюгатов (ТК) определяли спектрофотометрически по наличию максимумов поглощения при l= 232 и l=275 нм, уровень малонового диальдегида (МДА) – по реакции с 2-тиобарбитуровой кислотой. Активность супероксиддисмутазы (СОД) оценивалась способностью фермента тормозить аэробное восстановление нитросинего тетразолия до формазана [13]. Регистрацию каталитической деятельности фосфолипазы А2 (ФЛА2) проводили титрометрическим методом по мере образования свободных жирных кислот [14].
С целью определения физико-химических свойств альбумина оценивали эффективную (ЭКА) и общую (ОКА) концентрацию альбумина в сыворотке крови. Для оценки резерва связывания альбумина (РСА) использовали формулу РСА = ЭКА/ОКА. Для расчета индекса токсичности плазмы (ИТ) применяли формулу: ИТ = ОКА/ЭКА – 1 [15].
Лабораторные данные, принятые за норму, были определены у 18 здоровых лиц обоего пола в возрасте от 24 до 60 лет.
В работе при обработке полученных данных использованы методы вариационной статистики на основе специализированных компьютерных программ Statistica 5.5 for Windows, Excel for Windows XP Professional. Данные проверялись на нормальность распределения и представлялись в виде М±m, где М - среднее арифметическое, m - средняя ошибка среднего арифметического анализируемых показателей. Достоверность различий определяли параметрическим критерием t Стьюдента. За достоверные отличия принимались значения при достоверности нулевой гипотезы менее 0,05.
Результаты исследования и их обсуждение
При оценке общеклинических показателей крови пациентов с острым холециститом выявлено, что на момент поступления и при выписке не отмечаются статистически значимые изменения большинства показателей от физиологически установленных норм. Исключением стали уровень лейкоцитов и скорость оседания эритроцитов, которые превышали нормальные показатели в контрольные сроки.
Исследование выраженности ЭИ у больных острым холециститом разной степени тяжести в до- и послеоперационном периоде показало следующие изменения, представленные в таблице, которые имели сходную направленность при изучении показателей эндогенной интоксикации авторами [16; 17].
Установлено, что при катаральной и деструктивной формах острого холецистита на момент поступления регистрировали лабораторные признаки синдрома ЭИ. Так, в плазме крови отмечалось достоверное увеличение среднемолекулярных пептидов на 20,84-36,64 и 47,93-63,06% (р<0,05) для первой и второй групп соответственно. Регистрировали повышение ИТ по альбумину на 291,67 и 395,00% (р<0,05) соответственно.
Учитывая важнейшую роль печени как органа детоксикации и анатомическую близость желчного пузыря к органу, данные изменения, обусловленные наличием очага воспалительной альтерации, можно также считать опосредованными маркерами дисфункциональных явлений в печени.
После выполнения лапароскопической холецистэктомии регистрировали различную динамику исследованных токсических продуктов при катаральной и деструктивной формах острого холецистита.
При легкой степени тяжести заболевания в первые сутки послеоперационного периода отмечали некоторое увеличение маркеров эндотоксикоза в плазме крови, что, вероятно, связано с влиянием «хирургической агрессии». В последующем отмечалась положительная динамика исследованных показателей, и на конечном этапе наблюдения большая часть из них достигала нормальных значений.
Динамика показателей эндогенной интоксикации у больных острым холециститом
разной степени тяжести (M±m) [составлено по 15; 16]
|
Показатель |
Груп-па |
МСМ (λ=254 нм) усл. ед. |
МСМ (λ=280 нм) усл. ед. |
ОКА, г/л |
ЭКА, г/л |
РСА, усл. ед. |
ИТ, усл. ед. |
|
Норма |
261,92± 18,33 |
333,75± 34,38 |
54,30± 5,21 |
48,43± 5,08 |
0,89±0,09 |
0,12±0,01 |
|
|
При поступлении |
I |
357,89± 39,01 |
403,31± 28,63 |
49,73± 5,07 |
33,93± 2,82 |
0,68± 0,06 |
0,47± 0,05 |
|
II |
427,08± 35,45 |
493,72± 47,40 |
42,84± 4,63 |
28,40± 2,07 |
0,66± 0,05 |
0,51± 0,04 |
|
|
1-е сутки |
I |
371,99± 34,97 |
422,90± 35,52 |
42,77± 3,51 |
26,99± 2,11 |
0,67± 0,05 |
0,49± 0,06 |
|
II |
439,71± 34,30 |
505,38± 39,42 |
36,15± 3,11 |
22,85± 2,15 |
0,63± 0,05 |
0,58± 0,05 |
|
|
3-и сутки |
I |
325,03± 40,50 |
396,86± 37,09 |
44,21± 4,09 |
33,20± 1,69 |
0,75± 0,05 |
0,33± 0,05 |
|
II |
449,78± 48,58 |
533,50± 38,41 |
32,84± 2,82 |
20,08± 1,57 |
0,61± 0,04 |
0,64± 0,07 |
|
|
5-е сутки |
I |
300,67± 27,66 |
366,96± 33,76 |
48,81± 4,18 |
37,11± 2,59 |
0,76± 0,07 |
0,32± 0,04 |
|
II |
364,19± 36,78 |
455,34± 45,53 |
36,50± 2,55 |
25,39± 1,93 |
0,70± 0,08 |
0,44± 0,03 |
|
|
7-е сутки |
I |
271,39± 23,07 |
342,14± 32,50 |
50,53± 4,85 |
41,14± 3,85 |
0,81± 0,06 |
0,23± 0,02 |
|
II |
334,95± 25,79 |
406,23± 32,50 |
40,72± 4,03 |
30,64± 2,33 |
0,75± 0,06 |
0,33± 0,04 |
Примечание: жирный шрифт - достоверность отличия от установленной нормы при p<0,05.
При деструктивном холецистите было выявлено более длительное и тяжелое течение интоксикационного синдрома. Так, в первые и третьи сутки после операции показатели МСМ продолжали возрастать и превышали норму на 51,42-67,88 и 59,85-71,72% (р<0,05) соответственно. На пятые сутки терапии содержание данных гидрофобных продуктов в плазме крови снижалось, но оставалось выше нормы на 36,43-39,05 и 21,72-27,88% (р<0,05) соответственно. Регистрировали снижение ОКА в плазме крови относительно нормы на 33,43% (р<0,05) на первые сутки наблюдения, на 39,52% (р<0,05) – на вторые сутки, на 32,78% (р<0,05) – на третьи сутки, на 25,01% (р<0,05) – на пятые. Аналогичная динамика была выявлена и относительно ЭКА и РСА. ИТ плазмы крови по альбумину был выше нормы на всех этапах послеоперационного наблюдения на 383,33, 433,33, 266,67 и 175,00% (р<0,05) соответственно.
Изучение состояния универсальных механизмов клеточного повреждения в плазме крови при различных степенях тяжести острого холецистита показало следующие результаты. Было выявлено, что на момент поступления пациентов в клинику показатели ПОЛ, фосфолипазной активности и состояние антиоксидантной системы организма были достоверно изменены в сторону активизации универсальных механизмов мембранного повреждения. При деструктивной форме острого холецистита данные изменения были существенно более выражены относительно катаральной формы заболевания.
В послеоперационном периоде у пациентов первой группы было выявлено увеличение продуктов липопероксидации и активности ФЛА2 на первые сутки после операции. В дальнейшем данные показатели начинали снижаться, показывая положительную динамику (рис. 1-4). Активность СОД в 1-5-е сутки послеоперационного периода была ниже нормы на 10,3-14,5% (p<0,05), к 7-м суткам достоверно от нормы не отличалась.
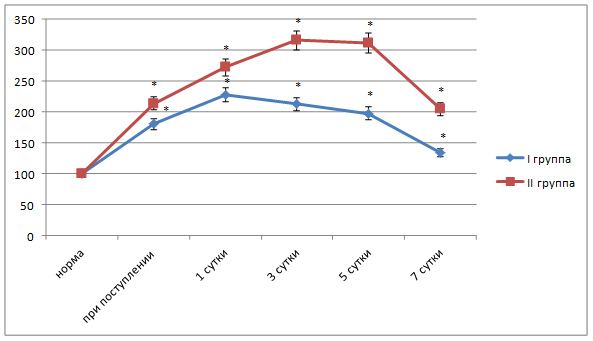
Рис. 1. Динамика показателя диеновых конъюгатов в плазме крови больных острым холециститом разной степени тяжести. Здесь и далее в рисунках: I – пациенты с катаральным холециститом, II – пациенты с деструктивным холециститом;
* - достоверность отличия от установленной нормы при p<0,05
Во второй группе исследования у пациентов с деструктивным холециститом отмечали увеличение первичных и вторичных продуктов ПОЛ в течение трех суток послеоперационного периода. Так, содержание МДА было выше нормы на первые сутки терапии на 176,3% (р<0,05), на третьи - на 185,4% (р<0,05), на пятые – на 162,5% (р<0,05) и на седьмые сутки – на 81,3% (р<0,05) (рис. 3). Активность фосфолипазы А2 показала аналогичную динамику (рис. 4). Было зарегистрировано снижение активности СОД в динамике всего периода наблюдения на 18,4-28,1% (p<0,05).
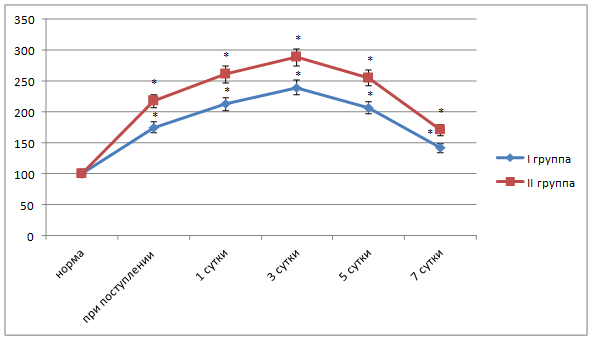
Рис. 2. Динамика показателя триеновых конъюгатов в плазме крови больных острым холециститом разной степени тяжести
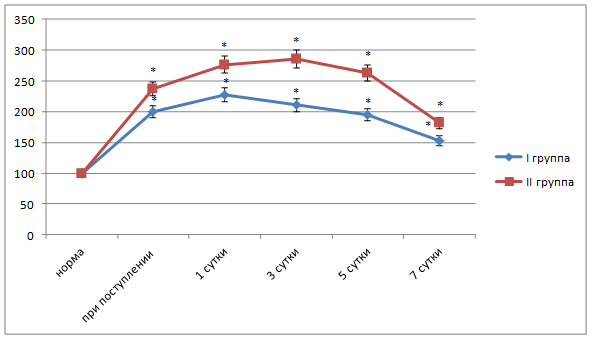
Рис. 3. Динамика показателя малонового диальдегида в плазме крови больных острым холециститом разной степени тяжести
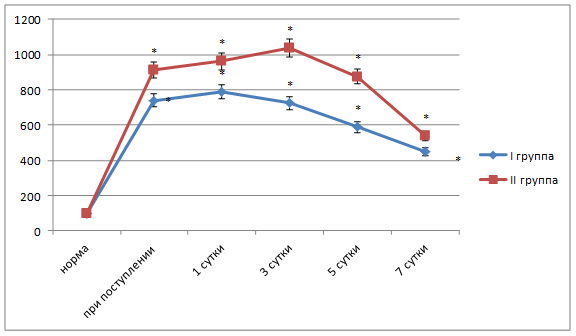
Рис. 4. Активность фосфолипазы А2 у больных острым холециститом разной степени тяжести
Заключение. Таким образом, анализ клинико-лабораторных результатов исследований показывает, что при остром холецистите до операции, и особенно в первые сутки раннего послеоперационного периода, отмечаются нарушения функционального статуса печени. Показано, что их выраженность сопряжена с воспалительным процессом в органе поражения. При начальной (катаральной) форме острого холецистита существенные изменения со стороны печени отмечаются только в первые сутки после операции, в дальнейшие сроки – они незначительные. При деструктивной же форме они отличаются и выраженностью, и продолжительностью. В патогенезе дисфункциональных явлений печени при остром холецистите важную роль играет процесс липопероксидации и активизация фосфолипаз, активность которых при деструктивных формах достоверно выше, что определяет их значимость в триггерных механизмах развития дизрегуляционной патологии. Отметим еще один факт значимости операционной травмы (хирургической агрессии) для функционального статуса печени. Даже в условиях малотравматичных вмешательств возникают патологические реакции, способные влиять на ее функциональные характеристики.
Библиографическая ссылка
Власов А.П., Шейранов Н.С., Власова Т.И., Курочка Ю.Г., Муратова Т.А., Кумар Н.-. ОСТРОЕ ПОРАЖЕНИЕ ПЕЧЕНИ ПРИ ОСТРОМ ДЕСТРУКТИВНОМ ХОЛЕЦИСТИТЕ // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=27034 (дата обращения: 14.02.2026).



