Гомеостаз микро- и макроэлементов тесно связан с функционированием желудочно-кишечного тракта. Цинк стимулирует транскрипцию генов и пролиферацию клеток, а также отвечает за активацию ДНК и РНК-полимеразы [1]. Этот микроэлемент входит в состав ряда ферментов: щелочной фосфатазы, карбоксипептидаз, ряда дегидрогеназ, аминопептидаз, ангидраз, супероксиддисмутазы и др. [2]. Имеются предположения об участии цинка в поддержании целостности слизистой оболочки желудка [14]. В экспериментах установлено стимулирующее влияние цинка на продукцию слизи в желудке, что может являться одним из механизмов гастропротекции [6]. В экспериментах на животных показано, что цинкдефицитная диета способствует развитию язвенных поражений слизистых оболочек желудка и кишечника и увеличивает степень выраженности экспериментальных повреждений желудка [11]. В ходе экспериментальных исследований также было выявлено, что гипертрофические, эрозивные (по данным эндоскопии) и диффузные (по данным морфологического исследования) изменения в слизистой двенадцатиперстной кишки и антрального отдела желудка коррелировали с более низкими показателями цинка в сыворотке крови. Введение терапевтических доз цинка в состав комплексного лечения способствовало положительной лабораторной динамике [1]. Результаты доклинических и клинических исследований свидетельствуют о том, что цинк-содержащие соединения могут быть успешно использованы для профилактики и для лечения язвенной болезни желудка [11, 6]. Цинк способствует стабилизации лизосомальных мембран, обусловливая терапевтический эффект при эрозивных гастропатиях [8].
Дефицит магния приводит к замедлению синтеза белковых молекул и нуклеиновых кислот, так как является активатором таких ферментов как: ДНК-полимераза, РНК-полимераза, полинуклеотидаза. В ходе экспериментальных исследований доказано, что недостаток магния негативно влияет на заживление эрозивных дефектов [5]. В настоящее время известно о нарушениях статуса магния в качестве основного патофизиологического события при развитии язвы желудка [13]. Показано, что введение магния крысам обладает мощным антиульцерогенным действием, вероятно, за счет ингибирования роста уровней синтетазы оксида азота мРНК и оксида азота в слизистой оболочке желудка [12]. Под влиянием магнийсодержащей композиции происходит разной степени выраженности снижение содержания малондиальдегида в тканях желудка и плазме крови, который, в свою очередь, появляется в крови при деградации полиненасыщенных жирных кислот в процессе язвообразования [7]. Магний является важным фактором для образования соляной кислоты, регулирует секрецию желудка вместе с кальцием [10]. Дисбаланс в магний кальциевой системе может привести к нарушению работы желудочно-кишечного тракта. В частности, у крыс площадь язвы коррелирует с механизмами перераспределения кальция, возможна мобилизации его из депо в активную фазу язвенного повреждения, и снижения в фазы рубцевания и эпитализации [4].
Нарушения функционирования желудочно-кишечного тракта приводит к изменению содержания микро и макроэлементов в плазме крови, что может помочь в ранней диагностике таких заболеваний, как язва желудка и двенадцатиперстной кишки, что и определяет важность данного вопроса.
Цель работы – определить изменения баланса цинка, магния и кальция в сыворотке крови крыс с ацетатной моделью ульцерогенеза.
Материалы и методы исследования
Исследования проведены в пяти сериях опытов на лабораторных беспородных крысах массой 250–300 г, содержащихся в стандартных условиях вивария медико-биологической клиники КГМУ. Работа выполнена с соблюдением этических норм использования животных в медико-биологической практике, руководствуясь приказом № 755 от 12.08.77 МЗ СССР «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных», приказом Министерства высшего образования СССР № 724 (1984) «Правила проведения работ с использованием экспериментальных животных» и положениями Директивы 2010/63 EU Европейского парламента и Совета ЕС по охране животных, используемых в научных целях.
Опытным животным воспроизводили ацетатную модель язвенного повреждения желудка, которая используется в современных исследованиях для изучения развития и заживления хронических язв [15]. Для этого крыс после суточного голодания наркотизировали с помощью хлоралгидрата (300 мг/кг). Затем производили срединную лапаротомию и обнажали желудок. К его серозной поверхности в течение 15 секунд плотно прижимали кружок фильтровальной бумаги диаметром 7—8 мм, смоченный в ледяной уксусной кислоте. Для стандартизации условий язвообразования бумагу накладывали примерно на одно и то же место желудка крысы (в области пилорического отдела). Внутренние швы обрабатывали порошком пенициллина или стрептоцида; шов на коже обрабатывали йодом. Прооперированных животных помещали в клетку с чистыми опилками. Обеспечивали свободный доступ к пище и воде. В первые два дня после операции производился ежедневный осмотр наружного шва — его целостности и чистоты.
Для изучения динамики развития язвообразования животных выводили из эксперимента на 3-и сутки (группа № 2), 4-е (группа № 3), 6-е (группа № 4) и 7-е сутки (группа № 5). Контролем служили ложнооперированные животные (группа № 1), которым производили лапаротомию без моделирования язвенного повреждения
Забор крови производили методом пункции сердца. У крыс средних размеров получали 3–5 мл крови, которую аккуратно помещали в вакуумные пробирки UNIVAC® с активатором свертывания крови и центрифугировали на скорости 3000 оборотов в течение 10 минут. В полученной сыворотке определяли содержание цинка, магния и кальция с помощью автоматического анализатора Random Access A-25.
Для оценки состояния слизистой оболочки желудка делали разрез по малой кривизне, подсчитывали количество деструкций у каждого животного, процентное соотношение пораженных животных, и на основании полученных данных рассчитывали значения «язвенного индекса» Паулса [9].
Полученные данные проверяли на нормальность распределения с использованием тестов Шапиро – Уилка. В зависимости от формы распределения для оценки статистической значимости различий между выборками применяли критерии Стьюдента или Крускала –Уоллиса.
Результаты исследования и их обсуждения
На третьи сутки у экспериментальных животных наблюдалось повышение концентрации ионов цинка в сыворотке крови на 35,5 % (p<0,05) по сравнению со значениями контрольной группы. Затем содержание цинка снижалось относительно контроля на 16,3 % (четвертые сутки эксперимента), к шестым суткам это снижение становилось значимым и составило 62,7 % (p<0,05) , а к седьмым – 75,7 % (p<0,05) (табл.1).
Таблица 1
Динамика содержания электролитов в сыворотке крови крыс при моделировании ацетатной язвы, ± m, Ме [P1;P2]
|
Показатель |
Группа №1 (контроль) |
Группа №2 (3 сутки) |
Группа №3 (4 сутки) |
Группа №4 (6 сутки) |
Группа №5 (7 сутки) |
|
Zn в сыворотке крови лабораторных крыс (ммоль/л) |
68±0,24 |
92,2* [97,5 56,7 143,9] |
56,9±7,6 |
25,3±1,9* |
16,5±1,1* |
|
Мg в сыворотке крови лабораторных крыс (ммоль/л) |
1,65 ±0,09 |
1,59 ± 0,02 |
1,32 ±0,06* |
1,02 ±0,03* |
1,05 ±0,02* |
|
Ca в сыворотке крови лабораторных крыс (ммоль/л) |
3,19±0,22 |
3, 98 ±0,08 |
2, 26±0,05* |
3,02±0,22 |
2,72±0,25 |
Примечание: *Статистически значимые отличия от значений контрольной группы (p<0,05).
Концентрация ионов магния также уменьшалась с четвертых (на 25 %, p<0,05) по седьмые сутки эксперимента (на 38,2% (p<0,05) в сравнении со значениями контрольной группы. Содержание кальция возрастало на 24,7 % на третьи сутки, к четвертым снижалось на 29,1 % (р<0,05), а к шестым суткам восстанавливалось до значений контрольной группы.
Колебания концентрации электролитов в сыворотке крови экспериментальных животных с моделью язвенного повреждения желудка могут быть интерпретированы в сопоставлении со значениями «язвенного индекса» Паулса. Наибольшим его значение было на третьи сутки эксперимента, что соответствует максимальной степени повреждения слизистой желудка. Уменьшение индекса Паулса до 1,3 к седьмым суткам эксперимента (табл. 2) подтверждает высокую активность регенеративных процессов.
Таблица 2
Изменения «язвенного индекса» при моделировании ацетатной язвы
|
Группа |
Среднее число деструкций на 1 животное (М+m) |
Процентное поражение животных |
Индекс Паулса |
|
Группа №1 (контроль) |
- |
- |
- |
|
Группа №2 (3 сутки) |
13±1,6 |
100 |
13 |
|
Группа №3 (4 сутки) |
4,7±0,5 |
90 |
4,23 |
|
Группа №4 (6 сутки) |
3,4±0,3 |
65 |
1,9 |
|
Группа №5 (7 сутки) |
2±0,2 |
56,2 |
1,3 |
Полученные результаты свидетельствуют о повышении концентрации цинка и кальция в сыворотке крови в острую фазу развития язвенного повреждения (третьи сутки эксперимента). В фазу рубцевания и эпителизации (шестые и седьмые сутки эксперимента) их содержание существенно снижалось. Концентрация магния также уменьшалась, но снижение происходило постепенно, начиная с четвертых суток эксперимента.
Изменения острой фазы можно объяснить разрушением клеточных белков, в частности, цинкзависимых ферментов, вследствие чего и повышается уровень цинка в крови [6]. Спад интенсивности повышения концентрации ионов цинка в плазме крови является одним из показателей активации репаративных процессов, в которых цинк используется для образования новых ферментов пролиферации и дифференцировки. Механизм снижения концентрации ионов цинка в сыворотке крови может быть также связан с потенцированием энергетического обмена в клетках желудочно-кишечного тракта, учитывая известные данные об увеличении содержания АТФ в клетках слизистой оболочки желудочно-кишечного тракта под влиянием цинка [8]. Снижение концентрации ионов магния также совпадает со временем заживления язвенных дефектов слизистой желудка, что может быть обусловлено накоплением магния активно делящимися клетками, участвующими в репарации поврежденных тканей желудка [6]. Колебания концентрации кальция в сыворотке крови экспериментальных животных на различных этапах язвообразования может быть обусловлено взаимоотношениями метаболизма кальция и секреции соляной кислоты [3]. Относительные изменения концентрации исследуемых ионов в сыворотке крови представлены на рисунке 1.
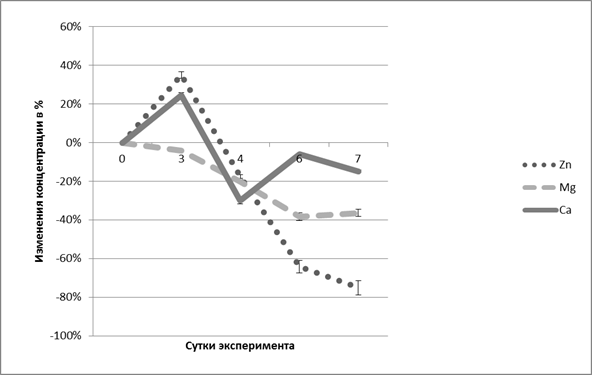
Рис. 1. Относительные изменения концентрации цинка, магния и кальция в сыворотке крови крыс с ацетатной моделью язвенного повреждения желудка
Рассматривая полученные данные с точки зрения системной регуляции и ее нарушений, важно обратить внимание на изменение кальций-магниевых соотношений. Известно, что магний действует как физиологический антагонист кальция, конкурируя с ним за потенциалзависимые и рецепторуправляемые каналы [4]. В нашем исследовании концентрации кальция в сыворотке крови контрольных крыс в 1,9 раза превышала концентрацию магния (рис. 2).
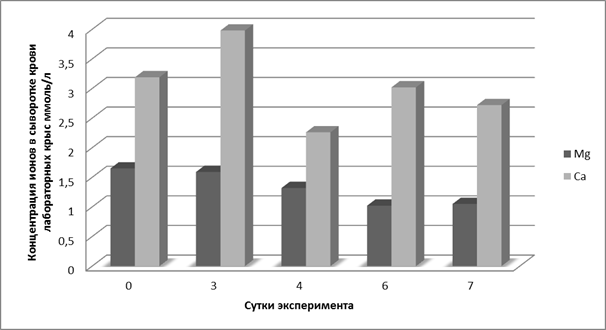
Рис. 2. Кальциево-магниевые соотношения в сыворотке крови крыс с ацетатной моделью язвенного повреждения желудка
Это соотношение нарушалось в процессе формирования и последующего заживления язвенного дефекта слизистой оболочки желудка. Концентрация ионов кальция по сравнению с концентрацией ионов магния в сыворотке крови на третьи сутки эксперимента была выше в 2,5 раза, на шестые – в 2,96 раза, а на седьмые – в 2.59 раза. В то же время на четвертые сутки эксперимента кальций-магниевое соотношение составило 1,71, что свидетельствует о снижении относительной концентрации кальция во время перехода к активной репарации поврежденной слизистой желудка.
Выводы
1. В условиях экспериментального моделирования язвенного повреждения желудка наблюдаются фазовые колебания концентрация ионов цинка и кальция в сыворотке крови крыс.
2. Динамика изменения содержания электролитов (цинка, магния, кальция) в сыворотке крови крыс коррелирует с изменениями значения «язвенного индекса» Паулса.
3. Максимальная степень повреждения слизистой желудка сопровождается повышением содержания цинка (на 35,5%, p<0,05) и кальция (на 29,1 % p<0,05). В фазу рубцевания и эпителизации наблюдается снижение концентрации ионов цинка (на 75,7%, p<0,05) и магния (на 38,2 %, p<0,05) в сыворотке крови экспериментальных животных.
Библиографическая ссылка
Привалова И.Л., Камал Э.Т., Озерова И.Ю. ИЗМЕНЕНИЯ БАЛАНСА ЦИНКА, МАГНИЯ И КАЛЬЦИЯ В СЫВОРОТКЕ КРОВИ КРЫС С АЦЕТАТНОЙ МОДЕЛЬЮ УЛЬЦЕРОГЕНЕЗА // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=27005 (дата обращения: 14.02.2026).



