Цель тканевой инженерии – создание функциональных тканевых трансплантатов, которые могут способствовать регенерации или замещению дефектов в тканях. В настоящее время исследуются возможности создания трансплантатов – тканеинженерных конструкций – на основе биоразлагаемых носителей, заполняемых тканеспецифическими клетками, предварительно выращенными in vitro. Чтобы в полной мере мобилизовать биологический потенциал клеток, в настоящее время разрабатывается новое поколение систем тканевого инженеринга с учетом экспансии клеток в культуре и наработки ими межклеточного матрикса. Для преодоления проблемы недостаточного количества донорских клеток при заселении их в матрицы необходимо увеличить их численность в культуре in vitro в течение адекватного времени культивирования и пассажирования, когда клетки достигают необходимой численности и дифференцировки. В этом случае необходимо определить сроки культивирования клеток для оптимального заселения матриц. В работе с клеточными культурами обычно используют 3–5 пассажей [1]. Этот выбор основан на исследованиях морфологии, кариотипической стабильности, способности к дифференцировке длительно культивированных мезенхимальных стволовых клеток (МСК) [2]. В доступной литературе представлен ряд работ, посвященных исследованию зависимости синтетической активности от времени культивирования эндотелиоцитов [3], МСК [2, 4], но работ, посвященных этой проблеме, применительно к хондробластам не обнаружено. Функциональная активность клеток определяется способностью создавать и накапливать в окружающей среде внеклеточный матрикс. Основными компонентами гиалинового хряща являются коллаген и протеогликаны. Протеогликаны – сложные белково-углеводные молекулы, состоящие из центральной нити белка и прокрепленных к ней углеводных цепей – гликозаминогликан (ГАГ). ПГ в ткани обеспечивают метаболические потоки, межклеточные контакты, биомеханическую прочность. В культуре клеток синтезированные протеогликаны обеспечивают межклеточные контакты и способствуют формированию монослоя [5].
Цель работы
Исследовать способность хондробластов пластинки роста позвонков синтезировать гликозаминогликаны внеклеточного матрикса в динамике роста культуры.
Материал и методы
Материалом для культивирования служили хондробласты, извлеченные в стерильных условиях из пластики роста позвонков двухмесячного беспородного щенка. Исследование выполнено с соблюдением положений Хельсинской декларации Всемирной медицинской ассоциации и Правилами проведения работ с использованием экспериментальных животных (утв. Приказом Министерства здравоохранения Российской Федерации от 19.03.2003 г. № 226). Гиалиновый хрящ отмывали в растворе Хенкса с канамицином 1 г/л в течение 15 минут, измельчали в чашке Петри с минимальным объемом среды RPMI 1640 (Биолот, Россия) до размеров 1–2 мм2, а затем помещали в раствор 1,5 % коллагеназы II типа (Gibco) в силиконизированной посуде для инкубирования на шейкере при температуре 37 ºС в течение 5–8 часов.
Суспензию пропускали через нейлоновый фильтр и центрифугировали 10 мин при 1500 об/мин. Далее клетки ресуспендировали в ростовой питательной среде. Полученную популяцию клеток культивировали в культуральных флаконах в концентрации 3 х 105/мл в среде RPMI 1640 1:1 с добавлением 20 фетальной сыворотки плодов коров (Gibco) и 100 ед/мл пенициллина-стрептомицина (Биолот, Россия), инкубировали в культуральных флаконах (TPP) в стандартных условиях СО2 инкубатора: 37 °С и 5 % СО2.
Смену среды осуществляли 2 раза в неделю. При достижении монослоем 80 %-й конфлюэнтности, клетки переводили в суспензию с использованием раствора трипсина 0,02 и версена 0,025 в соотношении (1:1) и рассевали в соотношении 1:3. На 1–10 пассажах (3–30 дней) среды культивирования клеток забирали для исследования содержания в них гликозаминогликанов (ГАГ).
Для выделения ГАГ среды обрабатывали раствором папаина с добавлением 0,01М ЭДТА и 0,005 М цистеина в буфере 0,2 M ацетата натрия рН 5,8 (60 ºС, 18 часов, 0,2 мг папаина на грамм сырой ткани). Раствор диализовали против буфера 0,05 М ацетата натрия с 0,01М ЭДТА рН 5,8 (+4 ºС, 24 часа). Белки из экстрактов осаждали ТХУ (5 % конечная концентрация) и удаляли центрифугированием (9000 g, +20C, r¥ = 8 см). После повторного диализа ГАГ осаждали тремя объемами этанола в присутствии 4 % ацетата калия (-18 ºС, 24 часа), осадок отделяли центрифугированием, промывали этанолом, ацетоном и высушивали в вакуумном эксикаторе. Выделенные ГАГ растворяли в дистиллированной воде. Количество определяли по присутствию гексуроновых кислот и сульфатированных ГАГ [6]. Результаты представлены в виде микрограммов на 100 микролитов среды. Отношение количеств ГАГ, определяемых по гексуроновым кислотам и по количеству сульфатированных групп, считали показателем степени сульфатированности. В качестве стандарта использовали хондроитинсульфат С и гексуроновую кислоту фирмы ICN.
Результаты и обсуждение
При исследовании влияния длительного пассажирования на синтез хондробластами компонентов межклеточного матрикса было установлено (рисунок, таблица), что количество уроновых кислот (УК) нарастает с 1-го по 6-й пассаж (3.282±0.164 – 11.589±0.579 мкг/мкл), количество сульфатированных ГАГ (С-ГАГ) нарастает с 1-го по 9 пассаж (3.041±0.152 – 19.238±0.962 мкг/мкл).
Количество ГАГ, синтезированных хондробластами дикого щенка (2 месяца) во время длительного пассажирования. * – количественный состав ГАГ в микрограммах на 100 микролитров; С-ГАГ – сульфатированные ГАГ, УК – уроновые кислоты, С-ГАГ/УК – отношение количества сульфатированных ГАГ к количеству уроновых кислот.
|
№ пассажа |
С-ГАГ * |
УК* |
С-ГАГ/УК |
|
1 |
3,041±0,152 |
3,282±0,164 |
0,927 |
|
2 |
5,808±0,290 |
5,734±0,287 |
0,956 |
|
3 |
9,804±0,490 |
7,104±0,355 |
1,380 |
|
4 |
9,876±0,494 |
7,178±0,359 |
1,370 |
|
5 |
11,192±0,560 |
10,279±0,514 |
1,083 |
|
6 |
13,132±0,657 |
11,589±0,579 |
1,133 |
|
7 |
13,638±0,682 |
8,648±0,432 |
1,578 |
|
8 |
14,112±0,706 |
7,837±0,392 |
2,917 |
|
9 |
19,238±0,962 |
5,179±0,259 |
3,715 |
|
10 |
16,341±0,817 |
4,82±0,241 |
3,391 |
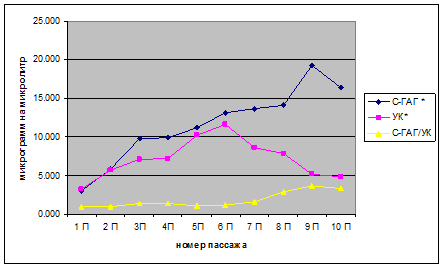
Количество ГАГ (в микрограммах на 100 микролитров), синтезированных хондробластами дикого щенка (2 месяца) во время длительного пассажирования. С-ГАГ – сульфатированные ГАГ, УК – уроновые кислоты, С-ГАГ/УК – отношение количества сульфатированных ГАГ к количеству уроновых кислот
Соотношение С-ГАГ/УК, которое указывает на степень сульфатированности ГАГ остается неизменным (0,927–0,874), близким к единице с 1-го по 6-й пассаж (что указывает на высокий уровень синтеза обоих компонентов ВКМ), далее с 7-го по 9-й пассаж наблюдает небольшой рост (1,578–3,715) и к 10-му пассажу наблюдается снижение небольшое (3,390). Эта динамика отражает различия в синтетической активности хондробластов с 7-го пассажа: снижение синтеза С-ГАГ (8,648±0,432 – 4,82±0,241 мкг/мкл) и продолжение нарастания синтеза УК до 9-го пассажа (13,638±0,682 – 5,179±0,259 мкг/мкл), с понижением на 10-м пассаже (4,82±0,241мкг/мкл). Таким образом, можно определить оптимальный период использования хондробластов для тканеинженерных манипуляций: 1–6 пассаж (3–12 дней).
Необходимость достаточно длительного культивирования первично выделенных клеток для наработки определенного объема клеточной массы для дальнейшего использования в области клеточных технологий ставит задачи типирования клеточных линий с целью определения оптимального периода их использования. Для этого оценивают влияние длительного культивирования (7–10 пассажей) клеточных культур на пролиферацию, дифференцировку, длину теломер, фенотип и морфологию этих клеток [1, 7, 8].
К сожалению, в доступной литературе не было обнаружено данных по типироваию хондробластов. МСК наиболее хорошо охарактеризованные на настоящий момент, в силу того, что их активно используют для дифееренцировки и последующих манипуляций. Исследования в области стандартизации и паспортизации МСК показали, что уровень дегидрогеназной активности в первичной культуре клеток мезенхимального происхождения возрастает на протяжении первых 5–7 пассажей, после чего постепенно снижается, что коррелирует со снижением терапевтического эффекта их использования. Также было установлено, что кариотип клеток в первичной культуре мезенхимального происхождения остаётся неизменным на протяжении первых десяти пассажей [7].
Мультипотентные МСК, выделенные из подкожно-жировой клетчатки человека в условиях длительного (начиная с 17-го пассажа) культивирования, теряют способность к адгезии с белками внеклеточного матрикса (коллаген, фибронектин, ламинин). Обнаружено, что, если на ранних пассажах (2–5), пассаж ММСК, выделенный из подкожно-жировой клетчатки человека, способен при соответствующей индукции дифференцироваться в хондро-, остеобласты и адипоциты, то на поздних пассажах (после 17 пассажа) сохраняется только адипогенный дифференцировочный потенциал [8].
В настоящее время широко изучено влияние длительного пассажирования на изменение биохимических свойств эндотелиальных клеток различных типов. Например, снижение пролиферативной активности, увеличение экспрессии белков окислительного стресса, активация сигнальных путей NFκ-B и p53 [9], снижение производства оксида азота и экспрессия поверхностно-активного белка D (SP-D) [10] были обнаружены в культуре эндотелиальных клеток коронарных артерий после многократного пассажирования in vitro. Был также выявлен усиленный апоптоз эндотелиальных клеток легочной артерии свиней [11].
При исследовании влияния длительного хранения клеточных линий на -80 ºС на адгезивные, пролиферативные, дифференцировочные свойства, был также определен оптимальный период для клеточный манипуляций 2–5 пассажей, причем два первых пассажа были необходимы для адаптации культуры клеток после хранения [3].
Полученные нами результаты хорошо коррелируют с литературными данными, хотя они посвящены другим клеточным линиям, но можно утверждать, что работы с клеточными культурами должны проводиться в период максимальной синтетической активности и фенотипической стабильности, в нашем исследовании это 1–6 пассажи.
Заключение
Таким образом, исходя из литературных данных и наших результатов, хондробласты при длительном пассажировании теряют свои морфо-функциональные характеристики и снижают синтетическую активность. В связи с этим, целесообразнее использовать их для клеточной и генной терапии на ранних пассажах.
Библиографическая ссылка
Корель А.В., Фаламеева О.В., Кирилова И.А., Садовой М.А. ИССЛЕДОВАНИЕ СИНТЕТИЧЕСКОЙ АКТИВНОСТИ ХОНДРОБЛАСТОВ В ЗАВИСИМОСТИ ОТ ДЛИТЕЛЬНОСТИ ПАССАЖИРОВАНИЯ IN VITRO // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=26998 (дата обращения: 14.02.2026).



