Постоянное повышение частоты заболеваний, их омоложение, более сложные формы проявлений, среди которых болезни почек занимают значительное место как у нас в стране, так и повсеместно, требует поиска не только новых методов лечения, диагностики, но и выяснения механизмов, лежащих в основе этих заболеваний, что, несомненно, поможет ускорить лечение с благоприятным исходом. Отсюда очевидна целесообразность проведения фундаментальных экспериментальных исследований на животных, с целью выяснения возможных изменений при различных патологических состояниях, в частности при почечной недостаточности.
Цель исследования
Определение чувствительности канальцевого аппарата почек к антидиуретическому гормону у крыс при острой и хронической почечной недостаточности.
Материалы и методы исследования
Модель почечной недостаточности создавали по методу G. Greven на 50-и крысах линии Вистар путем в/м введения 50,0 % глицерина в дозе 0,8 мл/100г [1]. Хотя существует много методов создания экспериментальных моделей почечной недостаточности, как фармакологических, недостатком которых является собственное действие вводимого препарата, нередко приводящее к тому, что хроническая почечная недостаточность развивается вторично, что затрудняет, а часто делает невозможным адекватное изучение ряда биохимических и иммунологических параметров, так и хирургических, с удалением большей (5/6) части почки [2; 3]. В наших опытах вводимый объём глицерина делился пополам, так как его введение в одно место в первые два-три дня приводило к гибели большей части крыс.
При постановке экспериментов мы исходили из времени развития почечной недостаточности: острая – в течение одной-двух недель после введения глицерина, хроническая – через три и более месяца. Но так как спустя один месяц после однократного введения крысам глицерина вызванные изменения начинают регрессировать, практически нормализуясь, то мы решили после опытов в конце второй недели и первого месяца ввести крысам еще по одному разу глицерин в указанной дозе. После первого введения глицерина из 50-и крыс, взятых в эксперимент, в первые два дня погибло четыре, а после второго и третьего введения – по три крысы. То есть непосредственно опыты ставили на 40 крысах.
Исследования по выяснению чувствительности тубулярного аппарата почек к антидиуретическому гормону проводили в условиях водного диуреза на 28-и крысах линии Вистар. В качестве антидиуретического гормона использовали минирин (Феринг, ФРГ), действующим началом которого является десмопрессин – синтетический аналог вазопрессина, полученный при дезаминировании цистеина и замещение L-аргинина на D-аргинин. Препарат, воздействуя на дистальные извитые канальцы и собирательные трубочки, обладает стойким, до 12 часов, антидиуретическим эффектом. В клинике его чаще всего применяют при несахарном диабете, причём суточная доза колеблется в значительном диапазоне – от 0,1 мг до 1,2 мг. А используемая нами для крыс доза десмопрессина в 1,5 мкг/кг, рассчитывалась эмпирически, с условием, чтоб его антидиуретический эффект длился около одного часа [4].
Так как исследования проводили в условиях водной нагрузки, то всем крысам вводили водопроводную воду в объёме 5,0 % их массы и помещали в специальные клетки-воронки для сбора (отдельно за каждый час), выделяющейся в течение трех часов мочи, в которой спектрофотометрически (UNICO 800, США) определяли содержание креатинина по методу Поппера, основанного на реакции Яффе с изменением окраски пикриновой кислоты при взаимодействии с креатинином в щелочной среде. Уровень креатинина определяли и в плазме крови (мкмоль/мл), а затем рассчитывали скорость клубочковой фильтрации (мл/час/100г) и величину канальцевой реабсорбции воды (%).
Содержание крыс, уход, постановка опытов и вывод их из эксперимента (в состоянии обезболивания и сна после внутрибрюшинного введения крысам анестетика общего действия «Золетил» (Франция) в дозе 0,1-0,15 мл/100г.), с последующей утилизацией, осуществлялись в соответствии с приказом Минздравсоцразвития России № 708н от 23 августа 2010 г. «Об утверждении Правил лабораторной практики».
Полученные результаты статистически обрабатывались с помощью программы «GraphPadPrizm 5.06», степень достоверности оценивалась по t-критерию Стьюдента (параметрический метод сравнения средних величин).
Полученные результаты и их обсуждение
Антидиуретический гормон свое действие на дистальные отделы канальцев почек и собирательные трубочки оказывает через V2 рецепторы, активация которых посредством Gs-белка и стимуляцию аденилатциклазного механизма каскадно запускает внутри эпителиоцитов процессы, приводящие к встраиванию в апикальную мембрану дистальных канальцев и собирательных трубочек аквапоринов второго типа, через которые вода из первичной мочи трансцеллюлярно, по системе образованных с аквапоринами трубочек, проходит к базолатеральной мембране, поступает в интерстиций, откуда далее идет в общий кровоток [5; 6; 7; 8].
Вначале мы выяснили влияние десмопрессина на интактных крысах. Полученные результаты выглядели следующим образом. За первый час из 28 крыс отсутствие диуреза было у 21-го, а у оставшихся 7-и количество выделившейся мочи было в 3 раза меньше контроля (в качестве контроля использовали этих же 28 крыс до введения им десмопрессина). То есть десмопрессин у ¾ крыс заблокировал образование окончательной мочи, а у остальных резко её снизил (табл.1). При этом скорость клубочковой фильтрации не менялась, а причиной угнетения водного диуреза было усиление канальцевой реабсорбции воды, то есть у крыс с полным отсутствие диуреза канальцевая реабсорбция воды, очевидно, была 100,0 %, а у 7-и крыс, у которых выделилась моча, процесс обратного всасывания воды составил 96,74±0,35 % (р<0,001). За второй час диурез был у всех крыс, но он оставался статистически значимо меньше (1,45±0,09 мл/час/100г – контроль, 0,98±0,06 мл/час/100г – десмопрессин, р<0,001). И в этом случае уменьшение было вследствие повышенной канальцевой реабсорбции воды. А за третий час количество мочи у крыс с десмопрессином стало больше контроля, что уже было обусловлено снижением обратного всасывания воды, хотя клубочковая фильтрация оставалась неизменной (рис.1). Но в среднем за три часа после введения десмопрессина водный диурез у крыс был на 22,2 % меньше контроля. И когда мы оставили животныхв клетках для сбора мочи еще на один час, то количество выделившейся мочи за четыре часа стало таким же, как у контрольных за три часа.
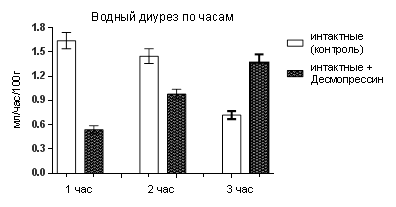
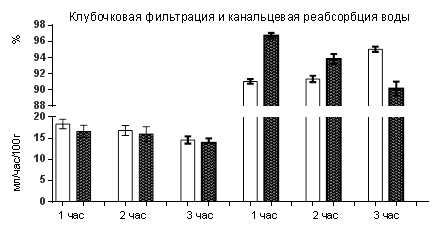
Рис. 1. Водный диурез, клубочковая фильтрация и канальцевая реабсорбция воды у крыс после инъекции десмопрессина
А то, что десмопрессин не изменил скорость клубочковой фильтрации созвучно с ранее полученным у нас в лаборатории данным об существенном его влиянии на скорость почечного кровотока. Отмечается лишь только слабое снижение [4]. Очевидно, что это могло быть связано с той незначительной вазоконстрикторской и гепертензивной способностью препарата, которая наблюдалось у больных [9], хотя в этом случае доза десмопрессина была другой (0,3 мкг/кг веса).
Таким образом, однократное введение интактным крысам десмопрессина в дозе 1,5 мкг/кг в условиях водной нагрузки водопроводной водой в объёме 5,0 % их массы, в течение первого часа, усиливая канальцевую реабсорбцию воды, блокирует диурез у 75,0 % животных, а у 25,0 % – в три раза его уменьшает. То есть у интактных крыс чувствительность канальцевого аппарата почек к действию антидиуретического гормона проявляется блокировкой диуреза за первый час, снижением за второй и повышением за третий, но в среднем за четыре часа введённая водная нагрузка выделяется почти в полном объёме, то есть десмопрессин в применяемой дозе не оказывает пролонгированное действие.
Исследование влияния десмопрессина при почечной недостаточности мы проводили в период наиболее выраженных изменений водовыделительной функции почек [10], то есть через две недели (в олигоанурическую фазу), один месяц (в полиурическую фазу) и через три месяца (в хроническую фазу). В эти периоды отмечаются: в течение первых двух недель снижение диуреза за счет угнетения клубочковой фильтрации; в конце месяца максимальное повышение диуреза вследствие ускорения фильтрации и частичного ослабления канальцевой реабсорбции воды; в конце третьего месяца водный диурез и основные процессы мочеобразования особо не отличаются от контроля (таблица).
Влияние десмопрессина на водный диурез, скорость клубочковой фильтрации и канальцевую реабсорбцию воды у крыс с почечной недостаточностью
|
Время |
Стат. показа-тели |
Диурез (мл/час/100г) |
Клубочковая фильтрация (мл/час/100г) |
Канальцевая реабсорбция (%) |
|
Интактные крысы (контроль для почечной недостаточности) |
||||
|
1 час |
М±m |
1,64±0,10 |
18,34±1,12 |
91,06±0,29 |
|
2 час |
М±m |
1,45±0,09 |
16,79±1,18 |
91,36±0,40 |
|
3 час |
М±m |
0,72±0,05 |
14,58±0,86 |
95,06±0,32 |
|
Интактные крысы + Десмопрессин (контроль для почечной недостаточностью + Десмопрессин) |
||||
|
1 час |
М±m// р |
0,54±0,05 // <0,001 |
16,58±1,44 // * |
96,74±0,35 // <0,001 |
|
2 час |
М±m // р |
0,98±0,06 // <0,001 |
15,96±1,75 // * |
93,85±0,62// <0,001 |
|
3 час |
М±m // р |
1,37±0,10 // <0,001 |
13,92±1,01 // * |
90,16±0,88// <0,001 |
|
Через 2 недели после введения глицерина |
||||
|
1 час |
М±m // р |
1,14±0,10 // <0,001 |
13,76±1,01 // <0,002 |
91,71±0,92 // * |
|
2 час |
М±m // р |
0,94±0,05 // <0,01 |
11,73±0,92 // <0,002 |
91,90±0,50 // * |
|
3 час |
М±m // р |
0,64±0,05 // * |
12,24±0,78 // <0,001 |
94,77±0,42 // * |
|
Через 2 недели после введения глицерина + Десмопрессин |
||||
|
3 час |
М±m // р |
1,38±0,16 // * |
38,09±2,82 // <0,001 |
96,37±0,70 // <0,001 |
|
Через 1 месяц после введения глицерина |
||||
|
1 час |
М±m // р |
2,08±0,14 // <0,02 |
22,53±1,12 // <0,001 |
90,76±0,72 |
|
2 час |
М±m // р |
2,12±0,16 // <0,001 |
20,25±1,33 // <0,01 |
89,53±0,69 // <0,05 |
|
3 час |
М±m // р |
0,72±0,06 // * |
16,75±1,02 // * |
95,70±0,54 // * |
|
Через 1 месяц после введения глицерина + Десмопрессин |
||||
|
2 час |
М±m // р |
0,77±0,10 // * |
30,29±4,59 // <0,001 |
97,76±0,32 // <0,001 |
|
3 час |
М±m // р |
2,13±0,23 // <0,01 |
39,06±2,50 // <0,001 |
94,98±0,72 // <0,002 |
|
Через 3 месяца после введения глицерина |
||||
|
1 час |
М±m // р |
1,52±0,09 // * |
17,52±1,13 // * |
91,32±0,60 // * |
|
2 час |
М±m // р |
1,35±0,09 // * |
17,75±1,29 // * |
92,39±0,74 // * |
|
3 час |
М±m // р |
0,59±0,03 // * |
15,23±0,91 // * |
96,12±0,39 // * |
|
Через 3 месяца после введения глицерина+ Десмопрессин |
||||
|
1 час |
М±m // р |
1,04±0,12 // <0,002 |
22,48±1,59 // <0,002 |
95,37±±0,30 // <0,01 |
|
2 час |
М±m // р |
1,65±0,14 // <0,001 |
18,76±2,15 // * |
91,20±0,46 // <0,002 |
|
3 час |
М±m // р |
0,92±0,08 // <0,002 |
13,62±1,09 // * |
93,24±0,57 // <0,002 |
|
* – отсутствие статистически значимых отличий |
||||
У крыс с почечной недостаточностью в конце второй недели после инъекции глицерина введение десмопрессина вызвало полное отсутствие водного диуреза за первый и второй часы, но за третий час он был у всех крыс в объёме 1,38±0,16 мл, что было больше, чем у интактных крыс (0,72±0,05 мл/час/100г). При этом появляется то, чего не было ни у интактных крыс под влиянием десмопрессин, ни у крыс с почечной недостаточностью – значительно ускорилась клубочковая фильтрация. Она достигла 38,09±2,85 мл/час/100г, что в 2,7 раза больше контроля на десмопрессине. Канальцевая реабсорбция воды оставалась усиленной (таблица).
В чем могла быть причина столь значительного ускорения клубочковой фильтрации? Ведь у интактных крыс десмопрессин не оказал влияние на фильтрацию и его антидиуретический эффект был вызван только воздействием на канальцы. Скорее всего это обусловлено тем, что повышается давление в клубочках нефронов в результате сужения выносящей артериолы. На это есть ссылки в научной литературе, показывающие, что вазопрессин стимулирует выброс кальция из саркоплазматического ретикулума гладкомышечных клеток, что усиливает их сокращение и соответственно приводит к сужению просвета выносящей артериолы [11; 12]. Также есть данные, что вазопрессин вместе с ангиотензином II и тромбоксаном через активацию протеинкиназ оказывают вазоконстрикторский эффект на выносящую артериолу, причем ангиотензин II является прежде всего физиологическим модулятором, а вазопрессин и тромбоксан проявляют свои эффекты при патологических состояниях, коим, конечно, является и почечная недостаточность [13], хотя по сравнению с вазопрессином десмопрессин обладает менее выраженным действием на гладкую мускулатуру сосудов и внутренних органов, вследствие того, что в структуре молекулы десмопрессина произошло дезаминирование 1-цистеина и замена 8-L-аргинина на D-аргинин.
В конце первого месяца введение десмопрессина вызвало отсутствие мочи за первый час у всех крыс с почечной недостаточностью, но за второй час диурез был уже у 60,0 % крыс (0,77±0,10 мл/час/100 г), а за третий – у всех (2,13±0,23 мл/час/100 г). И в этом случае также была ускорена клубочковая фильтрация и усилена канальцевая реабсорбция воды (таблица).
Исследования, проведённые в конце третьего месяца, показали, что десмопрессин особо не проявил свой характерный эффект. Диурез за первый час, хоть и был сниженным (1,04±0,12 мл/час/100г), но был у 90,0 % крыс, а за второй и третий – у всех (рис. 2).
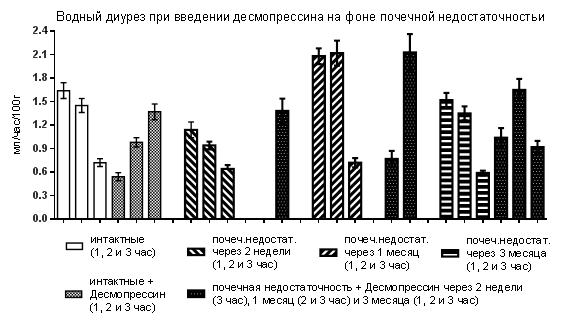
Рис.2. Влияние десмопрессина на водный диурез у крыс с почечной недостаточностью
Изменение диуреза при завершении экспериментов в основном было обусловлено канальцевой реабсорбцией воды, которая, по сравнению с данным после введения интактным крысам десмопрессина, была меньше за первые два часа и больше за третий час. Одновременно клубочковая фильтрация за первый час оставалась ускоренной, хотя уже не была столь значительной как в опытах через 1 месяца после создания модели (таблица).
Заключение
Введение десмопрессина в дозе 1,5 мкг/кг крысам с почечной недостаточностью в олигоанурическую фазу в условиях водного диуреза оказывает усиленное антидиуретическое действие, полностью блокируя выделение мочи не только в первый час, как у интактных крыс, но и во второй. На высоте полиурической фазы почечной недостаточности эффект проявляется слабее, хотя канальцевая реабсорбция воды остается усиленной, но одновременно ускоряется клубочковая фильтрация. При хронической почечной недостаточности десмопрессин практически перестает оказывать характерное действие, то есть чувствительность канальцев почек снижается, что, очевидно, вызвано тем, что к этому времени у крыс поражение затрагивает канальцы.
Библиографическая ссылка
Бедоева З.Р., Джиоев И.Г., Батагова Ф.Э., Кабоева Б.Н., Лолаева А.Т. ЧУВСТВИТЕЛЬНОСТЬ НЕФРОНА К АНТИДИУРЕТИЧЕСКОМУ ГОРМОНУ У КРЫС С ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=26883 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.26883



