Среди актуальных проблем современной медицины хронические заболевания органов пищеварения занимают одно из ведущих мест. Значимость их как медицинской проблемы определяется не только распространенностью язвенной болезни, хронического панкреатита и хронического холецистита, но и тяжестью их течения, а также осложнениями, угрожающими жизни больного [1].
Что касается обострения хронической патологии, то возникновение альтеративных (дистрофических и некротических) изменений в пораженных органах исследователи, как правило, не связывают с патологическим состоянием артерий [2, 3]. Так, при язвенной болезни основную роль принято отводить кислотно-пептическому или бактериальному воздействию Helicobacterpylori на слизистую оболочку [4-6]. Обострения хронического панкреатита обычно объясняют нарушением оттока панкреатического секрета и забросом желчи, особенно инфицированной, в проток, что вызывает активизацию панкреатических ферментов с последующим аутолизом ткани поджелудочной железы [7]. Обострение при холецистите связывают с повышением внутрипузырного давления из-за нарушенного оттока желчи и снижением резистентности слизистой оболочки желчного пузыря к «агрессивному» воздействию желчи и микрофлоры [8]. При этом следует подчеркнуть, что сосудистый генез обострений язвенной болезни, хронического панкреатита и хронического холецистита до настоящего времени еще не стал объектом систематических научных исследований.
Цель исследования – поиск доказательств реальной значимости сосудистого компонента в прогрессировании хронической патологии органов пищеварительной системы.
Задачи исследования – изучить морфофункциональные особенности состояния артериального сосудистого русла в рубцово-измененных тканях при язвенной болезни, хроническом панкреатите и хроническом холецистите.
Материалы и методы исследования
Для выяснения источников нарушенного кровоснабжения тканей, ведущих к формированию очагов альтерации при язвенной болезни, хроническом панкреатите и хроническом холецистите, проведено морфологическое исследование участков органов, резецированных при органосохраняющих операциях на желудке, двенадцатиперстной кишке и поджелудочной железе. При хроническом холецистите исследовали материал, полученный при холецистэктомии. У всех оперированных больных отсутствовала системная артериальная гипертензия.
Органосохраняющие операции при язвенной болезни заключались в иссечении рубцово-язвенного очага и в последующем закрытии дефекта в желудке или в двенадцатиперстной кишке собственными его стенками. Удалялись вместе с язвенным дефектом окружающие его рубцово-измененные ткани до участков с хорошим кровоснабжением (края резецированных стенок должны «хорошо кровоточить»), что обычно составляло от 0,5 до 1 см от края фиброзного слоя хронической язвы. Больным хроническим панкреатитом производилась проксимальная или медиальная резекция поджелудочной железы. Удалялись патологически измененные ткани железы. Накладывался конце-петлевой панкреатоэнтероанастомоз. При хроническом холецистите проводили холецистэктомию.
Нами исследован операционный материал от 45 больных язвенной болезнью желудка, 96 больных язвенной болезнью двенадцатиперстной кишки, 136 больных хроническим панкреатитом и 128 больных хроническим холециститом.
Гистологические срезы толщиной 7 мкм, изготовленные из фиксированной в формалине и залитой в парафин ткани органов, окрашивали гематоксилином и эозином, а также альдегид-фуксином. Для дифференцированной окраски слоев стенки артерий применили оригинальный способ окраски альдегид-фуксином – хромотропом – анилиновым синим, а также разработанный нами способ окраски альциановым синим и нейтральным красным [9]. Для выявления ишемических повреждений мышечной ткани мы адаптировали известный способ окраски гистологических срезов гематоксилином – основным фуксином – пикриновой кислотой [9]. Поврежденные мышечные клетки окрашивались в кирпично-красный цвет.
Результаты исследования и их обсуждение
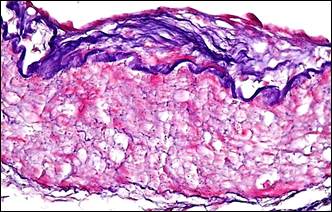
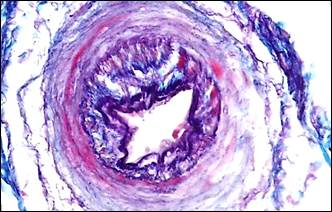
При изучении гистологических препаратов нами установлено, что наиболее характерным типом изменений артерий в рубцово-измененных тканях пораженных органов являлась гипертрофия их стенок, обусловленная гиперплазией мышечного слоя в сочетании с мультипликацией внутренней эластической мембраны, гиперэластозом и эластофиброзом (рис.1, а, б), которые, в целом, свидетельствовали о повышенных гемодинамических нагрузках на сосуд и могли быть проявлением артериальной гипертензии.
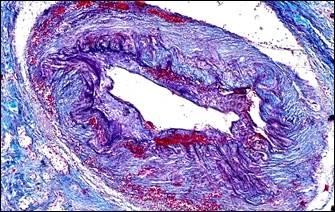
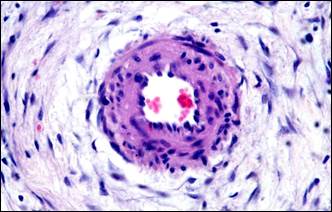
Для значительной части мелких артерий было характерно настолько интенсивное разрастание эластических волокон, что такие артерии принимали вид артерий эластического типа (рис. 1, б). Гиперэластоз сочетался с утолщенной интимой, которая была складчатой и содержала сближенные эндотелиальные клетки, ядра которых имели тенденцию своим большим размером располагаться перпендикулярно просвету сосуда (рис. 1, в). Этот морфологический симптомокомплекс отражал тоническое состояние мелких артерий, являющееся столь характерным для артериальной гипертензии. В артериолах отмечалось утолщение базальной мембраны (рис. 1, г).
|
|
|
||||
|
|
|
||||
|
|
|
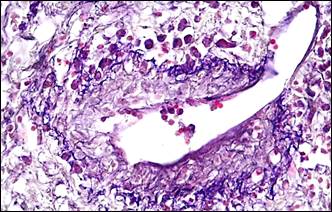
Рис. 1. Морфологические проявления регионарной артериальной гипертензии
Окраска: а, б, г, д – окраска альдегид-фуксином – хромотропом – анилиновым синим;
в – гематоксилином и эозином; е – альдегид-фуксином. Ув.: а, в, д, е – ×400; б, г – ×200
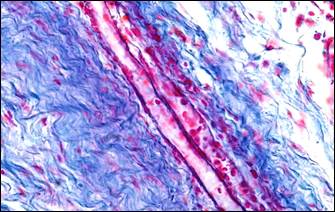
Примечание: а – гипертрофия мышечного слоя артерии, гиперэластоз, мультипликация внутренней эластической мембраны; б – гиперэластоз и эластофиброз стенки артерии (эластика – фиолетовая, коллагеновые волокна – синие); в – в гипертрофированной мелкой артерии интима складчатая со сближенными ядрами эндотелиальных клеток; г – утолщение базальной мембраны артериол; д – артерия замыкающего типа; е – скопление тканевых базофилов около артерио-венозного анастомоза.
В рубцовых полях выявлялись артерио-венозные анастомозы разных типов (рис. 1, д), способные разгружать артериальное русло, сбрасывая кровь в венозную систему Функционирующие артерио-венозные анастомозы являлись еще одним доказательством адаптации ткани к возросшему сопротивлению кровотока в условиях спланхнической артериальной гипертензии. Формирование артерио-венозных анастомозов сопровождалось неогенезом тканевых базофилов (рис. 1, е), обеспечивающих своими биологически активными веществами локальные механизмы регуляции кровотока.
Гипертрофические и гиперпластические процессы в артериальных стволах не носили универсального характера, так как встречались и артерии без видимых гипертрофических изменений, а в некоторых артериях наблюдались признаки продуктивного артериита с исходом в склероз с облитерацией просвета сосуда. Такое неравномерное поражение могло быть обусловлено анатомо-физиологическими особенностями внутриорганной регуляции кровотока, разной возбудимостью сосудистых модулей при формировании региональной гипертензии. Именно с учетом очаговой обособленности гипертонических расстройств в сосудистом русле могут найти свое объяснение известные факты очаговости поражений и точечной или характерной локализации язвенных дефектов в желудке и двенадцатиперстной кишке, альтеративных изменений в поджелудочной железе и стенке желчного пузыря.
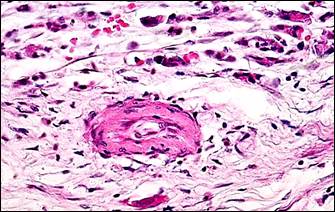
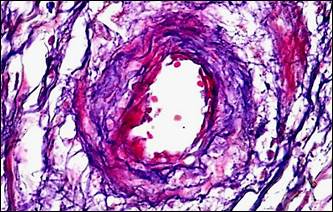
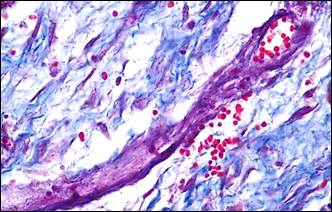
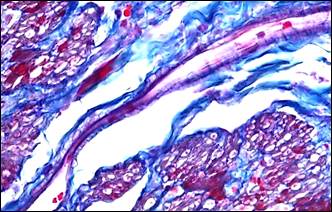
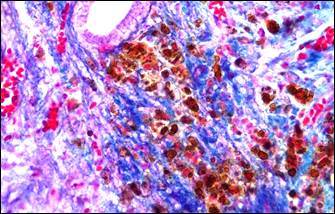
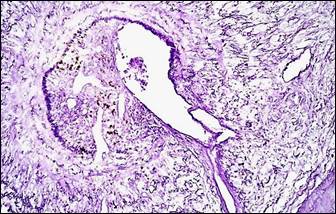
На фоне описанных изменений артериального сосудистого русла в периоде обострения болезни выявляется морфологический симптомокомплекс, характеризующий сосудистый криз. Он включал в себя альтеративные изменения мелких артерий и артериол в виде плазматического пропитывания стенки (рис. 2, а, б), гомогенизации, расщепления и в ряде случаев даже разрывов базальных мембран с формированием микроаневризм (рис. 2, е), а также выраженные дистонические процессы в виде чередования спазма и пареза на соседствующих участках мелких артерий (рис. 2, в, г). В микроциркуляторном русле обнаруживались картины стаза крови с агглютинацией эритроцитов и перистатические кровоизлияния. Выявлялись различные варианты микротромбов: эритроцитарные, фибриновые, гиалиновые, смешанные, но они были приурочены главным образом к венозному отделу микроциркуляторного русла.
Наблюдались самые различные проявления поражения тканей, обусловленные локальным сосудистым кризом: отек ткани, некробиотические процессы, вызываемые длительной блокадой кровотока, геморрагические инфильтраты тканей. Очевидно, что в рамках единого сосудистого генеза криза существует целая гамма его последствий, зависящих от силы и продолжительности его действия, а также от состояния органных тканевых структур, на территории которых реализуется этот криз.
|
|
|
||||
|
|
|
||||
|
|
|
Рис. 2. Морфологические проявления сосудистого криза: альтеративные, дистонические изменения артерий и их последствия
Окраска: а – гематоксилином и эозином; б, в, г, д – альдегид-фуксином – хромотропом – анилиновым синим; е – альдегид-фуксином. Ув.: а, б, в, г, д – ×400; е – ×100
Примечание: а – плазматическое пропитывание стенки мелкой артерии; б – фибриноидные изменения стенки артерии; в – явления спазма и пареза на соседствующих участках сосуда, расщепление и гомогенизация базальной мембраны, периваскулярный отек и кровоизлияния; г – сочетание спазма и пареза на протяжении артериолы, периваскулярный отек, некробиоз (гидропическая дистрофия) в мышечном слое двенадцатиперстной кишки; д – скопление гемосидерина (коричневый пигмент) в рубцовой ткани (синяя); е – ремоделирование аневризматического расширения мелкой артерии, дефект базальной мембраны на участке ее надрыва (внизу).
О повторяемости сосудистых кризов свидетельствовали рубцы и скопления гемосидерина (рис. 2, д), организованные тромбы в сосудах, перекалиброванные (ремоделированные) артерии с сохранившимися дефектами от разрыва их внутренней эластической мембраны (рис. 2, е). Таким образом, морфологическая картина состояния артериального русла в периоде обострения хронической патологии отражала не только наличие локальной артериальной гипертензии, но и свидетельствовала о развившемся очередном сосудистом кризе.
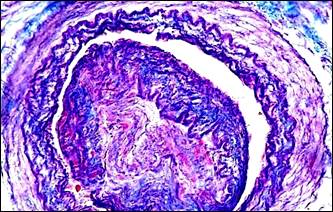
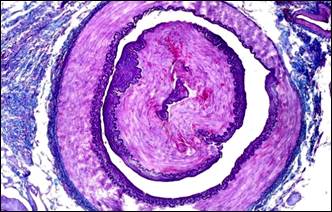
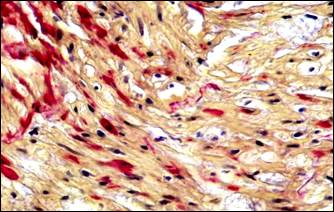
В периоде обострения хронической патологии нами впервые установлено неизвестное ранее явление инвагинации артерий, проявляющееся внедрением спазмированного участка артерии в просвет паретически расширенной дистальной ее части с блокадой кровотока. Бесспорные морфологические картины инвагинации артерий были получены нами в результате применения оригинального способа дифференцированной окраски слоев стенки артерий альдегид-фуксином – хромотропом – анилиновым синим и избирательной окраски эластических волокон и мембран артерий [9]. На поперечных срезах артерий через инвагинат отчетливо видно наличие "сосуда в сосуде" (рис. 3, а, б). Внедренный участок представлен всеми слоями стенки артерии. Наружный слой в инвагинате образован интимой и внутренней эластической мембраной, то есть сосуд как бы вывернут «наизнанку». Инвагинированная часть артерии подвергается сдавлению и деформируется, в результате интрамуральные сосуды (vasavasorum), кровоснабжавшие стенки инвагинированной части артерии, оказываются сдавлены. Это обусловливает нарушение трофики инвагината, о чем свидетельствуют поврежденные миоциты, которые отличались фуксинофилией (рис. 3, в).
Диаметр артерий, содержащих инвагинаты, по данным морфометрии, варьировал от 0,12 до 2,21 мм. Протяженность инвагинированного участка составляла 2–3 диаметра артерий. Нами выявлены инвагинаты в 1/3 всех наблюдений, что указывает на закономерность, а не исключительность обнаруженного нами явления. Явление инвагинации артерий при язвенной болезни и хроническом панкреатите признано научным открытием [10].
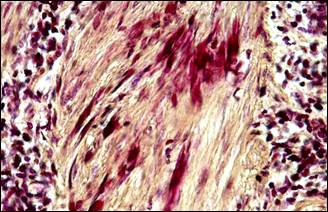
Инвагинация артерии из-за блокады артериального кровотока приводит к возникновению очага острой ишемии с альтеративными изменениями ишемизированных тканей (рис. 3, г) геморрагической инфильтрации (рис. 3, д), а также отеку и развитию местной коагулопатии (рис. 3, е).
Таким образом, выявленный нами феномен инвагинации артерий представляет собой
один из видов непроходимости артерий, проявляющийся острой блокадой кровотока из-за внедрения (вворачивания) одного участка артерии в просвет другого, являющегося его продолжением.
|
|
|
||||
|
|
|
||||
|
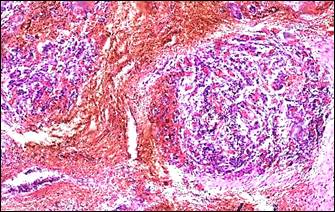
|
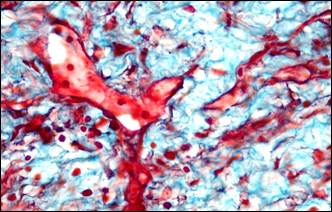
|
Рис. 3. Инвагинация артерий. Морфологические изменения тканей в связи с сосудистым кризом. Окраска: а, б – альдегид-фуксином – хромотропом – анилиновым синим; в, г – гематоксилином – основным фуксином – пикриновой кислотой; д – гематоксилином и эозином; е – альциановым синим и нейтральным красным.
Ув.: а, в, г, е – ×400; б – ×40; д – ×100
Примечание: а – инвагинация артерии, в инвагинате расщепленная внутренняя эластическая мембрана располагается снаружи, просвет сосудастал непроходим для тока крови; б – поперечное сечение через инвагинированную артерию; в – геморрагическая инфильтрация ткани поджелудочной железы; г – местная коагулопатия – отек, кровоизлияния, стазы, тромбозы; д – поврежденные миоциты (кирпично-красного цвета) в мышечном слое инвагината; е – фуксинофилия ишемически поврежденных миоцитов в стенке желчного пузыря.
Очевидно, что условием возникновения этого феномена являются соседствующие друг с другом спазмированные и паретически расширенные участки артерии, а также повышенный уровень давления крови в артериальном стволе. При этом гемодинамический фактор не преодолевает спазм, а, действуя по направлению кровотока, загоняет спазмированный фрагмент артерии в просвет расширенного дистального участка сосуда.
Заключение. Полученные нами данные легли в основу установления в бассейне чревного ствола ранее неизвестного явления региональной артериальной гипертензии, сущность которого заключается в том, что при хронической патологии органов пищеварения (язвенная болезнь желудка и 12-перстной кишки, хронический панкреатит, хронический холецистит) выявляется сформированный морфофункциональный симптомокомплекс, свидетельствующий о гипертензионном состоянии отдельных артериальных сосудов, с чем связано снижение кровоснабжения тканей этих органов и развитие в них очагов фиброзно-склеротических изменений, характерных для хронической патологии. Обострение хронической патологии сопряжено с регионарными сосудистыми кризами с выраженными дистоническими и альтеративными изменениями, а также проявлениями местной коагулопатии в видестазов, отека, кровоизлияний и тромбообразования в микрососудах. Кроме того, нами впервые выявлен феномен инвагинации артерий, формирующийся на фоне выраженных дистонических процессов с явлениями спазма и пареза на соседствующих участках артерий. Инвагинация артерий блокирует артериальный кровоток, что ведет к острой ишемии и гибели участка ткани, расположенного в бассейне кровоснабжения этой артерии.
Библиографическая ссылка
Фаустов Л.А., Павленко С.Г., Сычева Н.Л. МОРФОФУНКЦИОНАЛЬНЫЙ СИМПТОМОКОМПЛЕКС РЕГИОНАРНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ ПРИ ХРОНИЧЕСКОЙ ПАТОЛОГИИ ОРГАНОВ ПИЩЕВАРЕНИЯ // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=26848 (дата обращения: 14.02.2026).



