Известно, что артериальная гипертония (АГ) является одной из наиболее частых причин возникновения нарушений мозгового кровообращения (НМК) геморрагического и ишемического характера, обусловленных структурными изменениями сосудов головного мозга [1, 2]. К настоящему времени довольно подробно изучены патологические изменения сосудов первых двух структурно-функциональных уровней артериальной системы мозга, к которым относятся магистральные артерии головы, экстрацеребральные и крупные интрацеребральные артерии, т.е. артерии, доставляющие кровь к мозгу и распределяющие ее. Что касается третьего структурно-функционального уровня, то есть сосудов микроциркуляторного русла (МЦР) – артериол, капилляров и венул, на уровне которых осуществляются метаболические процессы в мозге, то характер и распространенность их изменений при НМК, обусловленных АГ, изучены слабо.
В то же время, как показали исследования последних лет, основанные на данных новейших модификаций магнитно-резонансной томографии, именно патология мелких внутримозговых сосудов, включая сосуды МЦР, сопровождающаяся нарушением проницаемости гематоэнцефалического барьера, играет ключевую роль в возникновении при АГ как очаговых повреждений мозга – кровоизлияний илакунарных инфарктов (ЛИ), так и диффузных изменений белого вещества полушарий, проявляющихся при нейровизуализации в виде феномена лейкоареоза [3-7]. В связи с этим НМК, связанные с АГ, трактуются в настоящее время как маркеры патологии мелких интрацеребральных артерий и обозначаются за рубежом термином «cerebral small vessel disease» [8, 9].
Эти новейшие данные полностью согласуются с результатами проведенных ранее патоморфологических исследований мозга в случаях с гипертоническими НМК, которые позволили разработать концепцию пато- и морфогенеза гипертонической ангиоэнцефалопатии. Установлено, что гипертоническая ангиопатия характеризуется, в первую очередь, тяжелыми деструктивными изменениями стенок интрацеребральных артерий диаметром 70–500 мкм в виде плазморрагий, фибриноидного некроза, милиарных аневризм, изолированного некроза мышечных клеток средней оболочки, гиалиноза и склероза. Отмеченные изменения обусловливают разнообразные проявления гипертонической энцефалопатии в виде интрацеребральных гематом разной величины, мелкоочаговых и диффузных ишемических повреждений вещества мозга, к которым относятся ЛИ, лакунарное состояние мозга (множественные ЛИ), прогрессирующая лейкоэнцефалопатия, очаги периваскулярного энцефалолизиса, персистирующий отек мозга с формированием так называемых криблюр [10, 11].
Следует подчеркнуть, что к микроциркуляторному (метаболическому) руслу мозга, как и других органов, относится субмакроскопическая часть сосудистой системы. Функцией МЦР является снабжение тканей кислородом и анаболитами и отведение катаболитов, при этом в головном мозге обмен между кровью и нервной тканью осуществляется не только посредством капилляров, но и за счет других микрососудов – артериол и венул [12]. Чрезвычайно высокая роль МЦР в сохранении и поддержании структуры и функций нервной ткани определяет важность изучения данного структурно-функционального уровня сосудистой системы мозга при различных патологических состояниях, в том числе при таком распространенном заболевании как АГ.
Цель исследования – изучение характера и распространенности патологических изменений сосудов МЦР мозга при АГ, осложнившейся развитием тяжелого геморрагического инсульта.
Материал и методы исследования
Проведено патологоанатомическое исследование МЦР различных отделов головного мозга в 125 секционных случаях с интрацеребральными кровоизлияниями, обусловленными АГ. В 78 % случаев отмечалась гипертоническая болезнь, в 22 % – симптоматическая (почечная) АГ. По данным анамнеза, длительность АГ в половине случаев составляла более 10 лет. У 62 % пациентов, особенно при наличии почечной АГ, отмечалось тяжелое течение последней в виде кризов с подъемами артериального давления до 190/100 – 210/110 мм ртутного столба, которое плохо коррегировалось антигипертензивной терапией и обусловливало возникновение у большинства больных геморрагического инсульта в молодом возрасте – 30–40 лет. У 30 % пациентов отмечались как интрацеребральные кровоизлияния, так и ишемические НМК, нередко повторные.
Патологоанатомическое исследование включало в себя макро- и микроскопическое изучение мозга и его артериальной системы на всех структурно-функциональных уровнях, включая магистральные артерии головы – внутренние сонные и позвоночные артерии, интракраниальные артерии – сосуды виллизиева круга и их ветви, а также внутримозговые артерии и сосуды МЦР. При исследовании мозга определялись величина и локализация интрацеребральных гематом, наличие прорыва крови в желудочковую систему, выраженность отека мозга, дислокации и сдавления его ствола. Учитывались предшествующие летальному инсульту очаговые повреждения мозга в виде крупных постгеморрагических псевдокист, организующихся и организованных ЛИ, а также другие визуализируемые изменения мозга, характерные для АГ (мелкие кровоизлияния, очаги периваскулярного отека, спонгиоформное состояние белого вещества). Микроскопическое исследование мозга проводилось в гистологических препаратах, заключенных в парафин. Они окрашивались гематоксилином и эозином, по методам ван Гизона (определение коллагеновых волокон и миоцитов в сосудах), Вейгерта (выявление эластических волокон в сосудах), Перльса (выявление гемосидерина), нейрогистологическими методами Ниссля (для оценки нейронов и глиальных клеток) и Клювера – Барреры (для оценки миелиновых волокон), а также импрегнированных по Снесареву (выявление ретикулярных волокон сосудов). Особое внимание при исследовании обращалось на сосуды МЦР в пределах гематом, в перифокальной зоне, а также на отдалении от гематом. Статистическая обработка данных проводилась с помощью программы «Statistica 6.0».
Результаты исследования и их обсуждение
Во всех 125 случаях выявлены массивные интрацеребральные кровоизлияния, расположенные в 84 % случаев в полушариях мозга: латеральные – 49 %, медиальные – 13 %, смешанные – 38 %. При этом объем геморрагических очагов превышал 40 см³. В 16 % наблюдений довольно крупные кровоизлияния выявлялись в мозговом стволе и полушариях мозжечка – 9 % и 7 % соответственно. В подавляющем большинстве случаев (79 %) отмечалось распространение крови в желудочковую систему мозга, сопровождавшееся его отеком, дислокацией и сдавлением ствола мозга, зачастую служивших причиной летального исхода. У больных, переживших острый период НМК, гематомы имели признаки организации различной степени выраженности, а отек мозга, как правило, был выражен незначительно или отсутствовал. Во многих наблюдениях выявлялись ранее перенесенные НМК в виде постгеморрагических кист разной величины (63 %), локализовавшихся в основном в участках мозга, симметричных свежей гематоме, значительной давности единичные ЛИ, а также организующиеся и организованные множественные ЛИ (лакунарное состояние мозга), которые более чем в трети случаев сочетались с организованными очагами кровоизлияний. Организующиеся очаги ишемии и лакуны наиболее часто располагались в области базальных ядер и белом веществе обоих полушарий мозга, иногда – в таламусе, мосту мозга и полушариях мозжечка.
При микроскопическом исследовании во всех секционных случаях были выявлены изменения внутримозговых артерий, характерные для гипертонической ангиопатии и послужившие причиной развития крупных кровоизлияний в мозг: плазматическое пропитывание стенок артерий и геморрагии в них со стенозом и облитерацией просветов, очаговый или тотальный фибриноидный некроз с формированием милиарных аневризм, а также первичный (изолированный) некроз мышечных клеток средней оболочки артерий с разрывом сосудов (рис.1).
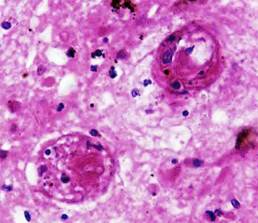
Рис. 1. Головной мозг пациента с плазморрагией в артериальную стенку и ее фибриноидным некрозом (снизу) с резким сужением просветов сосудов («гипертонический стеноз»). Окраска гематоксилином и эозином. Увеличение 200
Установлено, что кровоизлияния возникали на фоне мелкоочаговых и диффузных изменений мозгового вещества, характерных для гипертонической энцефалопатии и обусловленных тяжелой патологией артерий и МЦР мозга – мелкоочаговые периваскулярные кровоизлияния, очаги периваскулярного отека, некроз ткани мозга в периваскулярной области, отек перивентрикулярного белого вещества с разрушением миелина волокон, набуханием и фрагментацией аксонов с сопутствующей макрофагальной реакцией.
Проведенное исследование позволило разделить обнаруженные изменения МЦР на хронические, возникшие до геморрагического инсульта, и острые, возникшие в течение инсульта. К хроническим изменениям отнесены фиброз и утолщение стенок капилляров и других микрососудов с сужением, запустеванием и облитерацией их просветов, что можно расценить как соответственно снижение и утрату их функций (рис. 2).
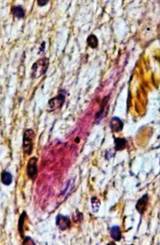
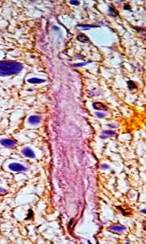
Рис. 2. Головной мозг пациента с резко выраженным фиброзом капилляров и облитерацией их просветов. Окраска по методу ван Гизона. Увеличение 400
Наряду с этим выявлены активная пролиферация клеточных элементов стенок многих микрососудов с формированием конволютов – микрососудистых формаций с множественными просветами, являющихся признаком адаптивных изменений МЦР при АГ, которые развились при ишемически-гипоксическом состоянии мозга вследствие редукции кровотока по артериям, подвергшимся резким деструктивным изменениям с сопутствующим стенозом и облитерацией (рис. 3).
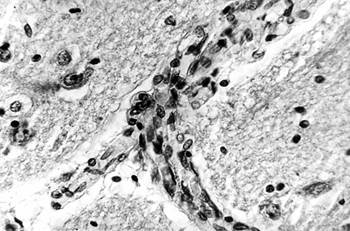
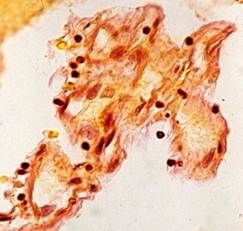
Рис. 3. Головной мозг пациента с адаптивными изменениями МЦР:
а – пролиферация клеток стенок микрососуда, импрегнация по Снесареву, увеличение 200;
б – капиллярный конволют, окраска по методу ван Гизона, увеличение 200
Указанные хронические изменения МЦР обнаружены в коре и белом веществе полушарий мозга и мозжечка, базальных ядрах, таламусе, различных отделах ствола мозга, в том числе в ядрах черепных нервов и ретикулярной формации. Следует подчеркнуть, что эти изменения, как правило, сочетались с характерными для хронической гипоксии липофусцинозом, ишемическим изменением и гибелью отдельных нейронов, а также элективным некрозом нейронных структур при сохранности глиальных элементов. Таким образом, обнаруженные повреждения «метаболического уровня» сосудистого системы мозга при гипоксии подтверждают положение некоторых исследователей о принадлежности МЦР не только к этой системе, но и к элементам паренхимы органов, в том числе вещества мозга [13].
В литературе формирование конволютов рассматривается как адаптивный процесс, направленный на компенсацию недостатка кислорода в ткани мозга при гипоксии и, соответственно, на снижение риска возникновения повторных НМК [14]. Исследования подтвердили, что при острой и хронической ишемии мозга наблюдается активный ангиогенез, который представляет собой комплексный регулируемый процесс, запускаемый гипоксией и приводящий к образованию новых сосудов из предсуществующих микрососудов за счет пролиферации их клеточных компонентов [15]. Установлена роль в регуляции этого процесса сосудистого эндотелиального фактора роста, обладающего проангиогенными свойствами.
К острым изменениям МЦР, которые носили наиболее выраженный и распространенный характер вблизи гематом и в меньшей степени на отдалении от них, отнесены резко выраженный отек эндотелиальных клеток микрососудов с закрытием их просветов и разобщением форменных элементов крови, сепарация крови с плазматизацией стенок капилляров и других микрососудов, резко выраженное полнокровие венул, что характерно для секвестрации кровотока (рис. 4).
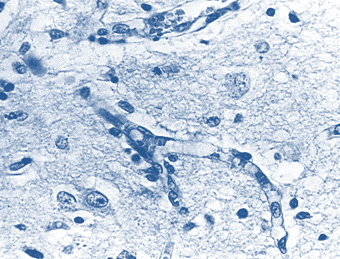
Рис. 4. Головной мозг пациента с отеком эндотелиоцитов капилляров, разобщающих эритроциты, и спонгиоформной структурой белого вещества.
Окраска по методу Клювера – Барреры. Увеличение 200
Отмечался лейкостаз в мелких сосудах и лейкодиапедез. Стенки целого ряда микрососудов, расположенных вблизи кровоизлияния, были некротизированы. В первые сутки на значительном расстоянии от гематомы обнаруживался резко выраженный отек вещества мозга, придающий ему спонгиоформную структуру (см. рис. 4), полнокровие МЦР, артерий и вен, стаз и тромбообразование в капиллярах, периваскулярные кровоизлияния с распространением эритроцитов вдоль волокон белого вещества. Кровь, проникшая в периваскулярные пространства из гематомы, обнаруживалась в них на довольно больших расстояниях от гематомы вплоть до субарахноидального пространства.
К острым изменениям МЦР, которые наблюдались в ряде случаев особо тяжелого течения геморрагического инсульта с развитием обширных гематом и прорывом крови в желудочки, относились также явления, характерные для синдрома диссеминированного внутрисосудистого свертывания крови: распространенный тромбоз микрососудов с фрагментацией тромбов, предтромботическое состояние в видесетевидных скоплений нитей фибрина в венулах, тромбоэмболы в просветах последних (рис. 5), шоковые тела в мелких интрацеребральных артериях и венах, а также перикапиллярные, периартериолярные и перивенулярные кровоизлияния.
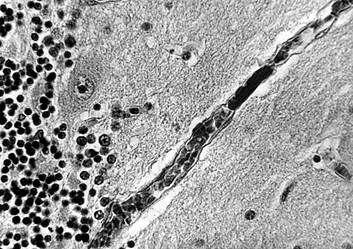
Рис. 5. Головной мозг пациента с тромбом (стрелка) в венуле коры мозжечка при синдроме диссеминированного внутрисосудистого свертывания крови.
Импрегнация по Снесареву. Увеличение 200
Установлено, что МЦР принимает активное участие на разных стадиях организации гематом: от отека и организации некроза окружающей ткани мозга в начальной стадии, до реабсорбции эритроцитов во второй и формирования глиомезодермального рубца вокруг псевдокисты в финальной стадии. Элементы МЦР принимают участие в иммунном воспалении (в виде реакции гиперчувствительности замедленного типа), которое развивается в ткани мозга при НМК, т.к. при них разрушается гематоэнцефалический барьер, и ткань мозга приобретает антигенные свойства по отношению к организму.
Заключение
Проведенное исследование показало, что изменения сосудов МЦР при АГ, осложнившейся развитием геморрагического инсульта, обусловлены гипоксией и ишемией мозга, его отеком, резким нарушением проницаемости сосудов. Эти изменения имеют локальный и распространенный характер, могут быть разделены на острые, возникшие в течение инсульта, и хронические, развившиеся до инсульта. Полученные данные способствуют дальнейшему развитию концепции гипертонической ангиопатии головного мозга, охватывающей все структурно-функциональные уровни его артериальной системы, важнейшим из которых являются сосуды МЦР.
Библиографическая ссылка
Гулевская Т.С., Ануфриев П.Л. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ CОСУДОВ МИКРОЦИРКУЛЯТОРНОГО РУСЛА ГОЛОВНОГО МОЗГА ПРИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ С НАРУШЕНИЯМИ МОЗГОВОГО КРОВООБРАЩЕНИЯ // Современные проблемы науки и образования. 2017. № 4. ;URL: https://science-education.ru/ru/article/view?id=26720 (дата обращения: 16.02.2026).



