Большинство пациентов после тотального эндопротезирования (ТЭП) крупных суставов нижних конечностей отмечают исчезновение болевого синдрома как основной жалобы, а также значимое улучшение функции как прооперированного сустава, так и всей конечности в целом [1,2]. Однако определенная часть больных испытывает сложности в восстановлении полноценного функционального статуса, в частности, статического баланса и цикла ходьбы [3]. Предрасполагающими факторами в данной ситуации служат тяжелая степень поражения сустава, связанная с длительностью патологического процесса, нарушением оси конечности и/или укорочением сегмента, снижением чувства проприорецепции; слабость параартикулярных мышц и связок; наличие сопутствующих заболеваний, в том числе сердечно-сосудистой, эндокринной, вертебро-неврологической патологии [4].
В результате основные биомеханические показатели баланса и ходьбы пациента нарушаются и характеризуются биомеханически невыгодным положением основной стойки, асимметрией цикла шага, неадекватностью опорных реакций при нагрузке [3,5]. Однако существует эффективный метод реабилитации биомеханических нарушений после ТЭП крупных суставов в виде искусственной коррекции движений (ИКД) посредством программируемой функциональной электромиостимуляции (ФЭС). В последние десятилетия данный метод находит все большее распространение при лечении пациентов с патологией нервной системы, опорно-двигательной системы [6,7]. Основным показанием к использованию данного метода является дефицит мышечной функции любого происхождения, приводящий к патологической локомоции. Перспективным представляется применение ФЭС у пациентов после ТЭП крупных суставов, определение показаний и противопоказаний к использованию метода, выявление контингента пациентов, нуждающихся в активной реабилитации с использованием данного метода. Наше исследование посвящено изучению динамики биомеханических и электрофизиологических параметров локомоторной системы больных после ТЭП, которым проведена реабилитация в виде ИКД.
Материалы и методы. Проведен анализ статуса локомоторной системы 25 пациентов, страдающих деформирующим остеоартрозом тазобедренных суставов (16 женщин и 9 мужчин, средний возраст 64,3±0,8 года) через 6–12 месяцев после оперативного вмешательства. Обследование проводилось на стабилометрическом программно-аппаратном комплексе «МБН Биомеханика» (г.Москва). Стабилометрия позволяла регистрировать положение общего центра давления (ОЦД) в основной стойке с европейской позицией стоп и биомеханически сложившийся паттерн статической позы. С использованием электроподографии и динамометрии исследованы временные характеристики шага и реакции опоры. Полученные данные изучены с помощью разработанной нами ранее программы для ЭВМ «Программа для оценки кинематической и статической функции опорно-двигательной системы на основе данных биомеханических исследований» (свидетельство о государственной регистрации №2016663559). Учитывали следующие параметры: среднее положение в центре давления во фронтальной и сагиттальной плоскостях и среднюю скорость колебания, длину и площадь статокинезиограммы, коэффициент ритмичности, период опоры и период одиночной опоры, экстремумы вертикальной составляющей реакции опоры [8,9]. Всем пациентам после имплантации эндопротеза тазобедренного сустава для повышения активационных способностей мышц окружающих сустав и мышц бедра оперированной конечности и контралатеральной стороны проведена комплексная ФЭС с использованием прибора «Стимул» фирмы МБН (г. Москва) с комплектом накожных электродов. Выбор мышц для стимуляции осуществляли по данным электромиографического (ЭМГ) паттерна, проведенного до оперативного лечения с определением характера мышечного дефицита (абсолютный, относительный) согласно рекомендациям профессора А.С. Витензона, К.А. Петрушанской [6]. В соответствии с нашими наблюдениям, а также данным литературных источников наиболее пораженными мышцами у больных с артрозом тазобедренного сустава являются ягодичные мышцы, мышцы передней группы бедра и передняя большеберцовая мышца на пораженной стороне и противоположной конечности [10]. Поэтому мы проводили функциональную электростимуляцию большой и средней ягодичных мышц, прямой мышцы бедра и передней большеберцовой мышцы с индивидуальным подбором параметров тока и размещением электродов на двигательных точках мышц согласно рекомендациям проведения ИКД. В качестве синхронизирующего датчика использовали гониометрический датчик, расположенный на коленном суставе, так как движения в тазобедренном суставе имели нарушенную периодичность. В связи с небольшим периодом времени прошедшим после операции и возрастом пациентов применялся малый или средний темп ходьбы. Частота стимулируемых импульсов не превышала 50Гц. Длительность импульса колебалась от 100 до 160 мкс. Амплитуда стимулирующего тока была наименьшей у пациентов с небольшими отклонениями биомеханических и ЭМГ–данных и составляла 35-42 мА. У больных с ЭМГ-признаками поражения всех составляющих мионеврального комплекса амплитуда тока была выше и колебалась от 58 до 70 мА. Электромиостимуляцию проводили двумя-тремя курсами по 10–15 сеансов в каждом с перерывами между ними по 3–4 недели. Статистический анализ показателей до, в процессе и после стимуляции проводился с помощью непараметрического критерия Уилкоксона для связанных выборок.
Результаты исследования. Функциональные результаты пациентов после курса реабилитации были оценены как отличные у 7 человек (28 %), хорошие – у 11 (44 %), удовлетворительные – у 4 (16 %) и неудовлетворительные – у 3 (12 %). В группе отличных результатов интегральный показатель оценки кинематической и статической функции опорно-двигательной системы (обозначенный как показатель К) после реабилитации был в пределах 22–33, т.е. нарушения отсутствовали. До реабилитации значения показателя К составляли 34–38 (р<0,05) и достоверно отличались от полученных данных после стимуляции. Наиболее значимую положительную динамику демонстрировали подографические параметры – коэффициент ритмичности, который до реабилитации был 0,93–0,94, а после реабилитации приблизился к норме и составил 0,95–1 (р<0,05); время цикла шага, до стимуляции составлявшее 0,9–1,6 сек, а после стимуляции достигшее нормальных величин (1–1,4 сек) (р<0,05).
Положительную динамику также продемонстрировали стабилометрические параметры: положение центра давления во фронтальной и сагиттальной плоскостях, длина и площадь статокинезиограммы, а также экстремумы вертикальной составляющей опоры (рис. 1).
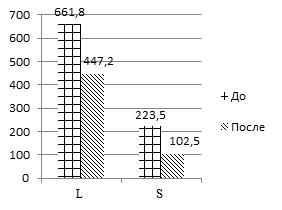
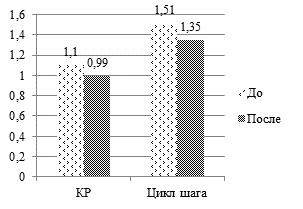
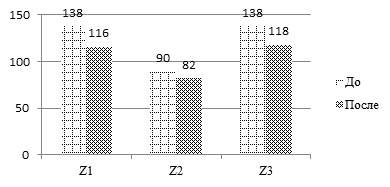
Рис. 1. Динамика средних значений биомеханических показателей кинематической и локомоторной функции локомоторной системы у пациентов до и после реабилитации.
Обозначения: L – длина статокинезиограммы, S – площадь статокинезиограммы, КР – коэффициент ритмичности, Z1,Z3 – максимумы вертикальной составляющей реакции опоры, Z2 – минимум вертикальной составляющей реакции опоры
В группе хороших результатов после реабилитации интегральный биомеханический показатель К составил 29–33, в то время как до реабилитации этот показатель был 38–41 (р<0,05). У 4-х пациентов в этой группе показатель К был свыше 35, что соответствовало выраженным функциональным нарушениям. Учитывая тот факт, что у данных пациентов удалось нормализовать подографические и динамические параметры, характеризующие устойчивость при ходьбе и ее симметричность, мы отнесли результаты их лечения к хорошим. Данные электромиографического исследования в этой группе пациентов показали, что, несмотря на хорошие биомеханические показатели, амплитуда ЭМГ большой и средней ягодичных мышц на стороне пораженного сустава отличалась от нормы и не превышала 656+23,3 мкв и 346+34,6 мкв соответственно. Частотные характеристики соответствовали норме (не более 400 Гц), структурные изменения ЭМГ-кривых отсутствовали. Показатели прямой мышцы бедра в большинстве случаев соответствовали данным нормы. В этой группе больных мы не выявили признаков мышечного поражения, а снижение уровня миоактивности ягодичной группы связывали с функциональной недогрузкой мышц из-за болевого синдрома, ограничивающего разгибание и отведение в тазобедренном суставе.
У пациентов с удовлетворительными исходами оперативного лечения изменения электрогенеза мышц были более выраженными. Показатели ЭМГ-паттерна ягодичных мышц не превышали 45 % от данных нормы. Наиболее сниженной была амплитуда ЭМГ средней ягодичной мышцы, значения которой составили 280+11,8 мкв (р<0,05). В группах пациентов с удовлетворительными результатами выявлены структурные изменения кривых, характерные для миодистрофической перестройки двигательных единиц. Более низкие показатели интерференционного паттерна были отмечены также в прямой мышце бедра и составили 480,3+32,1мкв (р<0,05), в передней большеберцовой мышце – 378,2+11,9 мкв (р<0,05). Снижение сократительной способности мышц перонеальной группы голени регистрировалось с 2-х сторон и чаще было связано с радикулярными поражениями, о чем свидетельствовал сдвиг амплитудно-частотных характеристик ЭМГ.
Выраженные функциональные нарушения получены у 3-х человек, у которых интегральный биомеханический показатель составлял 46–49 баллов, результаты их лечения были расценены как неудовлетворительные. Причинами подобных результатов, на наш взгляд, послужили несколько факторов: преклонный возраст (свыше 73 лет), невыполнение элементарной гимнастики для суставов, наличие сопутствующей патологии (дегенеративный стеноз позвоночного канала, хроническая ишемия головного мозга, снижение остроты зрения из-за возрастных изменений). Больные с неудовлетворительными результатами лечения выделялись значительным снижением ЭМГ-паттерна мышц ягодичной группы, мышц бедра и голени, как на оперированной конечности, так и противоположной стороне. Практически у всех пациентов амплитуда ЭМГ средней ягодичной мышцы не превышала 100 мкв, прямой мышцы бедра – 230 мкв. Структурные нарушения ЭМГ кривых мышц бедра и голени носили полиморфный характер. Регистрировались признаки невропатического и миодистрофического поражения.
Результаты электрофизиологического исследования свидетельствовали о необходимости повышения активационных свойств мышц бедра и голени для нормализации локомоторных функций нижних конечностей и снижения энергозатрат при передвижении. Применение метода ИКД позволило не только снизить уровень дефицита мышечной активности нескольких мышц, но и исправить ослабленные элементы ходьбы. После курса ФЭС отмечены следующие клинические признаки его эффективности: повышение устойчивости при ходьбе, повышение скорости передвижения, прохождение более длительного отрезка пути без ощущения дискомфорта, ослабление нагрузки на дополнительную опору или отказ от нее, увеличение амплитуды движений в суставах. Сопоставление результатов ЭМГ-исследования до и после ИКД показало, что наибольший прирост мышечной активности был отмечен у больных с удовлетворительными функциональными результатами. Достоверное увеличение ЭМГ показателей средней и большой ягодичных мышц на 35–46 %, прямой мышцы бедра – на 28–34 % относительно исходных данных свидетельствовало о повышении сократительных свойств стимулированных мышц (рис. 2).
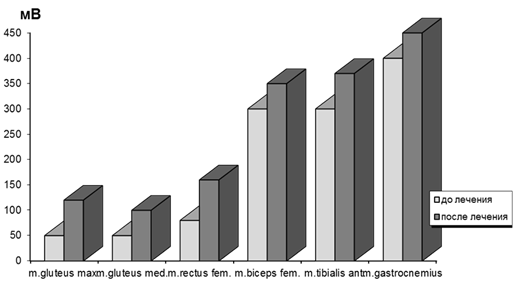
Рис. 2. Динамика амплитудных характеристик мышц нижних конечностей у больных до и после эндопротезирования тазобедренного сустава до и после применения функциональной электромиостимуляции
Менее выраженный, но достоверный сдвиг ЭМГ-профиля регистрировался у пациентов с выраженным дефицитом мышечной активности в виде тенденции к повышению амплитуд ЭМГ-кривых большой ягодичной и четырехглавой мышц бедра.
Обсуждение. Длительное время восстановление функционального статуса пациента после ТЭП крупных суставов сводилось к применению методов лечебной физкультуры и физиотерапии. Относительно недавно был разработан новый эффективный метод, удачно сочетающий положительные эффекты традиционных методов реабилитации – ИКД (W.T. Liberson, 1961) [9]. Благодаря ему во время сознательной локомоции пациента происходит сокращение необходимых мышц, подобное естественному. Кроме того, сеансы ИКД в послеоперационном периоде у пациентов с ТЭП крупных суставов позволяют снизить или устранить дефицит мышечной функции, устранить асимметричность походки и ускорить функциональное восстановление прооперированной конечности. Основными преимуществами данного метода реабилитации являются возможность включения в работу мышц в основные фазы двигательного цикла, соответствующие фазам естественного возбуждения и сокращения; стимуляционное воздействие не на отдельную мышцу, а на конечности и туловище в целом; приближение к норме патологического двигательного стереотипа в результате усиления функции ослабленных мышц и коррекции нарушенных движений. Показаниями к назначению активных реабилитационных мероприятий являются выраженные нарушения походки и основной стойки по данным подографии и стабилометрии, нарушения динамической опороспособности конечности, а также выраженная асимметрия и снижение ЭМГ-данных по сравнению с контралатеральной конечностью.
Заключение. Таким образом, метод искусственной коррекции движений с помощью контролируемой электромиостимуляции позволяет улучшить состояние кинематической и локомоторной функции опорно-двигательной системы у пациентов после ТЭП крупных суставов. Хотя положительная динамика в отношении функции нижних конечностей отмечается уже после одного курса проводимой электромиостимуляции, по нашим наблюдениям, данная категория пациентов нуждается в проведении не менее двух курсов ИКД для повышения эффективности реабилитационных мероприятий.
Библиографическая ссылка
Ромакина Н.А., Сертакова А.В., Коршунова Г.А., Пучиньян Д.М., Ульянов В.Ю. ДИНАМИКА БИОМЕХАНИЧЕСКИХ ПОКАЗАТЕЛЕЙ ФУНКЦИОНАЛЬНОГО СТАТУСА У БОЛЬНЫХ ПОСЛЕ ТОТАЛЬНОГО ЭНДОПРОТЕЗИРОВАНИЯ КРУПНЫХ СУСТАВОВ НИЖНИХ КОНЕЧНОСТЕЙ НА ФОНЕ ИСКУССТВЕННОЙ КОРРЕКЦИИ ДВИЖЕНИЙ // Современные проблемы науки и образования. 2017. № 4. ;URL: https://science-education.ru/ru/article/view?id=26697 (дата обращения: 05.01.2026).



