Рак простаты (РП) занимает второе место среди злокачественных новообразований у мужчин. В последние годы отмечается быстрый рост заболеваемости РП. В России в 2000 году состояло на учете у онкологов 37 442 больных РП, а в 2010 году – 107 942 пациента, прирост составил 155 % [1]. Несмотря на улучшение методов диагностики и внедрение ПСА-мониторинга, заболеваемость запущенными формами РП в России остается на высоком уровне. В последние десятилетия эффективность лечения онкологических больных по показателям длительной выживаемости и продолжительности жизни изменяется незначительно [2]. Лечебный патоморфоз — это типовые и стойкие изменения клинических и морфологических проявлений опухоли под воздействием лечения. Неоспоримым методом оценки степени развития лечебного патоморфоза после воздействия на ткань простаты является гистологическое и иммуногистохимическое исследование [3,4]. Однако для разных методов лечения рака простаты характерны свои особенности морфологических и иммуногистохимических изменений.
Цель: изучение степени выраженности патоморфоза аденокарциномы простаты через 3 месяца после максимальной андрогенной блокады (МАБ).
Материалы и методы
В данной работе мы изучали материал, полученный от 30 пациентов с диагнозом ацинарная аденокарцинома простаты до и после лечения МАБ. До лечения исследовали материал трансректальной биопсии простаты, после – материал трансуретральной резекции простаты. Признаки патоморфоза РП оценивали через 3 месяца после билатеральной орхэктомии или химической кастрации (20 пациентов – после билатеральной орхэктомии, 10 пациентов – после 3 месяцев непрерывного приема элегарда). Материал после фиксации, стандартной проводки и парафинизации окрашивали гематоксилином и эозином. Изучали морфологические изменения не только в аденокарциноме, но и в железах простаты. Иммуногистохимические реакции проводили на парафиновых срезах, используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675) фирмы Daco, в качестве хромогена – диаминобензидин (Daсo). В работе использовали следующие антитела: Monoclonal Mouse Anti-Human Androgen Receptor Clone AR 441-фирма Daco (разведение 1:50); P53 Mouse Monoclonal Antibody- фирма CELL MARQUE (разведение 1:100); Monoclonal Mouse Anti-Human Ki67 Antigen Clone MIB-1-фирма Daco (разведение 1:100); AMACR Rabbit Polyclonal Antibody RP 134 R -фирма Diagnoatic BioSystems (разведение 1: 50); Monoclonal Mouse anti Bcl-2 oncoprotein-фирма Daco (разведение 1:50). Результаты реакций цитоплазматических маркеров (AMACR, Вcl2) оценивали полуколичественным способом по балльной шкале от 0 до 3 с помощью светового бинокулярного микроскопа «MicrosMC100», учитывая выраженность реакции и ее локализацию: 0 – отсутствие экспрессии, 1 – слабая экспрессия, 2 – умеренная экспрессия, 3 – сильная экспрессия маркера. Результаты экспрессии с ядерными антигенами (Р53, Andr) оценивали, подсчитывая количество окрашенных ядер на 100 ядер в 5 полях зрения, выражая полученные результаты в процентах. Результаты реакций оценивали по системе подсчета histochemical score (Hs). Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-х балkьной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное окрашивание.
Формула подсчета следующая: histochemicalscore (Hs) = ∑ P (i) х i,
где i – интенсивность окрашивания, выраженная в баллах от 0 до 3. P (i) – процент клеток, окрашенных с разной интенсивностью. Для определения индекса пролиферации экспрессии ядерного маркера Ki67 выполняли подсчет количества окрашенных ядер клеток опухоли, учитывая процентное соотношение окрашенных/неокрашенных ядер клеток на 100 учтенных клеток в 10-ти репрезентативных полях зрения при увеличении х40. Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows, критерия Манна – Уитни.
Результаты исследования и их обсуждение
В биоптатах простаты, до лечения у всех 30 пациентов была диагностирована ацинарная форма аденокарциномы 3+4=7 или 4+4=8 балов по Глисону, занимающая в среднем 40–60 % биоптата. Кроме участков аденокарциномы, у всех пациентов диагностировались признаки доброкачественной гиперплазии простаты (смешанный вариант) с простатической интраэпителиальной неоплазией (ПИН) высокой степени. Через 3–3,5 месяца после лечения МАБ при морфологическом изучении материала с помощью обзорных методов окраски, у всех пациентов (как после билатеральной орхэктомии, так и химической кастрации) в аденокарциноме развивались следующие изменения: в цитоплазме опухолевых клеток – дистрофические изменения. Ядра становились более мелкими, гиперхромными, ядрышки не визуализировались. После лечения у 70 % пациентов увеличивалась градация по Глисону, так как на некоторых участках опухоль теряла свое ацинарное строение, начинали преобладать участки солидного строения из мелких опухолевых клеток. Описанные изменения, развивающиеся в простате в первые месяцы после МАБ, отмечают и другие авторы [5]. В строме простаты у 98 % пациентов появлялась очаговая лимфоцитарная инфильтрация и полнокровие сосудов. Морфологические изменения в простате у пациентов после билатеральной орхэктомии и химической кастрации были одинаковые.
По данным литературы [6], опухолевый маркер Ki-67 является одним из наиболее востребованных в онкологии для морфологического определения пролиферативной активности опухолевых клеток, степени злокачественности новообразования и решения вопроса о виде дополнительного консервативного лечения в адъювантном и/или неоадъювантном режимах. Для достоверной оценки данного маркера изучали его экспрессию как до, так и после МАБ. До лечения индекс пролиферации опухолевых клеток был во всех случаях на достаточно высоком уровне и колебался от 40 % до 89 % (медиана 60 %). После МАБ (как билатеральной орхэктомии, так и химической кастрации) показатели индекса пролиферации заметно снижались и находились в пределах от 0 % до 25 % (медиана15 %). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия. Экспрессия данного маркера в ядрах эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) также снижалась: до МАБ медиана – 40 %, после – 1,5 %, однако по критерию Манна – Уитни различия в данных выборах были не существенны.
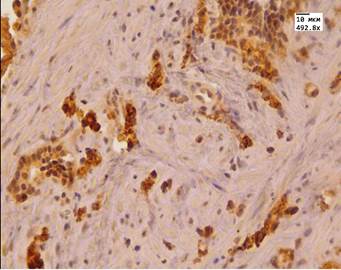
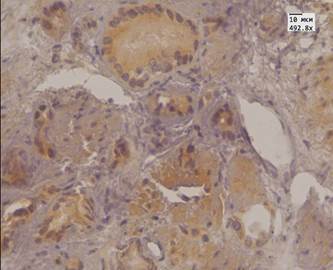
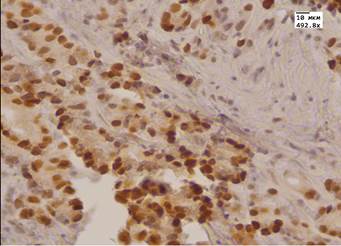
Альфа-метилацил-КоА-рацемаза (AMACR) – специфичный высокоэффективный иммуногистохимический онкомаркер, позволяющий дифференцировать рак простаты от других патологических процессов, а также более точно определить стадию заболевания. Этот маркер считается позитивным в 80–100 % случаев малых очагов рака [7]. В нашем исследовании до лечения у 96 % пациентов в аденокарциноме простаты отмечали сильную (3 балла) экспрессию данного маркера в виде мелких зерен коричневого цвета в цитоплазме, у 4 % пациентов – умеренную. После лечения у 56,5 % пациентов экспрессия данного маркера была слабая (1 балл), у 37,5 % – умеренная (2 балла), и лишь у 6 % пациентов экспрессия оставалась на высоком уровне (3 балла). Сравнивая показатели двух групп по критерию Манна – Уитни, мы получили существенные различия в уровнях выборок. Экспрессия AMACR находилась в прямой корреляции с маркером пролиферации Ki-67. Экспрессия данного маркера в цитоплазме эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) также снижалась, однако по критерию Манна – Уитни различия в выборах до и после лечения были не существенны. Стромальная экспрессия данного маркера была минимальна как до, так и после МАБ.
Р53 иммуногистохимический маркер, локализующийся в ядре клетки, является супрессором опухолевого роста. Он предотвращает вступление клетки с поврежденной ДНК в фазу цикла и индуцирует апоптоз. Мутация гена р53 ведет к потере контроля пролиферации клеток, угнетению апоптоза. Утрата функции этого гена может быть связана с высоким метастатическим потенциалом опухоли и развитием андрогеннезависимого РП. Величина экспрессии мутированного р53 при РП зависит от того, состоит ли она из гормонозависимых клеток или образована гормононезависимыми клетками [7]. Однако другие авторы считают, что взаимосвязь между экспрессией маркера p53 и прогнозом при РП требует дальнейшего изучения [8]. В нашем исследовании мы учитывали экспрессию данного маркера в ядрах эпителия желез и в элементах опухоли. У пациентов до лечения МАБ в аденокарциноме простаты экспрессия данного маркера колебалась в пределах Hs= от 200 до 70 (медиана 130). После МАБ показатели экспрессии снижались: медиана Hs=60, но интервал колебания экспрессии данного показателя составлял от Hs=15 до 250. Сравнивая показатели групп по критерию Манна – Уитни, мы получили, что различия в уровнях выборок были не существенными. В ядрах эпителия простатических желез экспрессия Р53 до МАБ составляла Hs= от 70 до 0 (медиана 50), после лечения МАБ Hs= от 20 до 0 (медиана 5). По критерию Манна – Уитни различия в уровнях выборок были не существенными.
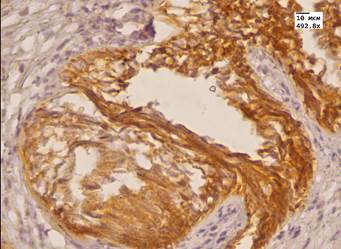
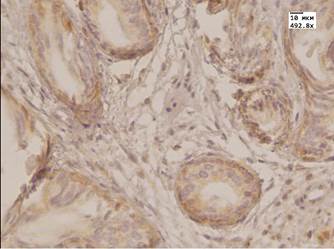
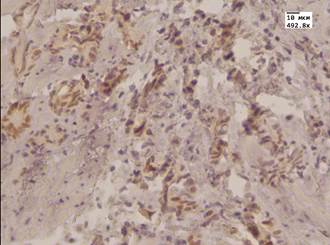
Антиген Всl-2 экспрессируется в цитоплазме и на базальной мембране эпителия желез и является регулятором апоптоза. В андрогеннезависимом РП отмечается усиленная экспрессия гена Bcl-2, что является признаком гормоноустойчивости [9]. Ген Вс1-2 способствует опухолевой прогрессии, ингибируя апоптоз и тем самым повышая выживаемость опухолевых клеток [10]. В нашем исследовании экспрессия данного маркера в клетках аденокарциномы у пациентов до МАБ была умеренной (2 балла) и сильной (3 балла) во всех случаях. После лечения у 12 % пациентов экспрессия оставалась сильной, у 41 % пациентов отмечали умеренную экспрессию, у 35 % – слабую, и у 12 % экспрессия данного маркера в опухолевых клетках была отрицательной. Используя критерий Манна – Уитни, можно считать, что различия в уровнях выборок являются существенными. У 93 % пациентов после МАБ положительная экспрессия Вс1-2 в лимфоцитах в очагах лимфоцитарной инфильтрации в строме простаты. Экспрессия данного маркера в цитоплазме эпителия желез простаты (доброкачественная гиперплазия простаты с ПИН высокой степени) снижалась, но по критерию Манна – Уитни различия в выборах до и после лечения были не существенны.
|
|
||||
|
|
|
||||
|
|
Рис.1. Аденокарцинома простаты. А. Иммуногистохимическая реакция с антителом к AMACR до лечения МАБ. Ув.492,8. Б. Иммуногистохимическая реакция с антителом к AMACR после лечения МАБ. Ув.492,8. В. Иммуногистохимическая реакция с антителом к Bcl 2 до лечения МАБ. Ув.492,8. Г. Иммуногистохимическая реакция с антителом к Bcl 2 после лечения МАБ. Ув.492,8. Д. Иммуногистохимическая реакция с антителом Androgen до лечения МАБ. Ув.492,8. Е. Иммуногистохимическая реакция с антителом Androgen после лечения МАБ. Ув.492,8.
Андрогены участвуют в стимуляции пролиферации эпителиальных клеток простаты, а также стимулируют синтез кератинного и фибробластического факторов роста стромальными клетками, что оказывает митогенный эффект на окружающую строму и эпителиальные клетки. До МАБ экспрессия данного маркера в аденокарциноме простаты у 70 % пациентов была выраженной (медиана Hs=210). Через 3 месяца после МАБ медиана Hs составила 86, показатель гистосчета колебался в пределах от 4 до 300. При анализе критерия Манна – Уитни различия в уровнях выборок можно считать существенными. При сравнительном анализе экспрессии андрогенов в ядрах эпителия желез простаты до и после лечения также отмечалась статистически значимая разница критерия Манна – Уитни. В строме простаты экспрессия данного маркера у 98 % пациентов отсутствовала. Экспрессия андрогенов находилась в прямой корреляции с экспрессией Ki67 и AMACR.
Заключение
Через 3 месяца после МАБ независимо от метода ее проведения (билатеральная орхэктомия или химическая кастрация) при стандартной окраске гематоксилином эозином в эпителии желез и опухолевых элементах развиваются выраженные дистрофические изменения, часть опухоли теряет ацинарное строение, в результате чего увеличивается индекс Глисона. Несмотря на это отмечается снижение индекса пролиферации, экспрессии онкомаркера AMACR и маркера регулятора апоптоза Bcl-2 в опухолевой ткани до и после МАБ (р≤ 0,05). Снижение экспрессии данных маркеров в ядрах эпителия желез простаты не существенно. Экспрессия регулятора апоптоза Р53 в ядрах опухолевых клеток и не измененных желез после МАБ снижалась, но достоверного различия между группами пациентов до и после лечения не было. Ядерная экспрессия андрогенов в аденокарциноме и железах простаты через 3 месяца после МАБ достоверно снижалась. Таким образом, после МАБ в аденокарциноме достоверно снижается экспрессия маркера пролиферация, онкомаркера AMACR, ингибитора апоптоза. Экспрессия андрогенов достоверно снижается как в аденокарциноме, так и в эпителии желез простаты.
Библиографическая ссылка
Маслякова Г.Н., Воронина Е.С., Бучарская А.Б., Медведева А.В. ЛЕЧЕБНЫЙ ПАТОМОРФОЗ АДЕНОКАРЦИНОМЫ ПРОСТАТЫ ЧЕРЕЗ 3 МЕСЯЦА ПОСЛЕ МАКСИМАЛЬНОЙ АНДРОГЕННОЙ БЛОКАДЫ // Современные проблемы науки и образования. 2017. № 4. ;URL: https://science-education.ru/ru/article/view?id=26608 (дата обращения: 16.02.2026).