Изучение биологических эффектов малых доз ионизирующих излучений (ИИ) является одной из центральных проблем современной радиобиологии, требующей привлечения все новых подходов для ее решения. К настоящему времени установлено, что малые дозы ИИ являются индуктором некоторых генетических и эпигенетических механизмов, при этом зависимость эффекта от дозы облучения носит немонотонный полимодальный характер [1-3]. Появляется все больше данных о том, что ИИ может приводить к нестабильности генома, модифицировать клеточные и тканевые процессы которые способны реализовываться на разных уровнях структурной организации, что в конечном итоге способствует изменению чувствительности организма к действию дополнительных нерадиационных факторов [1; 2; 4]. В рамках этой проблемы особого внимания заслуживают результаты изучения ответных реакций органов и тканей, которые обладают разной пролиферативной активностью. Для выявления закономерностей действия ИИ в хроническом режиме важным является изучение тканей с низким пролиферативным потенциалом, способных накапливать структурные изменения ДНК [5]. Кроме того, в отдаленные сроки после облучения наблюдаются нарушения, длительно сохраняющиеся и в интенсивно размножающихся тканях, которые, по всей вероятности, также имеют своей первопричиной нестабильность генома облученных клеток [4]. Проявления геномной нестабильности, такие как усиленный мутагенез, нарушение контроля клеточной пролиферации и апоптотической гибели, изменение характера экспрессии генов, могут приводить к стойким морфофункциональным перестройкам на более высоких уровнях организации [6].
Цель исследования – оценить процессы размножения и степень поврежденности генома в соматических клетках мышей линии Af после хронического γ-облучения в диапазоне малых доза (10-30 сГр) и изучить возможность модификации радиационно-индуцированных эффектов после дополнительного химического воздействия.
Материалы и методы исследования. Опыты проводили на 115 мышах линии Af (на начало экспериментов масса тела 20-25 г), полученных из научной коллекции экспериментальных животных ФГБНУ «ИБ Коми НЦ УрО РАН» (http://www.ckp-rf.ru/usu/471933/). Исследования осуществляли в соответствии с рекомендациями, приведенными в [7]. Животных случайным образом делили на опытные (облученные) и контрольные группы. Мышей опытных групп в возрасте двух-трех месяцев подвергали γ-облучению в течение 29, 56 и 84 суток от двух источников 226Ra (мощность экспозиционной дозы – 150 мкГр/ч), в результате суммарные поглощенные дозы составили 10, 20 и 30 сГр соответственно. Поглощенную дозу облучения определяли по показаниям термолюминесцентных дозиметров (ДТУ-01) с детекторами ДТГ-4 (LiF) на дозиметрической термолюминесцентной установке ДВГ–02ТМ (НПП «Доза», Россия). Контрольные особи находились в идентичных условиях при нормальном уровне радиационного фона (0,15 мкГр/ч). Через четыре месяца после окончания облучения животных выводили из эксперимента путем декапитации. Непосредственно после вскрытия у облученных и контрольных животных взвешивали органы для последующего вычисления индексов селезенки, печени и семенников и брали материал для молекулярных и цитогенетических исследований клеток щитовидной железы, костного мозга и мужских половых клеток. При оценке процессов воспроизводства облученных самцов спаривали с облученными самками (1:2) во всех опытных группах (10, 20 и 30 сГр) и в течение последующих трех месяцев регистрировали показатели, характеризующие интенсивность размножения самок (одновременно с контрольными группами). Выявление модификации радиационно-индуцированных эффектов после дополнительного химического воздействия осуществляли на животных, облученных в максимальной из используемых доз – 30 сГр. Для этого через четыре месяца после прекращения облучения одной группе животных внутрибрюшинно вводили 10%-ный раствор уретана (этилкарбамат; Sigma-Aldrich, USA) в количестве 1 мг/г массы тела особи (приготовленный на основе изотонического раствора), а второй – аналогичным образом эквивалентное массе тела количество 0,9%-ного раствора NaCl. Эти же манипуляции осуществляли и с контрольными особями. Через 48 часов после химических воздействий всех животных выводили из эксперимента путем декапитации с последующим взятием материала для цитогенетических исследований соматических и половых клеток.
Генетические нарушения в половых клетках самцов определяли по частоте аномальных головок сперматозоидов (АГС) на 500 клеток под световым микроскопом Micros (Austria). В клетках костного мозга и щитовидной железы с помощью флуоресцентного микроскопа Axioscop А1, (Carl Zeiss, Germany) подсчитывали число клеток с микроядрами (МЯ), в костном мозге на этих же препаратах также анализировали митотический индекс (МИ) и долю клеток, элиминирующих по пути апоптоза (500-1000 клеток на препарат). Методики приготовления препаратов соматических клеток подробно описаны в работе [8]. Двунитевые разрывы ДНК (ДР ДНК) определяли по методу «ДНК-комет» в нейтральной версии рН с применением программы Соmet Score Pro (TriTek Corp., USA) с помощью видеосистемы на основе цифровой камеры AxioCam (Carl Zeiss; Germany). На слайде для разных тканей обрабатывали не менее 50-100 «комет» на одно животное. Рассчитывали среднее значение %ТDNA, отражающее процент ДНК в «хвосте кометы», вычисляли частоту встречаемости клеток с неповрежденной и/или низко фрагментированной ДНК (диапазон 0-10%TDNA) и с высоко фрагментированной ДНК (имеющие более 40% ДНК в «хвосте кометы»). Полученные данные подвергали стандартному статистическому анализу с использованием при сравнении различий между опытными и контрольными группами t-критерия Стьюдента. Результаты представлены в таблице в виде средней арифметической и ошибки средней (M±m).
Результаты исследования и их обсуждение. Значения массы тела зверьков и индексов разных органов, используемые для определения общего физиологического состояния организма в целом, не показали статистически значимых различий между опытными и контрольными группами животных (табл. 1). Способность к воспроизводству осуществляется под генетическим контролем, и изменения в этом процессе могут свидетельствовать о нарушениях в геноме. Обнаружено, что хроническое воздействие ИИ вызывало статистически значимое увеличение числа рожденных детенышей на самку (при всех дозах облучения) и числа детенышей в помете (20 и 30 сГр) по сравнению с контрольными данными (табл. 2). Анализ частоты цитогенетических нарушений в половых клетках самцов, выявляемых по количеству АГС, не показал статистически значимых отличий между облученными (при всех дозах) и контрольными животными. По данным литературы, стимуляция интенсивности размножения является компенсацией высокой эмбриональной и постэмбриональной смертности, сокращения продолжительности жизни и других отрицательных эффектов [9]. Результаты проведенного эксперимента позволили выявить повышение на 21,8% и 12,8% смертности детенышей (в первые сутки жизни), рожденных от родителей, облученных в дозах 20 и 30 сГр, чего не наблюдали после дозы 10 сГр и в контроле. Отметим, что до окончания эксперимента (возраст животных 10 мес) и в контрольных и в опытных группах доживало меньше самок, чем самцов (рис.), что можно объяснить дополнительными энергетическими затратами, связанными с вынашиванием и выкармливанием детенышей самками. При этом число самок, доживших до анализируемого срока, было максимальным после облучения в дозе 20 сГр.
Таблица 1
Морфофизиологические показатели мышей линии Af после хронического γ-облучения
|
Группы животных (число животных) |
Масса животных, г |
Индексы органов |
||
|
селезенка |
печень |
семенники |
||
|
Облучение 10 сГр (15) |
31,1±1,9 |
5,1±0,4 |
44,5±1,8 |
2,9±0,2 |
|
Контроль к 10 сГр (15) |
27,7±1,2 |
5,9±0,5 |
49,4±1,6 |
3,4±0,1 |
|
Облучение 20 сГр (15) |
27,3±0,6 |
5,3±0,5 |
46,5±2,3 |
3,2±0,1 |
|
Контроль к 20 сГр (15) |
24,4±0,7 |
7,3±1,5 |
49,9±3,1 |
3,3±0,1 |
|
Облучение 30 сГр (29) |
27,6±1,0 |
6,4±0,8 |
44,9±0,9 |
3,4±0,1 |
|
Контроль к 30 сГр (26) |
27,3±1,8 |
6,4±0,8 |
48,2±2,1 |
3,2±0,1 |
Таблица 2
Показатели размножения самок (в течение трех месяцев) и частота АГС у самцов
мышей линии Af после хронического γ-облучения
|
Показатель |
Вариант эксперимента (поглощенные дозы) |
|||
|
Контроль |
10 сГр |
20 сГр |
30 сГр |
|
|
Число пометов на самку |
1,1±0,2 |
1,4±0,3 |
1,1±0,2 |
1,1±0,1 |
|
Число детенышей в помете |
4,1±0,3 |
4,7±0,3 |
6,1±0,8* |
6,0±0,4** |
|
Число детенышей на самку |
4,3±0,5 |
6,5±0,9* |
6,9±0,4*** |
6,5±0,6** |
|
Доля самок, участвовавших в размножении (%) |
76,2±9,3 |
87,5±11,6 |
87,5±11,7 |
78,3±8,6 |
|
Частота АГС (%) |
2,6±0,2 |
3,3±0,4 |
2,6±0,3 |
2,2±0,2 |
Различия с контролем статистически значимы при *р≤0,05; **р≤0,01 и ***р≤0,001.
Анализ радиационно-индуцированных цитогенетических эффектов проведен на клетках костного мозга и щитовидной железы. Костный мозг относится к наиболее радиочувствительным органам с быстрым темпом пролиферации, что позволяет даже при сравнительно небольшом облучении организма обнаруживать генетические нарушения в его клетках. Щитовидная железа представлена радиочувствительными медленно обновляющимися клеточными популяциями, поэтому изучение состояния клеток этой ткани с помощью молекулярных и цитогенетических методов приобретает особую значимость при проведении исследований в хроническом режиме воздействия факторов.
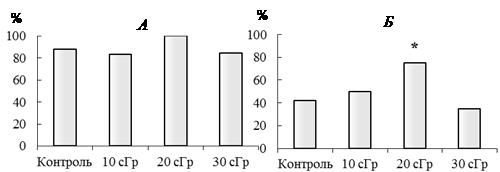
Число облученных самцов (А) и самок (Б) в возрасте 10 месяцев (доживших до окончания эксперимента). Различия с контролем статистически значимы при *р≤0,05
Полученные результаты показали, что через четыре месяца после хронического γ-облучения мышей в диапазоне доз 10-30 сГр частота клеток с МЯ в анализируемых органах была в пределах значений, характерных для контрольных животных (табл. 3). В ответ на действие ИИ в костном мозге было обнаружено статистически значимое понижение относительно нормы элиминации клеток по пути апоптоза (во всех опытных группах) и уровня МИ (после доз 10 и 20 сГр). Замедление клеточного цикла, о котором косвенно свидетельствует снижение МИ, возможно, обусловлено его остановкой в точках контроля целостности ДНК, необходимой для увеличения продолжительности и эффективности репарации генетических повреждений [2]. Кроме того, с помощью метода «ДНК-комет» в обоих органах после радиационного воздействия обнаружено изменение степени фрагментации ДНК (табл. 4). В костном мозге животных, подвергнутых радиационному воздействию в дозе 30 сГр, выявлено статистически значимое понижение, по сравнению с контролем, среднего значения %ТDNA (ДР ДНК). Это произошло вследствие увеличения более чем в два раза числа неповрежденных клеток (0-10%TDNA; р≤0,01), что может свидетельствовать об активации систем репарации ДНК в ответ на действие ИИ в этой дозе. Средние значения %ТDNA в костном мозге мышей, облученных в дозах 10 и 20 сГр, были в пределах нормы, однако ранжирование клеток по классам в зависимости от содержания ДНК в «хвосте кометы» позволило выявить статистически значимые различия с контролем (р≤0,001) и в этих опытных группах; после облучения животных в дозе 10 сГр в костном мозге было снижено в 1,7 раза количество клеток с неповрежденной ДНК (0-10%TDNA), а после дозы 20 сГр уменьшалась в 1,8 раза частота встречаемости клеток с высоко фрагментированной ДНК (41-100%TDNA). В клетках фолликулярного эпителия щитовидной железы также обнаружены радиационно-индуцированные генетические изменения, которые проявлялись в статистически значимом снижении относительно нормы частоты встречаемости клеток с высоко фрагментированной ДНК у животных, облученных в дозах 20 и 30 сГр, что повлияло на средние значения содержания %ДНК в «хвосте кометы» (%TDNA при 20 сГр; р≤0,05). Число клеток, в которых ДНК находилась вблизи «головы кометы» (0-10%TDNA), не выходило за пределы контроля во всех опытных группах.
Таблица 3
Цитогенетические показатели клеток костного мозга и щитовидной железы мышей линии Af после хронического γ-облучения и дополнительного введения уретана (‰)
|
Группы животных |
Щитовидная железа |
Костный мозг |
||
|
МЯ |
МЯ |
МИ |
Апоптоз |
|
|
Контроль |
8,0±1,5 |
22,7±1,2 |
6,9±0,6 |
8,1±0,6 |
|
10 сГр |
4,5±1,2 |
21,8±2,1 |
4,2±0,6* |
1,6±0,5*** |
|
20 сГр |
6,8±1,2 |
21,9±1,7 |
4,1±0,7* |
2,7±0,6*** |
|
30 сГр |
9,0±1,0 |
21,4±0,5 |
7,3±0,3 |
6,2±0,2* |
|
Уретан |
7,8±1,3 |
21,8±0,5 |
3,9±1,2* |
11,0±1,5* |
|
30 сГр+Уретан |
7,3±1,4 |
24,0±1,2ν |
9,4±0,7ν |
4,6±0,2ν |
Здесь и в табл. 4. статистически значимы отличия между опытными и контрольной группами при *р≤0,05; **р≤0,01 и ***р≤0,001; между группами «30 сГр+Уретан» и «30 сГр» при νp≤0,05.
Таблица 4
Результаты метода «ДНК-комет», проведенного на соматических клетках мышей линии Af после хронического γ-облучения и дополнительного введения уретана
|
Группы животных
|
Щитовидная железа |
Костный мозг |
||||
|
%TDNA |
0-10% TDNA |
41-100% TDNA |
%TDNA |
0-10% TDNA |
41-100% TDNA |
|
|
Контроль |
31,7±1,0 |
18,6±1,1 |
33,3±1,3 |
23,3±0,3 |
13,1±0,8 |
5,7±0,6 |
|
10 сГр |
31,9±1,0 |
19,3±1,9 |
34,7±2,3 |
24,6±0,4 |
7,6±1,1*** |
4,0±0,8 |
|
20 сГр |
27,7±0,8* |
19,7±1,8 |
17,4±1,7*** |
23,2±0,4 |
13,7±1,4 |
3,1±0,7** |
|
30 сГр |
30,4±1,0 |
16,8±1,8 |
21,3±2,2*** |
19,6±0,5* |
27,9±1,8*** |
6,3±1,0 |
|
Уретан |
30,6±0,9 |
14,1±1,6* |
27,1±2,0* |
17,8±0,7 |
39,4±1,8*** |
8,4±0,6* |
|
30 сГр+Уретан |
31,9±1,0 |
11,6±1,8ν |
28,7±2,5ν |
29,7±0,8ν |
17,7±0,8ν |
28,5±0,6ν |
% TDNA – ДР ДНК по средним значениям процента ДНК в «хвосте кометы»;
TDNA –0-10%TDNA – доля клеток с неповрежденной и/или низко фрагментированной ДНК; 41-100%TDNA – доля клеток с высоко фрагментированной ДНК.
Изучение спонтанного и радиационно-индуцированного уровней повреждений генома клеток костного мозга и щитовидной железы животных позволило дать оценку последствий с учетом не только радиационного фактора (30 сГр), но и реакции соматических клеток на дополнительное действие химического фактора – уретана (1 мг/г массы тела животного). Тест с химической нагрузкой показал различия в ответной реакции клеток анализируемых органов между контрольными и облученными животными (табл. 3 и 4). В костном мозге мышей контрольной группы через двое суток после воздействия уретана статистически значимо снижался МИ, возрастали доля апоптозных клеток и значения низко и высоко фрагментированной ДНК. Это свидетельствует в пользу того, что в ответ на действие канцерогена в клетках костного мозга контрольных животных в целях защиты целостности генома происходит усиление таких процессов, как репарация ДНК и элиминация клеток с нерепарируемыми повреждениями ДНК. В итоге средний уровень ДР ДНК (%TDNA) и частота встречаемости клеток с МЯ в костном мозге сохранялись в пределах спонтанного уровня. У облученных животных после воздействия уретана изменения митотической активности и апоптоза происходили в противоположных направлениях по сравнению с контрольными значениями – МИ возрастал, число апоптозных клеток снижалось. Также у этих животных в костном мозге отмечено увеличение (p≤0,05) доли клеток с МЯ и с ДР ДНК, что указывает на проявление нестабильности генома.
В щитовидной железе как у облученных, так и у контрольных групп животных уретановая интоксикация по истечении двух суток не повлияла на частоту встречаемости клеток с МЯ и средний уровень содержания ДНК в хвосте «кометы» (%TDNA). Различие между этими группами проявлялось в доле клеток с высоко фрагментированной ДНК (41-100%TDNA); у контрольных мышей после воздействия уретана отмечали снижение значения этого показателя, тогда как у предварительно облученных особей, наоборот, повышение, что свидетельствует об изменении ответной реакции клеток щитовидной железы у облученных животных. Следует отметить, что доля клеток с неповрежденной ДНК (0-10%TDNA) в обеих сравниваемых группах была статистически значимо ниже, чем до химического воздействия.
Заключение. Обнаружено, что эффективность хронического воздействия ИИ в малых дозах (10, 20 и 30 сГр) при внешнем физиологическом благополучии мышей проявлялась в повышении показателей плодовитости у самок и в изменении стабильности генома соматических клеток. Результаты цитогенетического анализа позволили выявить более выраженные радиационно-индуцированные изменения в клетках костного мозга, обладающего высокой пролиферативной активностью, по сравнению со щитовидной железой. Хроническое облучение способствовало изменению чувствительности клеток животных к действию дополнительного химического фактора – уретана. При выявлении биологических эффектов в области малых доз ИИ оптимальным является применение методов исследования на разных уровнях структурной организации, в том числе с учетом пролиферативной активности органов.
Работа выполнена при частичной финансовой поддержке Комплексной программы Президиума УрО РАН (грант № 15-4-4-20) и в рамках государственного задания (№ 115012860038).
Библиографическая ссылка
Раскоша О.В., Башлыкова Л.А. ЦИТОГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ ХРОНИЧЕСКОГО ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ В МАЛЫХ ДОЗАХ // Современные проблемы науки и образования. 2017. № 4. ;URL: https://science-education.ru/ru/article/view?id=26580 (дата обращения: 06.03.2026).



