Термин «гастроинтестинальная стромальная опухоль» (gastrointestinal stromal tumor, ГИСТО, GIST) был предложен американскими морфологами M.T. Mazur и H.B. Clark в 1983 году для обозначения особого вида злокачественных опухолей, которые до этого расценивались как лейомиомы, лейомиосаркомы или шванномы. После внедрения в клиническую практику иммуногистохимического исследования и электронной микроскопии, появилась возможность выделить ГИСТО в отдельную нозологическую форму [1, 5].
Считается, что данный вид опухоли возникает из интерстициальных клеток Кахаля, являщихся пейсмекерами желудочно-кишечного тракта, но факты выявления в неорганных ГИСТО вызывают противоречие с вышеназванной гипотезой. Основным предиктором, позволяющим выделить ГИСТО в отдельную нозологическую группу, в настоящее время является определение мутации в гене c-kit, экспрессирующий маркер CD117 в мезенхимальных и нейрогенных опухолях [1, 2, 6].
ГИСТО является относительно редкой опухолью и составляя от 1 до 3 % от общего числа злокачественных опухолей. Ежегодно в мире выявляется от 10 до 40 новых случаев той опухоли на 1 миллион населения. Самая высокая заболеваемость регистрируется в возрасте 50–60 лет – более 75 %, чаще у мужчин. По данным американских авторов, в США ежегодно регистрируется около 5000 новых случаев этого заболевания. По России точные данные в настоящее время отсутствуют, экспертная частота возникновения составляет 2000–2500 случаев в год [2, 4, 6].
Чаще всего ГИСТО выявляются в желудке (до 70 %) и тонкой кишке (от 25 % до 35 %), и данная локализация характеризуется более неблагоприятным, по сравнению с другими, прогнозом. Значительно реже – менее 5 % – данный тип опухоли обнаруживают в толстой кишке и аппендиксе. Описаны также поражения поджелудочной железы, предстательной железы, матки и экстраорганные ГИСТО, с локализацией в сальнике, забрюшинном пространстве, брыжейках толстой и тонкой кишки [1, 6].
Для ГИСТО характерно весьма редкое метастазирование в лимфатические узлы, что накладывает определенные особенности на хирургическую технику: нецелесообразность выполнения лимфодиссекции при данной нозологии.
ГИСТО по своей гистологической структуре делятся на веретеноклеточные, эпителиоидные и смешанные. Веретеноклеточный тип опухоли представлен полисадообразными структурами с мономорфными ядрами округлой или вытянутой формы. Эпителиоидный тип характеризуется наличием полигональных или округлых форм со светлой цитоплазмой, которые формируют солидные, солидно-альвеолярные и клеточные гнезда. Изредка встречаются плеоморфный, перстневидно-клеточный, мезотелиомоподобный и онкоцитарный тип опухоли. Клеточный полиморфизм максимально выражен при эпителиоидном типе опухоли, что сопряжено с более агрессивным течением заболевания [1, 5].
Клинические проявления, макроскопические и гистологические характеристики опухолей неспецифичны. Лабораторная диагностика этих образований основывается на определении экспрессии мембранных белков CD117 и, в меньшей степени, CD34. Главный механизм неопластической трансформации и возникновения данного типа опухолей обусловлен гиперэкспрессией клетками тиразинкиназного рецептора KIT (CD117) и его безлигантной активацией. Кодируемый геном белок выступает в качестве трансмембранного рецептора фактора роста стволовых клеток. Мутации гена могут наблюдаться в 9, 11, 13 или 17 экзоне, кодирующих внутриклеточные и внеклеточные домены данного рецептора. Аналогичные, но взаимоисключающие мутации, хотя и редко, могут происходить со стороны гена, кодирующего рецептор тромбоцитарного фактора роста альфа (PDGFRA). Примерно в 10–15 % ГИСТО мутации генов с-KIT и PDGFRA могут отсутствовать, что говорит о диком типе данной опухоли.
Основным методом лечения местных и местнораспространенных форм ГИСТО является хирургическое лечение. В случае рецидива или обнаружения метастазов – показана таргетная терапия иматинибом. При этом опухоли размером менее 2 см возможно динамическое наблюдение с использованием методов КТ и МРТ визуализации [3].
Опухоли больших размеров подлежат безусловной резекции с отступлением от краев опухоли 1–2 см. Лимфодиссекция при неизмененных лимфатических узлах нецелесообразна. Возможно выполнение профилактической оментэктомии, но рандомизированных данных о ее целесообразности в настоящее время нет.
При локализации опухоли в пищеводе, кардиальном отделе желудка, двенадцатиперстной и прямой кишке, а также при сомнительной резектабельности рекомендуется предоперационное лечение иматинибом в течение 6–12 месяцев [1, 3].
За период с 2012 по 2016 г. в Волгоградском областном клиническом онкологическом диспансере по поводу ГИСТО проходили лечение 38 человек в возрасте от 24 до 79 лет. Медиана возраста составила 61 год. Женщин было 15, мужчин – 23.
В подавляющем числе случаев опухоль локализовалась в желудке – 20 наблюдений. Среди других локализаций нами были отмечены: тонкая кишка – 6, ободочная кишка – 6, прямая кишка – 3, поджелудочная железа и забрюшинное пространство –3.
Пациенты были госпитализированы в стационар в плановом порядке, после углубленного исследования органов желудочно-кишечного тракта, включающего УЗИ и КТ органов брюшной полости и забрюшинного пространства, ФГДС, рентгенографию желудка и двенадцатиперстной кишки, рентгенографию по пассажу, ФКС и ирригографию. Необходимо признать, что дооперационная диагностика неэпителиальных опухолей желудочно-кишечного тракта представляет весьма трудную задачу из-за редкости этой патологии и отсутствия сколь-нибудь характерной клинической картины. Таким образом, наиболее частым дооперационным клиническим диагнозом являлись «подслизистая опухоль желудка или кишки» и «внеорганая опухоль брюшной полости».
Клинические проявления ГИСТО были разнообразны и неспецифичны и сводились в основном к болям неопределенного характера, дискомфорту в брюшной полости, ухудшению общего самочувствия, диспепсии. Так болевой синдром у наших больных был отмечен в 26 (68, 4 %) наблюдениях. У 8 (21,1 %) пациентов опухоль определялась пальпаторно: в 5 случаях при локализации в желудке и забрюшинном пространстве и в 3 наблюдениях – при пальцевом исследовании прямой кишки. Анемия различной степени тяжести отмечалась при поступлении пациентов в 12 (31,6 %) случаях, а указания на состоявшееся кровотечение было у 5 (13,2 %) пациентов. В 3 (7,9 %) кровотечение возникло в период пребывания больных в нашем стационаре, что явилось показанием к экстренной операции, как мы показываем в следующем клиническом наблюдении.
Пациент С., 64 лет, и.б. №112628, поступил в хирургическое отделение №5 Волгоградского областного клинического онкологического диспансера 27.10.2016 г. При поступлении предъявлял жалобы на общую слабость, боли в эпигастральной области и левом подреберье, наличие в анамнезе черного стула. При поступлении состояние расценено как относительно удовлетворительное. Нормостеничного сложения. Кожные покровы обычной окраски. В общем анализе крови отмечается умеренная анемия со снижение Hb до 103г/л, эритроцитов 3,8х1012, лейкоцитов 6,3х109, лейкоцитарная формула в пределах физиологической нормы, СОЭ 45 мм/ч. Креатинин 87,9 мкмоль/л, билирубин 6,3 мкмоль/л, глюкоза крови 4,7 ммоль/л.
20.10.2017. Фиброгастродуоденоскопия: Слизистая оболочка пищевода и кардии гиперемирована. Желудок деформирован по задней поверхности и большой кривизне в результате оттеснения извне объемным процессом от субкардиального кардиального отдела до нижней трети тела желудка. Слизистая оболочка в этой зоне инфильтрирована, складки разглажены. Отмечаются множественные эрозии различной величины. Признаков кровотечения не обнаружено. Привратник проходим. В двенадцатиперстной кишке явления фолликулярного бульбита.
26.10.2017. Рентгеноскопия пищевода, желудка и двенадцатиперстной кишки: опухоль желудка, субтотальное поражение и распространением на кардиальный жом. Вероятно ГИСТО, менее вероятно лимфома. Эвакуация из желудка не нарушена.
31.10.2017. Компьютерная томография с контрастным усиление «Ultravist»: опухоль верхнего этажа брюшной полости 8,3х10,7х13,7 см, исходящая из стенки желудка – ГИСТО (Рис. 1).
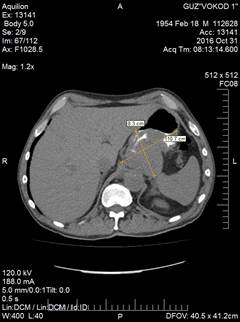
Рис. 1. Компьютерная томограмма пациента С
Гистологическое исследование (двукратное): лимфоидная инфильтрация слизистой оболочки, фиброзная ткань.
В соответствии с установленным диагнозом «Гастро-интестинальная стромальная опухоль желудка» была начата предоперационная подготовка.
01.11.2017. Отмечено ухудшение состояния пациента. Жалобы на слабость, головокружение, черный неоформленный кал. Объективно: состояние средней тяжести, кожные покровы бледные, влажные. АД 110/65 мм рт. ст., пульс 96 уд. в мин., ЧДД 18 в 1 мин. Гемоглобин 82 г/л, Гематокрит 27 %.
Установлен назо-гастральный зонд. По зонду отделяемое типа «кофейной гущи». Желудок по зонду отмыт до чистых вод, через зонд с целью гемостаза введено 100 мл 5 % раствора аминокапроновой кислоты. Начата гемостатическая терапия.
Фиброгастродуоденография: в полости желудка свежая кровь и сгустки. В теле желудка в области опухоли два язвенных дефекта размером 1,8х1,5 см и 1,5х1,5 см прикрытые фиксированными сгустками крови из под которых сохраняется кровотечение.
В срочном порядке пациенту выполнена лапаротомия, чрезбрюшная гастроспленэктомия (Рис. 2).
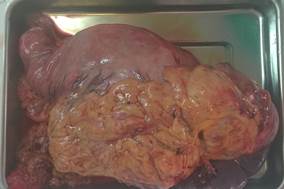
Рис. 2. Пациент С. Удаленный препарат
Послеоперационный период протекал без осложнений.
Гистологическое исследование удаленного препарата: гастро-интестинальная стромальная опухоль смешанного строения. При иммуногистохимическом исследовании: гиперэкспрессия в большинстве клеток CD117, гнездная гиперэкспрессия CD34, виментина. Митотический индекс в 50 полях – 8/50.
В послеоперационном периоде, с учетом высокого риска прогрессирования: размеры опухоли и митотический индекс – в адъювантном режиме назначена терапия Иматинибом в дозе 400 мг/сутки.
Осмотрен в феврале 2017 г. Признаков прогрессирования опухоли не обнаружено. Рекомендовано продолжение таргетной терапии до 3 лет.
Перечень выполненных нами хирургических вмешательств при ГИСТО представлен нами в ниже приведенной табл. 1.
Таблица 1
Виды выполненных операций в зависимости от локализации ГИСТО
|
Локализация опухоли |
Общее число операций |
Виды операций |
Число операций |
|
Желудок |
20 |
Гастротомия, удаление опухоли |
2 |
|
Сегментарная резекция |
8 |
||
|
СДРЖ |
6 |
||
|
Гастрэктомия |
4 |
||
|
Тонкая кишка |
6 |
Резекция кишки |
6 |
|
Ободочная кишка |
6 |
Гемиколэктомия |
2 |
|
Гемиколэктомия с атипичной резекцией двенадцатиперстной кишки |
1 |
||
|
Резекция сигмовидной кишки |
2 |
||
|
Передняя резекция прямой кишки |
1 |
||
|
Резекция илео-цекального угла |
1 |
||
|
Резекция селезеночного изгиба |
1 |
||
|
Прямая кишка |
3 |
Передняя резекция прямой кишки |
3 |
|
Поджелудочная железа, забрюшинное пространство |
3 |
Резекция тела поджелудочной железы |
2 |
|
Иссечение опухоли |
1 |
В послеоперационном периоде нами не было отмечено осложнений, требующих повторного оперативного вмешательства и дополнительных осложнений. Послеоперационной летальности не было.
Для дифференциальной диагностики ГИСТО и других видов мезенхимальных опухолей во всех случаях выполнялось иммуногистохимическое исследование с использованием маркеров CD-117 и CD-34. В качестве дополнительных маркеров ставилась реакция на виментин, S-100, десмин, NSE. Специфичность маркера CD-117 оказалась равной в нашей группе 100 %, CD-34 – 76,9 % (30 из 38 наблюдений). Достаточно часто – у 24 (64,2 %) из 38 случаев – была положительной реакция на виментин, столько же на NSE. Реакция на остальные маркеры носила спорадический характер.
Важным прогностическим параметром ГИСТО является оценка количества митозов на 50 полей зрения. В нашей группе разброс показателей составил от 1/50 до 40/50. Данный критерий был использован нами для оценки опухолевой прогрессии ГИСТО и риска прогрессирования по Miettinen с соавт. (табл. 2).
Таблица 2
Оценка риска прогрессирования ГИСТО
|
Риск прогрессирования |
Размер опухоли |
Митотический индекс (к-во митозов на 50 п/зрения) |
|
Очень низкий |
< 2 см |
< 5/50 |
|
Низкий |
2-5 см |
< 5/50 |
|
Промежуточный |
< 5 см |
6-10/50 |
|
5-10 см |
< 5/50 |
|
|
Высокий |
> 10см |
Любое количество митозов |
|
Любой размер |
>10/50 |
|
|
> 5 |
> 5/50 |
В соответствии с вышеописанными критериями, адъювантной терапии подлежало 20 (52,6 %) из 38 наших пациентов: в 14 наблюдениях причиной назначения терапии являлись биологические свойства опухоли, у 6 больных – прогрессирование заболевания. Терапия включала назначение Иматиниба в дозе 400 мг в сутки ежедневно в два приема в адъювантном режиме и от 600 до 800 мг в сутки – при самостоятельном лечебном режиме. Продолжительность лечения составляла от 1 до 3 лет.
За время наблюдения умерли 4 пациентов в сроки: до 12 месяцев – 2 больных, 18 месяцев – в 1 случае, и в одном наблюдении через 22 месяца с момента взятия под наблюдение. При этом у обоих пациентов, не доживших до года после операции, прогрессирование наступило на фоне лечения. Небольшое количество наблюдений и короткий временной промежуток наблюдения за больными не позволили нам выстроить кривую дожития при ГИСТО, но летальность 10,5 % мы расцениваем как неплохой результат лечения такой неоднозначной в прогностическом плане опухолевой патологии. Необходимо также указать, что критическими для больных ГИСТО пациентов являются первые два года жизни.
Заключение. Таким образом, ГИСТО является самой часто встречающейся стромальной опухолью желудочно-кишечного тракта. Диагностика этого типа опухолей не может основываться только на «очевидности» гистологической картины, но требует выполнения иммуногистохимического исследования с оценкой экспрессии CD117, CD34 и других маркеров мезенхимальных новообразований. Помимо хирургического компонента, в лечении ГИСТО ведущее значение имеет определение биологического потенциала, основанного на комплексе гистологических критериев, особенностях клиники и факторов прогноза. Прогноз заболевания может быть улучшен назначением таргетного препарата «Иматиниб».
Библиографическая ссылка
Ненарокомов А.Ю., Хвастунов Р.А. КЛИНИЧЕСКИЕ И ПАТОМОРФОЛОГИЧЕСКИЕ АСПЕКТЫ ГАСТРОИНТЕСТИНАЛЬНЫХ СТРОМАЛЬНЫХ ОПУХОЛЕЙ // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26538 (дата обращения: 02.01.2026).



