Хирургия мягких тканей, подвергнувшихся высокотемпературному термическому поражению, имеет свою специфику, а восстановление кожных покровов и последующая реабилитация этой категории пациентов является сложной задачей. Пластическое закрытие обширной гранулирующей раны является серьезной проблемой комбустиологии. Частота деградации аутодерматрансплантатов, а также инфекционных осложнений области донорского забора у больных с сопутствующей сосудистой патологией после свободной аутодермапластики, достаточно велика. Необходимым условием успешного приживления аутодерматрансплантатов является своевременность и качество подготовки раневого ложа, техника взятия трансплантата, адекватность общего и местного лечения в послеоперационном периоде, возраст и общее состояние пациента до и на фоне получения травмы, сопутствующих заболеваний. Весьма важным фактором планирования оперативного вмешательства является состояние микроциркуляторного русла. Если проблема пластического закрытия ожоговых ран в определенной степени решена, то поиск новых методов подготовки ожоговой поверхности к кожной пластике важнейшая задача комбустиологии. Фундаментальные исследования патогенетических процессов ожоговой раны, появление новых лекарственных препаратов, раневых повязок и аппаратуры позволяют разрабатывать современные технологии местного лечения обожженных [1-5]. На наш взгляд, полезным оказалось бы сочетанное применение специальных методов коррекции (низкочастотный ультразвук и раствор лавасептера 0,02%).
Цель исследования: оценка эффективности применения низкочастотной ультразвуковой кавитации при подготовке ожоговых ран к аутодермапластике.
Материалы и методы
В период с 2012 по 2016 год в ожоговом центре КГБУЗ «ККБ» были проведены клинические наблюдения у 25 пациентов. Контрольную группу составили 12 ожоговых больных, которым применяли общепринятую терапию, включающую этапные тангенциальные некрэктомии и аутодермапластики.
Исследуемую группу составили 13 обожженных, которым в комплексное лечение дополнительно были включены метод ультразвуковой кавитации с использованием аппарата Sonoca 300 и Sonoca 180, для предтрансплантационного дебридмента ожоговой поверхности был использован 0,02% р-р лавасепта.
Среди обожженных преобладали мужчины - 15. В контрольной группе было 5 женщин и 7 мужчин, в исследуемой группе - 5 и 8, соответственно.
Исследования проведены у обожженных в возрасте от 18 до 82 лет. Средний возраст больных контрольной группы составил 43,4 + 2,34 года, в исследуемой группе - 43,3 + 2,38 года. Люди пожилого и старческого возраста составили 2 пациента в контрольной группе и 3 в исследуемой группе.
Степень тяжести оценивали с помощью индекса Франка (ИФ) с учетом площади и глубины поражения и наличия ингаляционной травмы. Все обожженные в контрольной и исследуемой группах со средней степенью тяжести (площадь ожогов до 20%, ИФ до 70). Таким образом, по полу, возрасту и тяжести повреждения группы больных сопоставимы. Все полученные данные обрабатывали с использованием статистических методов. Определяли количественный признак - критерий Стьюдента.
Обработку ран проводили с помощью ультразвуковой кавитации от 20 до 100% мощности с различной интенсивностью подачи раствора, с частотой воздействия 25 кГц. В качестве акустической среды для проведения этапного, а также предтрансплантационного дебридмента ожоговой поверхности был использован 0,02% р-р лавасепта. Эффективность воздействия оценивалась по увеличению коэффициента приживления трансплантатов. Лечение начинали на 10-е сутки после травмы. Эти сроки определялись, прежде всего, выраженностью явлений воспаления в ране, которые определялись чаще всего визуально либо используя систему графической оценки состояния раны компании Lohman & Rausher, «Wound analyzer». Работа программы выполняется на удаленном сервере и заключается в точном подсчете площади раневой поверхности по заданным ориентирам (необходимо наличие калибровочной, стандартизированной линейки при выполнении фотографии), а также дифференциации раны на ткани струпную, гранулирующую, эпителизирующую. Ультразвуковая обработка гранулирующих ран применялась одномоментно на площади от 2 до 10% поверхности тела. Время воздействия на 100 см2 раневой поверхности составляло 60-600 секунд. Всем пациентам проводилась свободная пересадка расщепленных 0.3-0.4 мм аутодерматрансплантатов как перфорированных, так и не перфорированных. Одиннадцати пациентам проводился предтрансплантационный дебридмент раневой поверхности аппаратом «Сонока 300» или «Сонока 180», компании Soring, в качестве акустической среды использовался раствор лавасепта 0.02%. Аутодермапластика проводилась на 9-14-е сутки после травмы. Сроки аутодермапластики зависели от очищения раневой поверхности от струпной ткани и формирования грануляций. Первая перевязка п/о проводилась на 5-7-е сутки. Оценка уровня тканевого кровотока здоровой кожи проводилась в области предплечья, предполагаемой области донорского забора аутодерматрансплантата, а также края, периметра и центра раны перед свободной кожной пластикой, а также в послеоперационный период на 5-10-е сутки. Для оценки микроциркуляции использовался лазерный доплеровский флоуметр BLF21, Transonic Sistems Inc., США, с датчиком типа R, крепившимся к коже при помощи лейкопластыря. На флоуметре устанавливали постоянную времени 0,1 сек. На каждом уровне производилось 3-кратное измерение кровотока с последующим усреднением данных. После сеанса ультразвуковой кавитации выполнялась аутодермапластика, при дефиците донорских ресурсов кожи применялись биодеградируемые раневые покрытия типа «ксенодерм», «суспурдерм», «хитопран».
Аутодермапластика осуществлялась расщепленным 0,2-0,4 мм, перфорированным 1 к 4 аутодерматрансплантатом, трансплантаты фиксировались металлическими скобами, накладывались атравматичные сетчатые раневые покрытия, влажно высыхающие повязки с р-ром 0.02% лавасепта и ватно-марлевые повязки, первая перевязка после пересадки кожи выполнялась на 6-е сутки после операции.
Результаты исследования
У ожоговых больных (табл.) термическая травма привела к увеличению концентрации лактата в капиллярной крови в 2 раза по сравнению с нормой, что свидетельствовало о выраженности воспалительного процесса и могло привести к ишемии тканей. Проводимое лечение не смогло стабилизировать метаболический ацидоз к 10-м суткам, что создавало не благоприятные условия для приживления трансплантата.
Наши исследования показали, что ожоговая травма приводила к значительному увеличению ЦИК. На 10-е сутки рассматриваемый показатель превышал норму в 2,5-3 раза, что могло свидетельствовать о наличии выраженной аутоиммунной реакции.
Анализ концентрации лактата крови и клеточной реакции в ране у ожоговых больных (M + m, p)
|
Показатель |
Норма |
Контрольная группа |
Исследуемая группа |
||
|
10-е сутки |
16-е сутки |
10-е сутки |
16-е сутки |
||
|
Лактат мл/мин p p1 |
1,35 +0,06 |
2,70 +0,31 <0,001 |
2,91 +0,26 <0,001 |
2,77 +0,24 <0,001 >0,5 |
1,98 +0,28 <0,001 <0,001 |
|
Ц И К усл. ед. p p1 |
50,0 +3,63 |
149,4 +29,9 <0,001 |
108,5 +13,7 <0,01 |
138,6 +31,2 <0,001 >0,5 |
77,9 +20,7 >0,1 >0,1 |
|
Нейтрофилы кл х 109/л p2 |
12,6 +1,01 |
0 |
14,1 +1,23 |
- |
|
|
Фибробласты кл х 109/л p1 p2 |
16,1 +2,96 |
25,8 +2,37 <0,01 |
14,7 +1,29 >0,5 |
- |
|
|
Макрофаги кл х 109/л p1 p2 |
12,7 +1,01 |
12,8 +1,16 >0,5 |
14,2 +1,31 >0,5 |
- |
|
|
Коллаген кл х 109/л p1 p2 |
12,9 +1,01 |
20,6 +2,37 <0,001 |
11,4 +1,01 >0,1 |
- |
|
Примечание: p - достоверность по сравнению с нормой,
p1 - с контрольной группой,
P2 - с 10 сутками
Количественное определение ЦИК проводили в иммунологической лаборатории ККБ №1. За норму были приняты показатели здоровых людей, определенные в лаборатории Центр-СПИД г. Красноярска. Исследование лактата крови производили на аппарате AVI, страна производства - Дания, в клинической лаборатории ККБ №1.
Анализ раневого процесса на фоне термического поражения показал, что несмотря на наличие к 10-м суткам у ожоговых больных в ране фибробластов и коллагена, наличие значительного процента макрофагов и нейтрофилов свидетельствует о наличии воспаления, в то же время на фоне ацидоза вследствие нарушения энергетических процессов снижалась способность макрофагов к поглощению и перевариванию фагоцитируемого материала, а аутоиммунные процессы сохраняли риск отторжения трансплантата.
Капиллярный кровоток здоровой кожи на уровне внутренней поверхности предплечий составлял 3.1-5.4 мл/мин/100г, показатели раневого кровотока вокруг раны составляли 6.1 -7.4 мл/мин/100г, края раны 8.2-11.0 мл/мин/100г, центра раны 2.9-3.7 мл/мин/100г. Показатели кровотока, вопреки нашим ожиданиям, у пациентов с сахарным диабетом практически не отличались от показателей кровотока во всей исследуемой группе за исключением пациентов с нижней параплегией после спинальной травмы: показатели раневого кровотока центра и краев раны у данных пациентов составляли 1.1-2.1 мл/мин/100г. У данных пациентов предпринимались попытки местной пластики мягких тканей, без положительного результата, свободная пересадка кожи без проведения предтрансплантационного дебридмента закончилась регрессом 2/3 трансплантатов на 5-е сутки п/о. Отмечено значительное увеличение раневого кровотока у всех пациентов после предтрансплантационного дебридмента раневой поверхности, в среднем на 40% от исходного, а также более высокий коэффициент приживления трансплантатов: 0.95 против 0.6. Отмечалась зависимость уровня кровотока от локализации раны, как правило, чем дистальнее находилась рана от сердца, тем меньше были показатели кровотока. В послеоперационном периоде на первой перевязке (5-7-е сутки п/о) величина кровотока пересаженных аутодерматрансплантатов составляла 3.5-12.9 мл/мин/100г, в данном случае макроскопически не возникало признаков регресса трансплантатов. При показателях потока менее 2.1 наблюдался регресс трансплантатов. На 10-е сутки п/о показатели кровотока эпителизирующих ран были значительно выше до операционных в среднем на 130-240%.
Предлагаемая методика позволила у обожженных исследуемой группы к 16-м суткам (очевидно, за счет улучшения кровообращения в ране) снизить концентрацию лактата по сравнению с показателями в контрольной группе на 32%, нормализовать содержание ЦИК.
В первые сутки госпитализации рост микроорганизмов в биоптате, раневом отделяемом ожоговых больных был выявлен в 25,5% случаев, доминировали грамположительные микроорганизмы, доля MSSA (37,8%). На 10-50-е сутки госпитализации (рост получен в 93,2% случаев) доминирует грамотрицательная микрофлора (53,4%), при этом значительную роль играют Pseudomonas spp. и Acinetobacter spp. (38,0%), характеризующиеся высокой степенью резистентности к антимикробным препаратам. На 10-50-е сутки госпитализации также значительную роль играют стафилококки (38,7%), при этом доля MRSA – 62,2%. Наблюдение за течением раневого процесса в исследуемой группе показало значимое уменьшение бактериальной обсемененности, снижение числа микроорганизмов на 1 см2 раневой поверхности в среднем с 107 до 103, появление регенеративного типа цитограмм, более раннюю активизацию краевой эпителизации, практически полное отсутствие краевого лизиса аутодерматрансплантатов (рис. 1-2) по сравнению с контрольной группой больных, лечение которых проводилось традиционными методами.
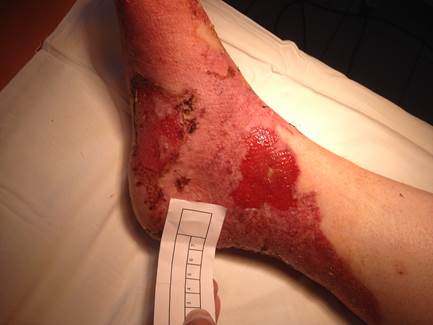
Рис. 1. Пациент Ч. Гранулирующая рана правой голени, стопы
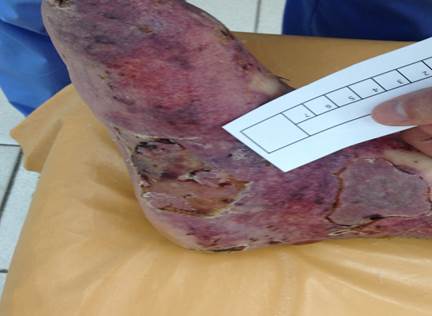
Рис. 2. Пациент Ч. Состояние после аутодермапластики, 6-е сутки после операции
Коэффициент приживления трансплантатов составил 0,95.
Выводы
Ожоговая травма вызывает развитие нарушения кислотно-основного равновесия в организме в сторону ацидоза, что на фоне аутоиммунной реакции в значительной степени повышает риск отторжения трансплантатов с развитием инфекционных осложнений со стороны раны.
Исходя из вышесказанного, необходимо усиливать местное лечение раневого процесса методиками, улучшающими локальное кровообращение и обладающими воздействием на раневую флору.
Применение ультразвуковой кавитации, современных раневых покрытий активной хирургической тактики позволяет повысить коэффициент приживления аутодерматрансплантатов ожоговых ран в среднем до 0,95.
Библиографическая ссылка
Владимиров И.В. ВОЗМОЖНОСТИ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ДЕБРИДМЕНТА ОЖОГОВЫХ РАН // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26504 (дата обращения: 02.01.2026).



