В мире ежегодно регистрируют до 1 млн новых случаев заболевания раком молочной железы (РМЖ) [1]. В Российской Федерации рак молочной железы является самым распространенным злокачественным новообразованием у женщин: в 2013 году было выявлено 57 307 новых случаев заболевания, а число умерших составило более 20 000 пациентов [1].
В настоящее время иммунотерапевтические курсы при РМЖ чаще используются при заболеваниях в продвинутой стадии и в основном направлены на антигены (например MUC1, CEA и др.), экспрессирующиеся с повышенной экспрессией в клетках опухолей [2; 3]. Иммунотерапия РМЖ, направленная на раково-тестикулярные антигены (РТА), может быть более эффективной, чем на вышеперечисленные опухолевые антигены. В норме РТА антигены экспрессируются преимущественно в зародышевых клетках человека и в трофобласте, а аберрантно их экспрессия индуцируется в опухолях [4]. Несмотря на то что некоторые соматические ткани (поджелудочная железа, печень и селезенка) экспрессируют мРНК нескольких РТА, уровни мРНК генов РТА составляют, как правило, менее 1% от их экспрессии в семенниках [5].
В рутинной клинической практике выбор лечебных воздействий основан на стандартных прогностических факторах (возраст, наступление менопаузы, размер опухоли, степень её злокачественности, рецепторный статус стероидных гормонов и HER2/neu). Однако стандартные прогностические факторы не всегда способны эффективно предсказать течение и прогноз развития заболевания. Для некоторых раково-тестикулярных антигенов в результате многочисленных исследований было выявлено их прогностическое значение, которое может быть использовано для уточняющей диагностики РМЖ [6,7,8].
В нескольких исследованиях по РМЖ было доказано, что частота экспрессии РТА выше в низкодифференцированных опухолях [7], а в исследовании Grigoriadis A. et al. [9] было обнаружено, что РТА разных классов (CT-X, non-X) по-разному экспрессируются в разных подтипах опухолей молочной железы. Однако исследования генов РТА в основном ограничены семействами MAGE-A и NY-ESO-1. Следовательно, анализ ассоциации экспрессии других генов РТА при РМЖ с клинико-патологическими характеристиками необходим для идентификации новых, возможно более надежных, молекулярных маркеров и мишеней для иммунотерапии.
Целью нашего исследования стал скрининг РТА, специфичных для опухолевых тканей молочной железы люминальных подтипов А и В на основании анализа транскрипционной активности раково-тестикулярных генов.
Материалы и методы
В исследовании использовали парные операционные биоптаты прилегающих не малигнизированных (норма) и опухолевых тканей молочной железы 25 пациенток (50 образцов) в возрасте 38-85 лет, поступивших на лечение в ФГБУ «РНИОИ» МЗ РФ в 2015–2016 гг. Исследование было одобрено этическим комитетом ФГБУ «РНИОИ»; в каждом конкретном случае было получено информированное согласие больного на включение его в данное исследование. Образцы для транспортировки в лабораторию и хранения мгновенно замораживали в жидком азоте без использования крио-/транспортных РНК-сред. Максимальное время от взятия образца до его заморозки в жидком азоте составляло не более 20 с.
Фрагменты ткани измельчали и растирали в фарфоровых ступках в лизирующем растворе, содержащем 4 М гуанидин тиоцианат, 25 мМ цитрат натрия, 0,5% саркозил и 0,1 М 2-меркаптоэтанол. Дальнейшее выделение РНК из тканей проводили по методу P. Chomczynski и N. Sacchi [10]. Для удаления следов геномной ДНК полученные образцы суммарной РНК обрабатывали препаратами ДНК-азы. Синтез кДНК проводили с использованием коммерческих наборов Reverta-L («Интерлабсервис», Россия). Методом RT-qPCR определяли величины относительной экспрессии 17 генетических локусов: MAGEA1, MAGEA2, MAGEA3, MAGEA4, MAGEB1, MAGEB2, GAGE1, GAGE3, GAGE4, MAGEC1, BAGE, CTAG1B, XAGE3, NY-ESO1, SSX2, SYCP1 и PRAME1. В качестве референсного использовали ген GAPDH. Дизайн специфичных олигонуклеотидных праймеров (таблица) осуществлялся нами с использованием референсных последовательностей NCBI GenBank и программы Primer-BLAST.
Полученную библиотеку кДНК амплифицировали в 25 мкл ПЦР-смеси, содержащей 12 нг кДНК, 0,25 мМ dNTPs, 2,5 мМ MgCl2, 1х-ый ПЦР-буфер и 1 ед. акт. SynTaq ДНК-полимеразы с ингибирующими активность фермента антителами («Синтол», Россия), краситель EVA-Green и по 400 нМ прямого и обратного праймеров для референсного гена (GAPDH) или гена-мишени. Количественную RT-PCR-амплификацию проводили на термоциклере Bio-Rad CFX96 (Bio-Rad, USA) по следующей программе: первичная денатурация: t=95 °С в течение 3 мин; 40 циклов: t=95 °С в течение 10 с, t=58 °С в течение 30 с (регистрация сигнала), t=72 °С в течение 30 с. Относительную экспрессию генетического локуса (RЕ) рассчитывали по формуле RЕ =2-ΔΔCt [11]. Нормализацию проводили по референсному гену GAPDH и экспрессии соответствующих генов в образцах нормальной ткани.
Статистический анализ результатов выполняли с использованием пакета прикладных статистических программ Microsoft Excel 2013 (Microsoft Corporation, США) и STATISTICA 8.0 (StatSoft Inc., США). Статистическую значимость различий определяли с помощью непараметрического критерия Манна-Уитни. Нулевую статистическую гипотезу об отсутствии различий отвергали при p<0,05.
Для проведения статистического анализа были сформированы следующие независимые группы пациенток:
1) группа А (1) - пациентки с возрастом до 55 лет (медиана возраста 45 лет, n=14) и группа Б (2) - пациентки с возрастом старше 55 лет (медиана возраста 68 лет, n=11);
2) группа В (3) - пациентки с гистологически подтвержденным диагнозом РМЖ люминального подтипа А (12 пациенток) и группа Г (4) – пациентки с гистологически подтвержденным диагнозом РМЖ люминального подтипа В (13 пациенток).
|
№ |
Название генетического локуса |
Последовательности праймеров 5’→3’ |
|
|
Прямой |
Обратный |
||
|
1 |
MAGEA1 |
GAAGGAACCTGACCCAGGC |
AGGGAATCCTGTCCTCTGGG |
|
2 |
MAGEA2 |
CGCAGGCTCCGTGAGG |
CTGTGTTGACCTGAGTCACCT |
|
3 |
MAGEA3 |
TGAGCAACGAGCGACGG |
TCAGCCTGTCCCCTCAGAA |
|
4 |
MAGEB1 |
TTCAGTGTGGTGTCCAGCAG |
CGAGTTGTACTCCTGGATGATCT |
|
5 |
MAGEB2 |
AGCCAGGGGTGAATTCTCAG |
GGCACGGAGCTTACTCTTCT |
|
6 |
GAGE-1 |
CTGATGGGCAGGAGATGGAC |
CCAGTCTGGGCAACATAGTGA |
|
7 |
GAGE3 |
TCACACAGATGAGTTGGCGA |
CTGTGTGAAATATGAGTTGGCGA |
|
8 |
GAGE4 |
GAGGAGGTGAAAACGCCTGA |
GCATCATTTCAACGTGCCTTCT |
|
9 |
MAGEC1 |
ACGAGGATCGTCTCAGGTCA |
CCAGGTCTTCAACTCCTGCT |
|
10 |
MAGEA4 |
CTGACCAGCAGCTTGGGAT |
TCCAGGGAATCCTGTCCTCC |
|
11 |
BAGE |
GCCGGCTCCTTTCAGGATT |
ACATCTTTCAGGAGCTTGGTCA |
|
12 |
CTAG1B |
TCACTGTGTCCGGCAACATA |
TGATGGAGAGCTGCAGTTGG |
|
13 |
XAGE3 |
ACTTGCCCTGAGACTTAGTTCG |
ACTTGCCCTGAGACTTAGTTCG |
|
14 |
NY-ESO1 |
GAGTTCACTGTGTCCGGCAA |
TGGAGACAGGAGCTGATGGA |
|
15 |
SSX2 |
CACGGTTGGTGCTCAAATACC |
CCGAGGCTTTCATCTTTTCCC |
|
16 |
SYCP1 |
CGGTGAAACCTCAGACCCT |
AGTCTTTGCAAATGGAAACTCAAA |
|
17 |
PRAME1 |
GCTGAGCCATTGTCTCGTTC |
AGGTCTCAGTCACTTGTTGCC |
|
18 |
GAPDH |
GTCAAGGCTGAGAACGGGAA |
TCGCCCCACTTGATTTTGGA |
Результаты и обсуждение
В нашем исследовании обнаружено статистически достоверное (р<0,05) увеличение экспрессии генов РТА MAGEA3, MAGEA4 и GAGE3 в 2,7 (у 63% пациентов); 2,7 (у 42% пациентов) и 2,9 (у 58% пациентов) раза соответственно в опухолевой ткани молочной железы относительно нормальной ткани у пациенток в возрасте 38-85 лет (n=25, рис. 1). Данные по гиперэкспрессии генов MAGEA при РМЖ подтверждаются в литературных источниках [7,9]. В исследовании Sahin U. и соавторов было показано, что экспрессия РТА отсутствовала в 47% опухолей молочной железы, а в 40% случаев рака молочной железы наблюдалась экспрессия по меньшей мере трёх РТА [12].
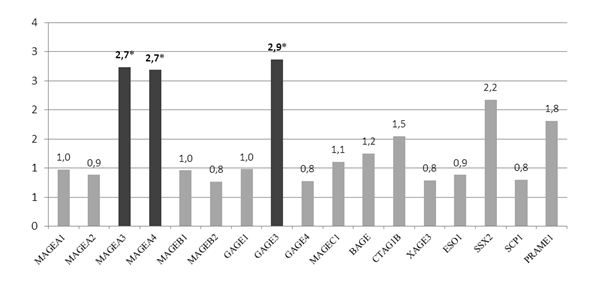
Рис. 1. Соотношение экспрессии генов РТА в опухолевой ткани относительно нормальной у пациенток в возрасте 38-85 лет (n=25)
Интересные результаты были получены при дроблении выборки по возрасту на две группы: группу А - пациентки до 55 лет (медиана возраста 45 лет, n=14) и группу Б - пациентки старше 55 лет (медиана возраста 68 лет, n=11). В группе А наблюдается достоверное увеличение экспрессии гена MAGEA3 в 2,8 раза (р<0,05, у 64% пациентов), в группе 2 - достоверное (р<0,05) увеличение экспрессии генов MAGEA1, MAGEB1, GAGE1, GAGE3, BAGE и CTAG1B в 6,0 (у 75% пациентов), 3,2 (у 63% пациентов), 4,3 (у 75% пациентов), 9,9 (у 75% пациентов), 1,6 (у 63% пациентов) и в 4,0 (у 75% пациентов) раза соответственно в опухолевой ткани относительно нормальной ткани молочной железы (рис. 2).
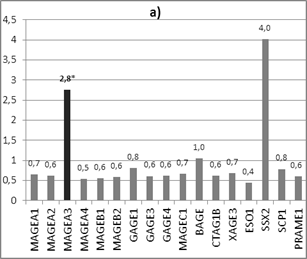
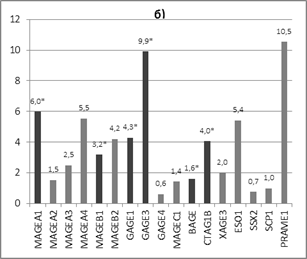
Рис. 2. Соотношение экспрессии генов РТА в опухолевой ткани относительно нормальной у пациенток: а) до 55 лет (медиана возраста 45 лет, n=14), б) старше 55 лет (медиана возраста 68 лет, n=11)
То есть обнаружен дифференциальный профиль экспрессии генетических локусов РТА у пациенток разных возрастных групп, причем до 55 лет обнаружено увеличение только 1 локуса MAGEA3, относящегося классу CT-X и тестикулярно-селективных РТА, а после 55 лет - 6 локусов (MAGEA1, MAGEB1, GAGE1, GAGE3, BAGE и CTAG1B), относящихся как к классам CT-X и non-X, так и к тестикулярно-селективным и тестикулярно-ограниченным РТА. Наличие возрастных особенностей в профиле экспрессии РТА можно объяснить возрастным изменением гормонального статуса, а также тем, что в исследовании использовались опухоли двух подтипов люминального А и В, экспрессирующие выраженно и умеренно рецепторы эстрогена в 90-100% ядер.
Основываясь на данных, представленных в исследованиях Theurillat J.-P. et al. [8], Grigoriadis A. et al. [9], Sugita Y. et al. [13], Hamaï A. et al. [14] о связи экспрессии генов некоторых РТА со статусом опухоли по наличию эстрогеновых рецепторов и HER2/neu (например, NY-ESO-1, MAGE-A3 и MAGE-A6), особенно интересно оценить значимую ассоциацию экспрессии более широкого спектра генов РТА с клинико-патологическими характеристиками не РМЖ в целом, а некоторых подгрупп РМЖ, в частности HER2 позитивных и негативных.
Сегодня выделяют две большие группы опухолей молочной железы, происходящие соответственно из базального (миоэпителиального) и люминального эпителия, которые можно отличить друг от друга по экспрессии специфических цитокератинов. Создана молекулярная классификация, согласно которой выделяют варианты РМЖ, различающиеся по прогнозу и чувствительности к различным видам лекарственной терапии. Внутри люминальной подгруппы выделяют два варианта – люминальный А, наиболее прогностически благоприятный, и люминальный В, который примерно в 30% случаев является HER2 позитивным, оставшиеся 70% случаев люминального В РМЖ, имея формальные признаки люминального А варианта (т.е. ER(+) и/или PgR(+)/HER2/neu(-)), отличаются от него высоким пролиферативным потенциалом и в силу этого характеризуются неблагоприятным прогнозом, мало отличающимся от HER2(-) и тройного негативного вариантов [15].
В нашем исследовании опухоли люминального типа В в 100% случаев экспрессировали HER2/NEU (но в разной степени). Были получены следующие результаты:
1) у пациенток с РМЖ люминального типа А обнаружено статистически достоверное (р<0,05) увеличение экспрессии генов РТА MAGEA1 в 6,2 раза, MAGEA2 в 3,5 раза, MAGEA4 в 14,9 раза, MAGEB1 в 15,0 раза, MAGEB2 в 4,1 раза, GAGE3 в 36,2 раза, GAGE4 в 8,5 раз, MAGEC1 в 9,7 раза и PRAME1 в 30,4 раза в опухолевой ткани относительно нормальной ткани (рис. 3а);
2) у пациенток с РМЖ люминального типа В обнаружено статистически достоверное (р<0,05) снижение экспрессии генов РТА MAGEB2 и GAGE4 в 8,0 и 3,0 раза соответственно в опухолевой ткани относительно нормальной ткани. Достоверного изменения экспрессии других РТА генов не обнаружено (рис. 3б).
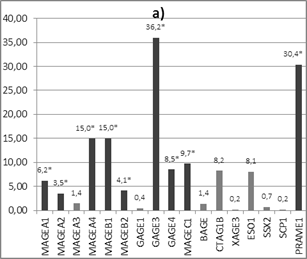
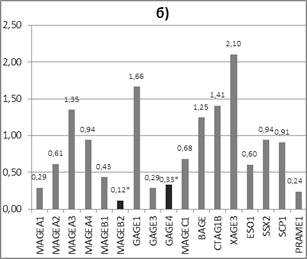
Рис. 3. Соотношение экспрессии генов РТА в опухолевой ткани относительно нормальной у пациенток РМЖ: а) люминального типа А (n=12), б) люминального типа В (n=13)
Полученные нами закономерности в изменении транскрипционной активности РТА-локусов двух групп пациенток с люминальным А и люминальным В подтипом РМЖ хорошо согласуются с прогнозом развития заболевания. В отличие от опухолей люминального подтипа А у опухолей люминального подтипа В не наблюдалось существенного увеличения транскрипционной активности исследованных РТА-локусов, что свидетельствует об их низком иммунотерапевтическом потенциале при лечении РМЖ данного типа. А достоверное снижение экспрессии генов MAGEB2 и GAGE4 может служить диагностическим маркёром РМЖ люминального типа В, так же как и увеличение экспрессии 9 локусов при РМЖ люминального типа А.
Заключение
Обнаруженное увеличение экспрессии генов MAGEA1, MAGEA2, MAGEA3, MAGEA4, MAGEB1, MAGEB2, BAGE, CTAG1B, GAGE1, MAGEC1, PRAME1, GAGE4 и GAGE3 создает предпосылки для использования этих РТА в качестве наиболее эффективных мишеней иммунотерапии РМЖ. Но для разных возрастных групп пациенток в качестве такой мишени выступают разные группы РТА: для пациенток до 55 лет - MAGEA3, для пациенток старше 55 лет - MAGEA1, MAGEB1, BAGE, CTAG1B, GAGE1 и GAGE3, так же как и для люминального типа А (MAGEA1, MAGEA2, MAGEA4, MAGEB1, MAGEB2, GAGE3, GAGE4, MAGEC1 и PRAME1) и В (локусов с повышенной экспрессией не обнаружено). Данные отличия транскрипционного профиля генов РТА, ассоциированные с возрастом и люминальным А/В типом РМЖ, необходимо учитывать при планировании и проведении иммунотерапии.
Обобщая приведенные выше результаты, можно сделать вывод, что гены РТА являются также перспективными биомаркерами прогрессии заболевания как для РМЖ в целом (MAGEA3, MAGEA4 и GAGE3), так и для его отдельных подтипов в частности.
Библиографическая ссылка
Водолажский Д.И., Кутилин Д.С., Могушкова Х.А., Ващенко Л.Н., Никитина В.П., Кит О.И. ТРАНСКРИПЦИОННАЯ АКТИВНОСТЬ РАКОВО-ТЕСТИКУЛЯРНЫХ АНТИГЕНОВ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ ЛЮМИНАЛЬНЫХ ПОДТИПОВ А И В // Современные проблемы науки и образования. 2017. № 4. ;URL: https://science-education.ru/ru/article/view?id=26492 (дата обращения: 07.01.2026).



