С учетом изменений условий существования холерных вибрионов при смене экологической ниши обитания вопрос о стабильности их генома в условиях стресса остается в настоящее время весьма актуальным, особенно в области признаков, касающихся эпидемической значимости возбудителя холеры. Установлено, что вся эволюция V.cholerae обеспечивается присутствием в геноме мобильных генетических элементов: профагов (CTXφ, RS1φ), островов пандемичности (VSP-I и VSP-II) и патогенности (VPI-1 и VPI-2), а также транспозонов и IS-элементов [4,10,13]. Благодаря данным структурам, в конце прошлого столетия появились генетически измененные варианты V. cholerae биовара Эль Тор с повышенной вирулентностью (так называемые «гибридные» или «атипичные»), несущие в своем геноме ген ctxB1, присущий холерным вибрионам классического биовара. Такие вибрионы с 2001 г. полностью вытеснили типичные штаммы V.cholerae биовара Эль Тор на территории ряда стран Южной Азии (Непал, Индия, Бангладеш, Шри Ланка) и Африки (Мозамбик, Нигерия, Камерун). В 1994 году «атипичные» («гибридные») штаммы вызвали эпидемию холеры в Дагестане, а в 2010–2011 гг. – на о. Гаити [3,10,14]. Однако, несмотря на высокую адаптивную способность холерных вибрионов, не решен вопрос: какие условия требуются для появления и закрепления изменений в геноме возбудителя. Между тем такие сведения крайне необходимы для оптимизации эпидемиологического надзора.
Цель исследования: изучение влияния ряда стрессоров, действию которых вибрионы подвергаются в окружающей среде, на токсинопродукцию.
Материалы и методы: в работе использовали 13 эпидемически значимых штаммов V.cholerae О1 серогруппы биовара Эль Тор (3 – типичные: ctxAB3, rstRElTor, 10 – атипичные: ctxAB1, rstRElTor) и 2 штамма классического биовара, содержащих гены ctxAB1, rstRClass.
Для решения поставленных задач холерные вибрионы инкубировали в стерильной речной воде (конечная концентрация 1*107 м.к./мл) при +40С и при +220С в течение нескольких месяцев, а также (при моделировании условий пребывания возбудителя холеры в речной воде в летнее, осеннее, зимнее время) эксперимент продолжали 2 месяца при 22 0С, 2 месяца – при 10 0С, 5 месяцев – при 4 0С при сниженном содержании кислорода (в речной воде оно составляет около 1 %). Ежемесячно производили высевы на агар Мартена для определения выживаемости холерных вибрионов. Выжившие в условиях стресса клетки культивировали по методике М. Iwanaga [12] для определения продукции холерогена в супернатантах в GM1-ИФА с антитоксической сывороткой, полученной путем иммунизации кроликов по специально разработанной нами схеме, в рабочем разведении 1х20000. Результаты оценивали при титрации супернатантов по следующей схеме: низкий уровень токсинопродукции – титр в GM1-ИФА 1/2-1/20, средний уровень – 1/40-1/320, высокий уровень – 1/640-1/2560.
Выделение бактериальной ДНК из клеток V. cholerae проводили, согласно МУ 1.3.2569-09 [6]. Полученные образцы, содержащие тотальную ДНК холерного вибриона, использовали для амплификации фрагментов генов. Наличие гена ctxAB определяли в ПЦР[2]. Секвенирование геномной ДНК выполнялись на платформе MiSeq (Illumina). Пробоподготовку проводили согласно протоколам производителя. Сборку контигов осуществляли с помощью программы Velvet [15]. Биоинформационный анализ проводили с помощью программ GeneExpert и SeqAnalyzer, разработанных во ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора с использованием ресурсов геномной базы данных NCBI.INDEL-типирование проводили по методике, предложенной А.С. Водопьяновым [1].
Результаты и обсуждение. Как нами было показано ранее [9], у холерных вибрионов при +4ºС в речной воде в течение первых 14 дней имеет место некоторое увеличение показателей токсинопродукции у большей части исследуемых штаммов (за исключением штаммов V.cholerae 1601 и 17427 – у них отмечалось незначительное снижение титра, и штаммов 569, 1310, 19188, у которых уровень продукции оставался без изменений). Однако уже через месяц стрессового воздействия показатели токсинообразования резко снижались, вплоть до полного исчезновения фенотипического проявления признака к концу второго месяца. Только три штамма V.cholerae ElTor сохраняли способность к токсинопродукции, определяемой методом ИФА: высокотоксигенный типичный 1310, типичный 3119 и атипичный 19667, выделенный от больного в Москве в 2014 г. Остальные 10 штаммов перестали продуцировать холероген, при сохранении генов ctxАВ, определяемых в ПЦР. Через три месяца низкотемпературного стресса ни одна из культур не выросла в среде AKI, показатели токсинопродукции были отрицательными, гены ctxAB в ПЦР не обнаружены.
Обращает на себя внимание, что реакция на стрессовое воздействие разных температур, имитирующих условия пребывания холерных вибрионов в речной воде, отличалась у типичных и атипичных вариантов. Так, средние показатели токсинопродукции при холодовом стрессе (4°С) у атипичных вариантов были выше только в первые две недели (рис. 1), затем уровень холерогена у них снижался интенсивнее, чем у типичных штаммов (показания высокотоксигенного исходного мутантного штамма 1310 в расчет не принимались), т.е. они были более чувствительны к низким температурам, чем типичные.
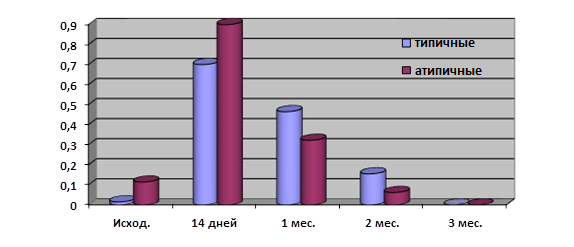
Рис. 1. Средние показатели токсинопродукции при длительной инкубации типичных и атипичных холерных вибрионов в речной воде при 4°С
Напротив, в отсутствие температурного стресса (22°С) средние показатели токсинопродукции у атипичных вариантов вибрионов Эль Тор на всем протяжении исследования были в 2–8 раз выше, чем у типичных штаммов, что в полной мере характеризует их, как варианты с повышенной вирулентностью (рис. 2).
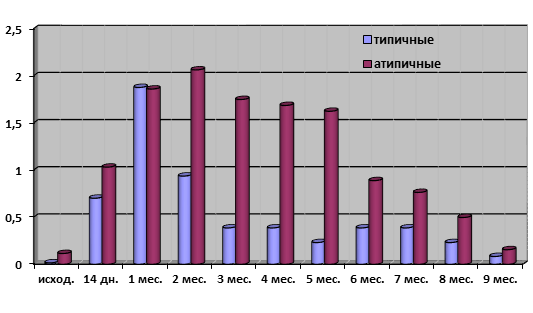
Рис. 2. Средние показатели токсинопродукции при длительной инкубации типичных и атипичных холерных вибрионов в речной воде при 22°С
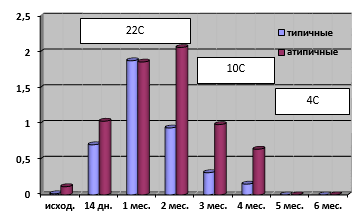
Рис. 3. Средние показатели токсинопродукции при длительной инкубации типичных и атипичных холерных вибрионов в речной воде при постепенной смене температур
При моделировании условий пребывания холерных вибрионов в водоемах Российской Федерации, в которых на протяжении эпидемического сезона температура постепенно снижается, токсинопродукция к 5 месяцу инкубации практически отсутствовала, но на протяжении 4 летне-осенних месяцев при 22°С и 10°С она в среднем в 2–4 раза была выше у атипичных вариантов (рис. 3), что необходимо учитывать при проведении эпиднадзора за холерой. Проведенные исследования показали, что фенотип возбудителя холеры в части токсинопродукции выраженно «отвечает» на стрессовые воздействия окружающей среды.
Что касается структуры генома, то в эксперименте Т.А. Кульшань с соавторами была показана возможность утраты генов профага СТХφ, в том случае, когда исследуемые «типичные» штаммы холерных вибрионов несли одну копию профага, в то время как атипичные «гибридные» геноварианты с двумя копиями профага СТХφ сохраняли указанные гены [5]. В наших опытах в ПЦР отмечено сохранение генов патогенности вне зависимости от отрицательных показателей ИФА, до тех пор, пока в популяции исследуемых штаммов сохранялись живые вибрионы. В «пустых» пробах, исследуемых после гибели всей популяции V.cholerae, гены, ответственные за токсинопродукцию, не обнаруживались.
В свете полученных данных представляло интерес сравнить геномы исходных и стрессированных вариантов холерных вибрионов, для чего было проведено полногеномное секвенирование 3 штаммов, а также сравнение их INDEL-профилей по 9 локусам (табл.1,2).
В таблице 1 представлены результаты сиквенса, выраженные в процентах совпадения с референс-последовательностью.
Таблица 1
Результаты полногеномного секвенирования исходных и стрессированных культур холерных вибрионов
|
Анализируемые гены |
V.choleraeElTor 19241 (301) морская вода, 2011г |
V.choleraeElTor 5879 больной, 1972г |
V.cholerae classical 569 больной, 1968 |
||||
|
исходный |
стресс |
исходный |
стресс |
исходный |
стресс |
||
|
Принадлежность к виду V. cholerae |
ompW (VCA0867) |
100,00 |
100,00 |
100,00 |
100,00 |
99,16 |
99,16 |
|
Коллагеназа(VC1650) |
99,74 |
99,70 |
99,80 |
99,80 |
99,21 |
99,21 |
|
|
VCA0164 |
100,00 |
100,00 |
100,00 |
100,00 |
98,1 |
98,1 |
|
|
Серогруппа |
О1 (ген wbe) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
Биовары |
hlyA Eltor |
100,00 |
100,00 |
100,00 |
100,00 |
98,9 |
98,9 |
|
hlyA classical |
94,6 |
94,6 |
97,6 |
97,6 |
100,00 |
100,00 |
|
|
rtxCElTor(VC1450) |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
|
Профаг CTX |
cep (VC1461) |
100,00 |
100,00 |
100,00 |
100,00 |
98,00 |
98,00 |
|
orfU (VC1460) |
100,00 |
100,00 |
100,00 |
100,00 |
96,1 |
96,1 |
|
|
ace (VC1459) |
100,00 |
100,00 |
100,00 |
100,00 |
98,6 |
98,6 |
|
|
zot (VC1458) |
100,00 |
100,00 |
100,00 |
100,00 |
98,8 |
98,8 |
|
|
ctxA (VC1457) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
ctxB1 (Classical) |
100,00 |
100,00 |
100,00 |
100,00 |
99,47 |
99,47 |
|
|
ctxB3 (El Tor) |
99,47 |
99,47 |
100,00 |
100,00 |
- |
- |
|
|
Профаг RSI |
RstR (VC1464) |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
RstA (VC1454) |
99,63 |
100,00 |
98,81 |
98,81 |
98,8 |
98,8 |
|
|
rstС (VC1452) |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
|
rstRElТor(VC1455) |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
|
Остров патогенности VPI-I |
aldA (VC0819) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
mop (VC0823) |
100,00 |
100,00 |
100,00 |
100,00 |
97,7 |
97,7 |
|
|
tcpA (VC0828) |
99,85 |
99,85 |
100,00 |
100,00 |
80,4 |
80,4 |
|
|
toxT (VC0838) |
100,00 |
100,00 |
100,00 |
100,00 |
99,88 |
99,88 |
|
|
acfB (VC0840) |
100,00 |
100,00 |
100,00 |
100,00 |
99,89 |
99,89 |
|
|
Остров патогенности VPI-II |
VC1757 |
100,00 |
100,00 |
100,00 |
100,00 |
99,90 |
99,90 |
|
VC1810 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
nanH (VC1784) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
VC1803 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
Остров пандемичности VSP-I |
VC0175 |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
VC0178 |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
|
VC0180 |
99,93 |
100,00 |
100,00 |
100,00 |
- |
- |
|
|
VC0183 |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
|
VC0185 |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
|
Остров пандемичности VSP-II |
VC0490 |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
VC0496 |
- |
- |
100,00 |
100,00 |
- |
- |
|
|
type IV pilin (VC0502) |
- |
- |
100,00 |
100,00 |
- |
- |
|
|
Кластер RTX |
RTX toxin RtxA (VC1451) |
100,00 |
100,00 |
100,00 |
100,00 |
- |
- |
|
RTX toxin transporter (VC1447) |
100,00 |
100,00 |
100,00 |
100,00 |
99,86 |
99,93 |
|
|
Кластер MSHA |
mshA (VC0409) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
proteinCsrD (VC0398) |
99,85 |
99,85 |
99,80 |
99,80 |
99,85 |
99,85 |
|
|
MSHA pilin protein MshD (VC0411) |
100,00 |
100,00 |
99,84 |
99,84 |
100,00 |
100,00 |
|
|
Система секреции шестого типа (T6SS) |
vasA (VCA0110) |
100,00 |
100,00 |
100,00 |
100,00 |
99,44 |
99,44 |
|
vasF (VCA0115) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
vasK (VCA0120) |
100,00 |
100,00 |
100,00 |
100,00 |
99,87 |
99,87 |
|
|
vgrG3 (VCA0123) |
100,00 |
100,00 |
100,00 |
100,00 |
99,93 |
99,93 |
|
|
Tol-кластер и локус vps |
tolQ (VC1839) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
TolA (VC1837) |
100,00 |
100,00 |
99,91 |
100,00 |
100,00 |
100,00 |
|
|
TolR (VC1838) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
vpsA (VC0917) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
vpsL (VC0934) |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
100,00 |
|
|
ToxT |
100,00 |
100,00 |
100,00 |
100,00 |
80,40 |
80,40 |
|
|
ToxR |
99,66 |
99,66 |
100,00 |
100,00 |
99,84 |
99,84 |
|
|
ToxS |
100,00 |
100,00 |
100,00 |
100,00 |
99,89 |
99,89 |
|
Как видно из таблицы, полногеномное секвенирование стрессированных культур не выявило полиморфизма структуры генома в сравнении с исходными штаммами по основным наборам генов.
В связи с тем, что в литературе есть сведения об изменениях VNTR-профиля холерных вибрионов на начальном этапе стрессового воздействия у отдельных штаммов, которые рассматриваются авторами как первичная реакция на стресс [7], вероятно, следует учитывать их при анализе результатов молекулярного типирования вибрионов, выделенных в рамках проведения мониторинга при эпидемиологическом надзоре за холерой. В связи с этим возникала необходимость выбора более стабильного метода типирования выделяемых штаммов холерных вибрионов, в том числе разработанного А.С. Водопьяновым INDEL-типирование [1]. Проведение INDEL-типирования исследуемых штаммов по 9 локусам показало, что все изученные стрессированные культуры сохранили свой INDEL-профиль без изменений (табл. 2).
Таблица 2
Результаты INDEL-типирования исходных и стрессированных культур холерных вибрионов
|
№ п/п |
№ штамма |
Дата выде-ления |
Место выделения |
Источник выделения |
ctx |
tcp |
INDEL-аллель по локусам |
||||||||
|
CoA |
OmpU |
hutG |
2456 |
122 |
704 |
3186 |
CheA |
p1070 |
|||||||
|
1 |
19241/ 301 |
2011 |
г.Таганрог |
морская вода |
+ |
+ |
98 |
166 |
159 |
78 |
79 |
77 |
67 |
169 |
67 |
|
19241-1 |
стрессир.1 |
+ |
+ |
98 |
166 |
159 |
78 |
79 |
77 |
67 |
169 |
67 |
|||
|
19241-2 |
стрессир.2 |
+ |
+ |
98 |
166 |
159 |
78 |
79 |
77 |
67 |
169 |
67 |
|||
|
2 |
5879 |
1972 |
г. Таганрог |
больной |
+ |
+ |
98 |
166 |
159 |
78 |
79 |
77 |
67 |
169 |
67 |
|
5879-1 |
стрессир.1 |
+ |
+ |
98 |
166 |
159 |
78 |
79 |
77 |
67 |
169 |
67 |
|||
|
5879-2 |
стрессир.2 |
+ |
+ |
98 |
166 |
159 |
78 |
79 |
77 |
67 |
169 |
67 |
|||
|
3 |
569В (классич.) |
1968 |
Индия |
больной |
+ |
+ |
98 |
166 |
159 |
87 |
79 |
77 |
67 |
169 |
80 |
|
569В -1 |
стрессир.1 |
+ |
+ |
98 |
166 |
159 |
87 |
79 |
77 |
67 |
169 |
80 |
|||
|
569В -2 |
стрессир.2 |
+ |
+ |
98 |
166 |
159 |
87 |
79 |
77 |
67 |
169 |
80 |
|||
Выводы. Таким образом, токсигенные холерные вибрионы могут персистировать в воде открытых водоемов при температуре 22°С-24°С достаточно продолжительный срок с сохранением продукции холерного токсина, т.е. оставаясь эпидемически значимыми; при понижении температуры до 10°С и ниже уровни токсинопродукции снижаются вплоть до отрицательных значений, а низкая температура как стрессор, имитирующий условия окружающей среды в речной воде в холодное время года, возможно, ингибирует активацию белка ToxT, ответственного за транскрипцию генов, кодирующий холерный токсин, уже в первый месяц. Установлено, что, вне зависимости от отрицательных показателей ИФА, гены ctхAB обнаруживаются в ПЦР до тех пор, пока в популяции исследуемых штаммов сохраняются живые вибрионы. В «пустых» пробах, исследуемых после гибели всей популяции V.cholerae, гены, ответственные за токсинопродукцию, не обнаруживаются. Изменений в популяции клеток вибрионов, выживших после низкотемпературного стресса, связанных с утратой профага CTXφ, несущего гены, ответственные за синтез холерного токсина, а также утратой других значимых участков генома, в наших экспериментах не отмечено, что подтверждается в полногеномном секвенировании INDEL-типировании исходных и стрессированных культур и говорит о его стабильности. Возможно, изменение токсинопродукции в стрессовых условиях связано не с реорганизацией генома, а с изменением экспрессии каскада регуляторных генов ToxR-S, ToxT, регуляция которых находится в непосредственной зависимости от состояния кворум сенсинга бактериальной культуры V.cholerae и управляется четырьмя малыми РНК, получившими название Qrr1-4 [8]. Возможно, регуляторная система малых РНК позволяет V.cholerae сохранять гены патогенности в стрессовых условиях, что и является предметом наших дальнейших исследований.
Библиографическая ссылка
Сизова Ю.В., Писанов Р.В., Водопьянов А.С., Черепахина И.Я., Бурлакова О.С. ФЕНОТИПИЧЕСКИЙ И ГЕНОТИПИЧЕСКИЙ АНАЛИЗ ТОКСИНОПРОДУКЦИИ ТИПИЧНЫХ И АТИПИЧНЫХ ШТАММОВ ХОЛЕРНЫХ ВИБРИОНОВ В СТРЕССОВЫХ УСЛОВИЯХ ОКРУЖАЮЩЕЙ СРЕДЫ // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26439 (дата обращения: 22.02.2026).



