Фибрилляция предсердий (ФП) является одной из наиболее распространенных аритмий в клинической практике. Такие пациенты требуют активного наблюдения за нарушением ритма сердца и лечения. Но в некоторых случаях выявить причину возникновения мерцательной аритмии не удается, и тогда говорят о генетическом компоненте в развитии ФП. В то же время ученые полагают, что идиопатическая форма ФП в большинстве случаев имеет связь с генетическим фактором [5,6].
Частота встречаемости мерцательной аритмии имеет тенденцию к увеличению с возрастом, так в возрастной группе старше 65 лет она достигает уровня 6 % [7].
В большинстве случаев на развитие ФП влияют различные сочетания полиморфизмов генов. Также генетический полиморфизм лежит в основе патофизиологии заболевания. Наличие одного или другого полиморфного аллельного варианта определенного гена или их комбинаций влияет как на возможность возникновения ФП, так и на эффект от терапии лекарственными препаратами. Известно, что ангиотензин II оказывает аритмогенное действие за счет стимуляции развития фиброза и гипертрофии предсердий, что в свою очередь является субстратом для развития ФП. Аритмогенное действие ангиотензина II обусловлено нарушением утилизации кальция, нарушением функции ионных каналов, активацией медиаторов окислительного стресса и усилением воспаления. Кроме того, в экспериментальных исследованиях были доказаны антиаритмические и противофиброзные свойства блокаторов РААС [11].
Известно, что уровень активности РААС контролируется на генном уровне, наибольшее значение имеют полиморфизмы генов ACE, AGT и AGTR1. Нами же был выбран ген AGT, поскольку ему отводится начальная роль в патогенезе ангиотензина II. Ген AGT был определен на длинном плече 1-й хромосомы в 42 локусе (1q42). Ген AGT кодирует белок про-ангиотензиноген (предшественник ангиотензина, который является мощным вазоконстриктором). И далее в результате биохимических процессов происходит его расщепление до ангиотензина II путем отщепления определенного количества аминокислот [1].
Наличие мутации в генах РААС приводит к нарушению данного каскада биохимических процессов, которые ведут к изменению уровня содержания ангиотензина в плазме крови, что в свою очередь может приводить не только к развитию сердечно-сосудистой патологии, но и к нарушению проведения импульса по проводящей системе сердца, и как следствие – развитие нарушения ритма сердца.
Исследование полиморфизма генов РААС позволит заблаговременно обнаруживать группы лиц повышенного риска возникновения ФП для осуществления первичной и вторичной профилактики. Последние данные показывают, что активация РААC играет важную роль в развитии и сохранении ФП [6,8,9].
Цель исследования: определить полиморфные аллельные варианты Т174М и М235Т гена AGT. А также изучить их взаимосвязь с развитием фибрилляции предсердий.
Материалы и методы исследования. В ходе работы было обследовано 40 пробандов с первичной ФП и 50 пробандов с вторичной ФП, а также их родственники I – III степени родства. Данные семьи были включены в основную группу исследования. Набор пациентов проводился в период их лечения в кардиологическом отделении КГБУЗ «КМКБ № 20 им. И.С. Берзона». Выявленные родственники проходили обследование в отделение функциональной диагностики и амбулаторно-консультативном отделение и КГБУЗ «КМКБ № 20 им. И.С. Берзона».
Дизайн исследования сформирован согласно Национальному стандарту РФ Надлежащая клиническая практика (Good Clinical Practice), ГОСТ P 52379-2005 (Утвержден приказом Федерального агентства по техническому регулированию и метрологии от 27.09.2005 №232-ст).
В таблице 1 представлена половозрастная характеристика пробандов как с первичной ФП (n=40 человек), так и с вторичной ФП (n=50 человек), а также лиц группы контроля (n=100 человек). Их средний возраст, стандартное отклонение, минимальный и максимальный возраст в данной подгруппе (таблица 1).
Таблица 1
Половозрастная характеристика пробандов с ФП и группы контроля
|
Подгруппа |
n |
Средний возраст |
Min |
Max |
Me; [Q25 - Q75] |
|
Пробанды с ПФП |
40 |
38,13 ± 13,06 |
18 |
65 |
39,00 [26,00; 49,00] |
|
Пробанды с ВФП |
50 |
67,16 ± 8,38 |
52 |
79 |
68,00 [62,00; 75,00] |
|
Группа контроля |
100 |
46,89 ± 10,99 |
18 |
65 |
49,50 [45,00; 55,00] |
В таблице 2 представлена половозрастная характеристика больных родственников пробандов с первичной и вторичной ФП. (таблица 2).
Таблица 2
Половозрастная характеристика больных родственников пробандов с первичной и вторичной ФП
|
Подгруппа |
n |
Средний возраст |
Min |
Max |
Me; [Q25 - Q75] |
|
Больные родственники пробандов с ПФП (n=11) |
|||||
|
ПФП |
11 |
49,55 ± 19,97 |
18 |
76 |
58,00 [30,00; 66,00] |
|
Больные родственники пробандов с ВФП (n=7) |
|||||
|
ВФП |
7 |
36,71 ± 17,79 |
13 |
67 |
38,00 [19,00; 46,00] |
Методы статистической обработки применялись в зависимости от характера учетных признаков и числа групп сравнения. Для определения характера распределения количественных показателей использовали критерий Шапиро – Уилкса. При нормальном распределении показателей использована описательная статистика, представленная в виде среднего значения и стандартной ошибки среднего. При отсутствии нормального распределения описательная статистика представлена в виде медианы и перцентилей. Для определения значимости различий использовался критерий Манна – Уитни [2]. Для определения статистической значимости отличий между качественными признаками применяли критерий хи-квадрат (χ2). Если ожидаемые частоты были менее 5, то использовался точный критерий Фишера. Сила связи между изученными признаками определялась при помощи критерия корреляции Пирсона и при непараметрическом распределении – Спирмена. Относительный риск (OR – oddsratio) развития заболевания по определенному аллелю или наличию конкретного генотипа вычислялся как отношение шансов [3]. OШ определяли с 95 % доверительным интервалом. Уровень значимости (p) определялся равным 0,05. Статистическая обработка материала была произведена с использованием программ «SPSS 22» и «Excel».
Соответствие распределения наблюдаемых частот генотипов исследуемых генов в группе контроля, теоретически ожидаемого по равновесию Харди – Вайнберга, оценивали с помощью критерия χ2. Вычисление проводили при помощи онлайн калькулятора [10].
Для проведения исследования в соответствии с Хельсинской декларацией, было получено разрешение Локального Этического комитета при КрасГМУ им. проф. В.Ф. Войно-Ясенецкого, а также для проведения молекулярно-генетического исследования информированное согласие пациента (Протокол № 54 от 10.02.2014 г.).
Результаты исследования и их обсуждения
В ходе изучения распределение частот генотипов и аллелей полиморфизма М235Т гена AGT среди пробандов с первичной и вторичной ФП, а также их больных родственников были получены следующие результаты.
На рисунке 1 представлено распределение частот генотипов и аллелей Т174М полиморфизма гена AGT среди пробандов с первичной ФП и лиц контрольной группы. Преобладала частота встречаемости носителей гомозиготного генотипа СС по распространенному аллелю среди пробандов с первичной ФП – 72,5 %±7,1, так и среди лиц контрольной группы – 70,0 %±4,6 (рис. 1).
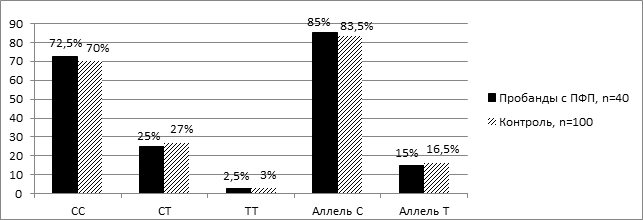
Рис.1. Распределение частот генотипов и аллелей Т174М полиморфизма гена AGT среди пробандов с первичной ФП и лиц контрольной группы
На рисунке 2 представлено распределение частот генотипов и аллелей полиморфизма М235Т гена AGT среди пробандов с первичной ФП и лиц контрольной группы. Было выявлено преобладание носителей гетерозиготного генотипа ТС как среди пробандов с первичной ФП, так и среди лиц контрольной группы, что составило 40,0 %±7,7 и 53,0 %±5,0 соответственно (рис. 2).
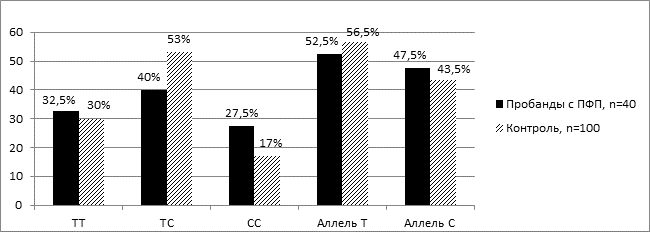
Рис.2. Распределение частот генотипов и аллелей M235T полиморфизма гена АGT среди пробандов с первичной ФП и лиц контрольной группы
На рисунке 3 представлено распределение частот генотипов и аллелей полиморфизма Т174М гена AGT среди пробандов с вторичной ФП и лиц контрольной группы. Среди пробандов с вторичной ФП преобладали носители гомозиготного генотипа СС по распространенному аллелю – 64,0 %±6,8. В контрольной группе также преобладал гомозиготный генотип СС по распространенному аллелю – 70,0 %±4,6 (рис. 3).
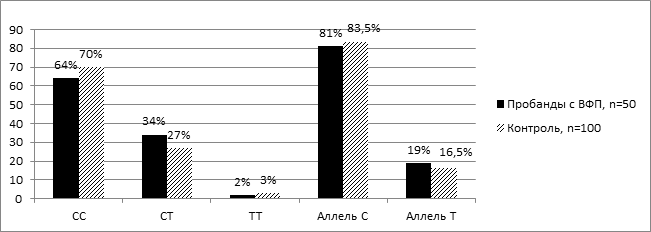
Рис. 3. Распределение частот генотипов и аллелей Т174М полиморфизма гена АGT среди пробандов с вторичной ФП и лиц контрольной группы
На рисунке 4 представлено распределение частот генотипов и аллелей M235T полиморфизма гена АGT среди пробандов с вторичной ФП и лиц контрольной группы. Среди пробандов с вторичной ФП преобладали носители гетерозиготного генотипа ТС 42,0 %±7,0. Среди лиц контрольной группы также преобладали носители гетерозиготного генотипа ТС 53,0 %±5,0 (рис. 4).
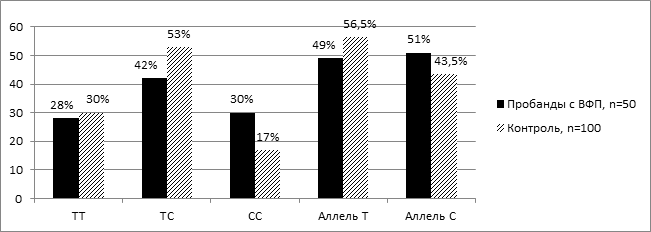
Рис. 4. Распределение частот генотипов и аллелей M235T полиморфизма гена АGT среди пробандов с вторичной ФП и лиц контрольной группы
При анализе распределения частот генотипов и аллелей Т174М и М235Т полиморфизмов гена AGT среди родственников пробандов с первичной и вторичной ФП не было получено статистически значимых результатов в сравнении с группой контроля.
По результатам проведенного исследования не было выявлено статистически значимых результатов взаимосвязи Т174М и М235Т полиморфизмов гена AGT с развитием ФП ни в одной подгруппе больных. В то же время Q.S. Wangetal. указали на то, что полиморфизм М235Т в гене AGT может предрасполагать к развитию ФП в китайской популяции [14]. H. Wangetal. с помощью и мета-анализа установили, что полиморфизм М235Т гена AGT может быть связан с повышенным риском развития ФП в азиатской популяции [13]. Так Tsai C.T. et al. в своей работе также не получили статистически достоверных различий взаимодействия Т174М полиморфизма гена AGT с фибрилляцией предсердий [12]. Zhao L.Q. et al. в своей работе также не получили достоверных данных о взаимосвязи данного полиморфизма с развитием ФП [15].
Полученные нами результаты могут быть обусловлены в первую очередь генетическими особенностями населения сибирского региона, которые зависят от климатических и географических условий, и в конечном итоге подтверждает, что ФП является гетерогенным заболеванием. Это доказывает важность мультилокусного и мультигенного подхода при определении риска развития таких мультифакторных заболеваний как ФП.
Заключение. Полученные результаты не показали взаимосвязи T174M и М235Т полиморфизмов гена AGT в развитии ФП среди пациентов сибирского региона. Но в то же время не стоит забывать о роли и других генов-кандидатов в развитии мерцательной аритмии. Где может играть важную роль не только отдельно взятый ген, но и их взаимодействие друг с другом. Полученные нами данные доказывают гетерогенную природу развития ФП и подтверждают мультифакторный характер заболевания.
Библиографическая ссылка
Никулина С.Ю., Чернова А.А., Кускаева А.В., Аксютина Н.В. РОЛЬ T174M И М235Т ПОЛИМОРФИЗМОВ ГЕНА AGT В РАЗВИТИИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ НА ТЕРРИТОРИИ Г. КРАСНОЯРСКА // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26407 (дата обращения: 02.01.2026).



