Проблема хирургического лечения послеоперационных вентральных грыж (ПОВГ) остается актуальной до настоящего времени. Частота возникновения ПОВГ после плановых операций достигает, по данным разных авторов, 4–18,1%, а после ургентных – 18,1–58,7% [8]. Применение сетчатых имплантов в лечении грыж уменьшило количество рецидивов, но привело к увеличению частоты послеоперационных раневых осложнений до внушительных цифр – 20,9–49,2% [1]. Одним из приоритетных направлений научных исследований в герниологии является разработка методов профилактики сером, которые являются самым распространенным осложнением течения послеоперационного периода и встречаются в широких пределах от 0,8 до 60% [7]. По данным ряда авторов, после лечения сером частота рецидивов достигает 70,9% [3].
Важнейшим методом профилактики послеоперационных раневых осложнений герниопластики является рациональный выбор положения сетчатого импланта в передней брюшной стенке [7]. При предбрюшинной пластике по методике sublay отмечается меньшая травматизация подкожной жировой клетчатки и апоневроза, меньшее количество раневого отделяемого, меньшее количество раневых осложнений и, соответственно, благоприятное течение послеоперационного периода [2]. Однако в ряде случаев интраоперационно не представляется возможным выделение предбрюшинного пространства с последующим размещением в нем сетчатого импланта по методике sublay. Такие клинические ситуации происходят при технической невозможности адекватной дифференцировки слоев передней брюшной стенки: наличии выраженного рубцового или спаечного процесса в области грыжевых ворот, отсутствии или выраженном повреждении брюшинного покрова в зоне пластики после множественных хирургических операций на брюшной полости или рецидивных грыжах. Единственным возможным решением в таком случае становится применение надапоневротической пластики (onlay), которая характеризуется наиболее высокой частотой развития послеоперационных раневых осложнений – 21,3-31,8% [4].
С целью профилактики послеоперационных раневых осложнений различными авторами предложен ряд методик, связанных с дополнительной имплантацией в зону пластики препаратов и материалов, тем или иным способом благоприятствующих интеграции эндопротеза в ткани передней брюшной стенки: фибрин-коллагеновых субстанций, аллогенных фибробластов, деструктурируемой матрицы с антибактериальным компонентом и др. [5; 6; 9], однако все эти способы не нашли широкого применения.
С этой точки зрения привлекает внимание полисахаридная система PerClot (CryoLife Inc., USA). PerClot относится к группе гемостатических средств и состоит из частиц рассасывающегося модифицированного полимера (АМР), произведенного из очищенного растительного крахмала. Частицы полимера АМР имеют молекулярную структуру, которая позволяет им быстро поглощать жидкую составляющую крови. Процесс дегидратации приводит к повышению концентрации форменных элементов и белковых компонентов крови в зоне применения. При контакте с кровью частицы АМР приводят к формированию гелеобразного клейкого матрикса, который выполняет барьерную функцию. Биодеградация PerClot в тканях организма занимает несколько дней, а ее скорость зависит от использованного количества вещества и места его применения.
По своему основному назначению PerClot широко используется с целью гемостаза во время хирургических вмешательств (в кардиохирургии, нейрохирургии, абдоминальной хирургии, урологии и т.д.), в случаях, когда не удается устранить кровотечение из капилляров, вен или артерий привычными способами, такими как компрессия, лигатура и другими. При экспериментальных исследованиях течения воспалительного процесса в послеоперационных ранах, обработанных PerClot, у крыс отмечено значительное увеличение числа фибробластов, новообразование капилляров, ускоренная регенерация коллагена и повышенное выделение трансформирующего фактора роста (TGF-β1) [10].
В связи с вышесказанным изучение особенностей ответной реакции тканей на имплантацию в брюшную стенку сетчатых эндопротезов, покрытых PerClot, может быть перспективным с точки зрения герниологии, однако требует экспериментального исследования и гистологического заключения.
Цель исследования. Экспериментальное обоснование целесообразности использования полисахаридной системы PerClot для обработки полипропиленовой сетки при ее надапоневротической имплантации в брюшную стенку.
Материал и методы исследования. Исследование выполнялось на 18 кроликах породы шиншилла массой 1800–2200 г, разделенных на 2 группы. В основной группе животных выполняли следующее оперативное вмешательство: по срединной линии живота рассекались кожа и подкожная клетчатка, белая линия живота и передняя стенка влагалища наружных косых мышц освобождались путем отсепаровки кожно-жировых лоскутов в стороны от срединного разреза на расстояние 2,5 см. В созданное пространство помещался полипропиленовый сетчатый имплант Prolene размером 3,0х2,0 см и фиксировался к апоневрозу нитью Prolene 2/0, на поверхность импланта равномерным слоем наносился порошок PerClot, после чего слой порошка орошался физиологическим раствором до образования гелеобразного покрытия. Операционная рана кожи ушивалась одиночными узловыми швами, дренирование раны не производилось. В контрольной группе животных аналогичное оперативное вмешательство производилось без применения PerClot. Операции выполнялись в условиях стерильности под общей анестезией, проводимой с использованием внутривенного введения препарата Золетил 100. После операции кролики содержались в условиях вивария в клетках с сетчатым дном на стандартном пищевом режиме. В послеоперационном периоде проводилось динамическое наблюдение за состоянием послеоперационной раны, ежедневные перевязки. Выведение животных из эксперимента в сроки 7, 14 и 21 сутки осуществляли передозировкой наркотического препарата. Для гистологического исследования иссеченные участки брюшной стенки фиксировали в 10%-ном растворе нейтрального формалина, проводили через батарею спиртов возрастающей концентрации и заливали в парафин. Парафиновые срезы толщиной 5-7 мкм окрашивали гематоксилином-эозином и по методу Ван Гизона. Эксперимент проведен в соответствии с этическими принципами, установленными Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях (принятой Советом Европы в 1986 г.), одобрен Локальным этическим комитетом РостГМУ.
Результаты исследования и их обсуждение. В контрольной группе через 7 суток после имплантации полипропиленовой сетки в переднюю брюшную стенку имплант очагово фиксирован к апоневрозу, отмечается выраженный отек тканей и формирование жидкостных полостей (сером) без признаков их клеточной воспалительной инфильтрации. Организация импланта, его прорастание и обрастание варьирующим количеством фибробластов и тонкостенных сосудов происходит не на всем протяжении, неравномерно по глубине проникновения в ячейки сетки и по площади, что связано со структурой сетки и имеющимися жидкостными полостями (рис. 1). Сетчатый слой дермы отёчен, идет формирование жидкостных полостей и затёков.
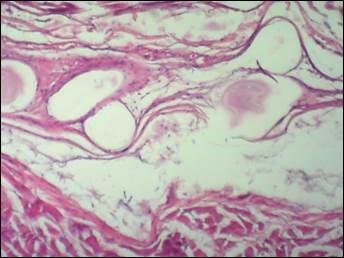
Рис. 1. Отслойка импланта от апоневроза формирующейся серомой (окраска гематоксилин-эозин, ув. х 40)
В основной группе через 7 суток после имплантации в брюшную стенку сетки, обработанной PerClot, организация импланта идет синхронно, на большей площади, с участием большего количества фибробластов, что свидетельствует о более быстрой и более качественной организации импланта; при обработке импланта PerClot несколько увеличивается адгезия импланта с прилежащими тканями, что ускоряет прорастание сосудов, уменьшает выраженность отека тканей, накопление жидкости и формирование сером; в организующемся импланте под слоем PerClot повышается плотность расположения фибробластов, а в самом слое PerClot определяются макрофаги и вертикально ориентированные к поверхности PerClot фибробласты. При использовании PerClot на 7-е сутки также формируются жидкостные полости (серомы), однако размер их и частота встречаемости меньше, чем в контрольной группе исследований (рис. 2).
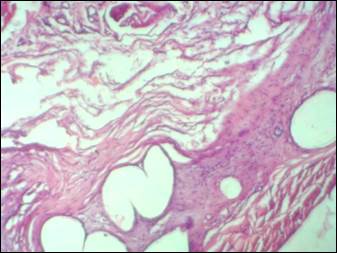
Рис. 2. Формирующиеся жидкостные полости (окраска гематоксилин-эозин, ув. х 40)
Через 14 суток в контрольной группе имплант фиксирован к апоневрозу на большем протяжении, однако отмечается неравномерно выраженная организация импланта соединительной тканью и разная степень зрелости последней. Между имплантом и сетчатым слоем дермы формируются серомы - округлые полости, заполненные оксифильными гомогенными массами с большим количеством разрушенных лизирующихся жировых клеток, увеличенные в объёме по сравнению с предыдущим сроком. В некоторых случаях, местами на границе сетчатого слоя дермы с жидкостью отмечаются скопления из 3-5 слоев продольно располагающихся фибробластов, что, возможно, дает повод говорить о сероме как о псевдокисте. Дерма остается отёчной, иногда в ней определяются затеки.
Через 14 суток в основной группе имплант сращен с апоневрозом на всем протяжении. Между имплантом и сетчатым слоем дермы встречаются небольшие, меньшие по объему, чем в контрольных исследованиях, серомы, выстланные PerClot (рис. 3). Отмечается повышенное количество фибробластов под слоем (параллельно поверхности) и в самом слое (перпендикулярно поверхности) PerClot (рис. 4). Между серомой и сетчатым слоем дермы формируются участки молодой соединительной ткани, участвующей в организации сером.

Рис. 3. Стенка серомы выстлана PerClot (окраска гематоксилин-эозин, ув. х 40)
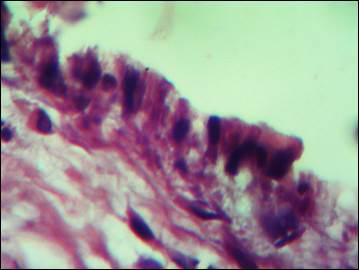
Рис. 4. Фибробласты и макрофаги в слое PerClot (окраска по Ван Гизону, ув. х 400)
Через 21 сутки в контрольной группе имплант организован и сращен с апоневрозом и сетчатым слоем дермы на большем протяжении, однако во всех случаях сформированы серомы округлой формы, размером 1-1,5 диаметра поля зрения малого увеличения микроскопа, стенкой которых является организованный (проросший и обросший соединительной тканью) имплант и уплотненный сетчатый слой дермы. Над серомой несколько уменьшена выраженность организации импланта, что уменьшает прочность его контакта с дермой.
Через 21 сутки в основной группе имплант окружен, а его ячейки заполнены соединительной тканью с нарастающим количеством коллагеновых волокон. Подобная волокнистая соединительная ткань соединяет имплант с прилежащими тканями - апоневрозом и сетчатым слоем дермы. Редко встречаемые небольшие жидкостные полости, размером до 1/4 диаметра поля зрения малого увеличения микроскопа, замещены молодой соединительной тканью (рис. 5). Организация импланта завершена. Имплант вживлен в стенку живота между апоневрозом и сетчатым слоем дермы.
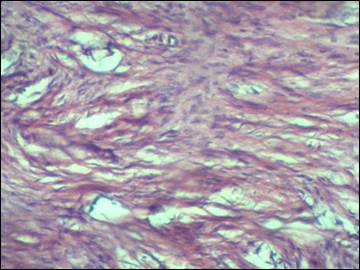
Рис. 5. Новообразованная соединительная ткань, заместившая серому (окраска гематоксилин-эозин, ув. х 40)
Выводы. Сравнительный анализ полученных данных показал, что при надапоневротической имплантации полипропиленовой сетки в брюшную стенку обработка импланта PerClot с учетом его сорбционной и адгезивной способностей уменьшает выраженность лимфореи, экссудации и отека, что снижает риск возникновения, частоту образования и размер сером, а также стимулирует увеличение количества фибробластов, что ускоряет организацию импланта и сером.
Таким образом, проведенное экспериментальное исследование доказывает возможность клинического применения и позволяет рекомендовать PerClot с целью снижения частоты имплант-ассоциированных послеоперационных раневых осложнений надапоневротической герниопластики и формирования оптимальной интеграции импланта в ткани организма.
Библиографическая ссылка
Черкасов М.Ф., Хиндикайнен А.Ю., Помазков А.А., Сулима В.И., Кушнарева О.Э. ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ СПОСОБА ПРОФИЛАКТИКИ ПОСЛЕОПЕРАЦИОННЫХ РАНЕВЫХ ОСЛОЖНЕНИЙ ГЕРНИОПЛАСТИКИ // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26391 (дата обращения: 12.03.2026).



