Взаимодействие между злокачественной опухолью и иммунной системой опухоленосителя может реализоваться в различных вариантах «иммуноредактирования» опухоли. Циркулирующие опухолевые клетки (ЦОК) считаются в настоящее время одним из важных механизмов метастазирования злокачественных опухолей, но они же могут нести опухолевые антигены и потенциально индуцировать иммунный ответ. К настоящему времени накоплен ряд данных о роли ЦОК в прогнозе течения некоторых злокачественных опухолей [2], в частности, он оказался возможным и при раке легкого (РЛ). Так, высокий уровень ЦОК коррелирует со сниженной общей выживаемостью при мелкоклеточном раке легкого (МРЛ); его изменения в динамике лечения также были прогностически ценными [6; 7]. Считается, что определение ЦОК при немелкоклеточном раке легкого (НМРЛ) может быть ограничено слабой экспрессией его клетками молекул EpCAM, на обнаружении которых основана система их выявления СellSearch. Ряд исследований доказывает, что частота обнаружения ЦОК при НМРЛ ниже, чем при МРЛ [3; 5]. Есть противоречивые сообщения о связи ЦОК с тяжестью опухолевого процесса при НМРЛ [4; 8]. Несмотря на то что ЦОК играют ключевую роль в метастатическом каскаде, в частности при РЛ, сведения об их возможном значении в процессе «иммуноредактирования» единичны. Между тем эти характеристики, как и особенности гистологического и молекулярного анализа [1], могут быть значимыми для уточнения прогноза и оптимизации лечения больных.
Цель исследования: изучить взаимосвязи между характеристиками клеточного иммунитета и количеством циркулирующих опухолевых клеток у больных мелкоклеточным и немелкоклеточным раком легкого при различной распространенности опухолей.
Материалы и методы исследования: изучали содержание ЦОК и показатели иммунного статуса у больных РЛ. Результаты анализировали в зависимости от распространенности (стадии), гистогенеза, количества ЦОК в крови. Обследовано 30 больных: 26 мужчин (86,7%) и 4 женщины (13,3%); средний возраст 62±1,3 года. Гистологическим типом у 20 больных (66,7%) был мелкоклеточный РЛ, представляющий собой нейроэндокринную опухоль (МРЛ/НЭО), у 10 больных (33,3%) НМРЛ (аденокарцинома). На момент установления диагноза у 13 больных (43,3%) была III, у 17 (56,7%) – IV стадия заболевания. У 25 больных (83,3%) был диагностирован центральный РЛ, у 5 (16,7%) – периферический РЛ. Среди пациентов с МРЛ подавляющее большинство составили мужчины – 19 из 20 (95%), в группе с НМРЛ было 3 женщины и 7 мужчин (30% и 70%). Средний возраст в обеих группах был идентичен: 62,2±1,6 и 62,8±2,2 года. Распределение по стадиям: в группе МРЛ у 13 больных (65%) была III, у 7 (35%) – IV стадия заболевaния; в группе с НМРЛ у всех 10 была диагностирована IV стадия. Среди пациентов с МРЛ у большинства был центральный рак – 18 больных из 20 (90%); в группе НМРЛ у 3 (30%) был периферический, у 7 больных (70%) центральный РЛ.
В крови больных до начала лечения определяли уровень ЦОК по технологии анализа в системе CellSearch System™ (Janssen Diagnostics, LLC) с микрочастицами железа, покрытыми антителами к маркерам адгезии эпителиальных клеток EpCAM, CD45 и цитокератинам 8,18,19. Качество работы оценивали с использованием стандартного контроля СТС control kit. Материал сканировали в анализаторе CellTracks® Analyzer II®. ЦОК регистрировали с учетом морфологических характеристик и экспрессии маркеров. Результаты выражали в абсолютном количестве ЦОК на 7,5 мл крови (объем пробы). В крови определяли субпопуляционный состав лимфоцитов на проточном цитометре FACSCantoII (BD): процент Т-В-NК-клеток, T-reg; CD4+ и CD8+ клеток, экспрессирующих активационные маркеры (CD69+, СD38+, CD25+, HLA-DR+ СD95+); «наивных» Т-лимфоцитов и Т-клеток памяти (CD45RA-/CD45RO+); среди NК-клеток определяли лимфоциты с различной экспрессией СD16 и CD56, а также экспрессирующие CD335, перфорин, гранзим В.
Статистический анализ результатов проводили с помощью программы STATISTICA 7.0 (StatSoft Inc., США) и пакета программ MicrosoftExcel (Windows XP): вычисляли среднюю, медиану, ошибку средней, достоверность различий (по критерию Стьюдента). Данные таблицы при сравнении по стадиям МРЛ представлены в виде M±m, а для оценки показателей иммунного статуса у больных МРЛ с различным уровнем ЦОК, ввиду малого количества данных, был применен непараметрический U-критерий Манна-Уитни.
Корреляционный анализ результатов исследования проводили с помощью программы STATISTICA 7.0 (StatSoft Inc., США): использовали вычисление коэффициента корреляции (r), силу прямых и обратных корреляционных связей по Пирсону.
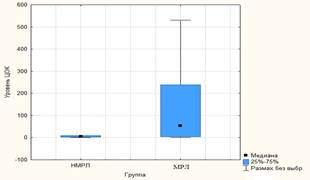
Результаты исследования: результаты представлены на рис. 1, 2 и в таблице. ЦОК были обнаружены у 27 больных (90%) в количестве от 1 до 6888, причем, как видно из рис. 1 А, Б, в группе МРЛ ЦОК выявлены у 17 больных (85%) в количестве 0-6888, среднее значение составило 655,7, медиана 38,5; в группе НМРЛ ЦОК найдены у всех 10 пациентов в количестве 1-486, среднее значение составило 57,2, медиана 5,0.
 А
А 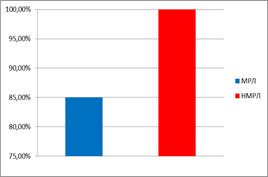 Б
Б
Рис. 1. Частота встречаемости (А) и уровни ЦОК (Б) у больных МРЛ и НМРЛ
При сравнении показателей иммунного статуса ЦОК+ больных РЛ разного гистогенеза установлено (рис. 2), что отмеченное выраженное преобладание уровня ЦОК при МРЛ сопровождалось более высоким содержанием CD3+СD4+ клеток с маркерами поздней активации (СD95+), а также CD3+СD4+ клеток с иммунофенотипом клеток «памяти» (84,4±2,4 и 72,2±3,7%; 73,2±4,1 и 64,7±3,5% соответственно, р<0,05). У этих же больных уровень CD3+СD8+HLA-DR+ лимфоцитов был выше, чем у больных НМРЛ (29,2±4,2 и 19,8±2,2% соответственно, р<0,05). У больных МРЛ обнаружены более низкие показатели индекса CD3+СD4+/CD3+СD8+ (1,4±0,1 и 1,9±0,3 соответственно, р<0,05), активированных CD3+СD4+ лимфоцитов, экспрессирующих CD38 (19,9±2,3 и 27,8±3,5% соответственно, р<0,05), и NK-клеток, способных к продукции интерферона-гамма (СD16dimCD56bright) (7,1±1,5 и 15,3±3,8% соответственно, р<0,05).
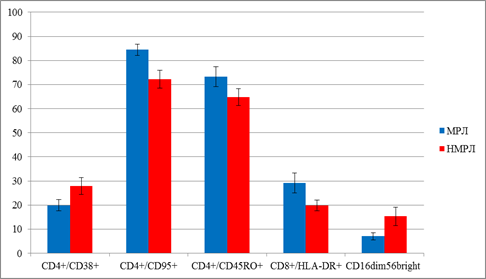
Рис. 2. Некоторые показатели иммунного статуса у больных МРЛ и НМРЛ (%)
При разделении больных с опухолями МРЛ/НЭО в зависимости от стадии был обнаружен более низкий уровень ЦОК при III стадии по сравнению с IV (таблица).
Сравнительная характеристика показателей иммунного статуса у больных МРЛ с различной распространенностью и уровнем ЦОК
|
Показатели, % |
Стадии |
Наличие ЦОК |
||
|
III |
IV |
U-критерий |
2-стороннее точное p |
|
|
ЦОК |
44,6±18,7 |
1616±952,7* |
- |
|
|
Лимфоциты |
20,2±1,6 |
22,6±1,9 |
21,5 |
0,689 |
|
Моноциты |
6,6±0,4 |
6,2±0,8 |
16,0 |
0,358 |
|
Гранулоциты |
72,2±1,6 |
70±2,6 |
25,0 |
1,000 |
|
CD3+ |
70,3±2,8 |
72,4±3,6 |
22,5 |
0,765 |
|
CD3+CD4+ |
36±1,9 |
37,5±2,9 |
14,0 |
0,258 |
|
T-reg (от CD4) |
7,6±1 |
9,5±1,5 |
17,5 |
0,416 |
|
CD3+CD4+CD45RA-СD45RO+ |
77,6±4 |
65,9±8,2 |
23,5 |
0,842 |
|
CD3+CD4+CD45RA+CD62L+ |
11±1,9 |
12,4±3,5 |
11,5 |
0,146 |
|
CD3+CD4+CD38+ |
17,7±2,6 |
23,4±4,4 |
2,0** |
0,007 |
|
CD3+CD4+HLA-DR+ |
15,6±2,7 |
8,4±1* |
14,0 |
0,258 |
|
CD3+CD4+CD25+ |
23±4,7 |
13,6±4,5* |
25,0 |
1,000 |
|
CD3+CD4+CD95+ |
89,8±1,9 |
75,8±3,5* |
22,0 |
0,765 |
|
CD3+CD4+CD69+ |
7,9±1,5 |
6,2±1,9 |
24,5 |
0,921 |
|
CD3+CD8+ |
30,6±3,1 |
29,9±3,5 |
22,5 |
0,765 |
|
CD3+CD8+CD45RA-CD45RO+ |
43,5±7,1 |
34±8 |
23,5 |
0,842 |
|
CD3+CD8+CD45RA+CD62L+ |
6,3±1 |
12,7±5,6 |
4,0** |
0,019 |
|
CD3+CD8+CD38+ |
31,3±8,1 |
17,5±4* |
13,0 |
0,216 |
|
CD3+CD8+HLA-DR+ |
34,4±6,1 |
20,8±3,6* |
3,0** |
0,012 |
|
CD3+CD8+CD25+ |
5,6±1,5 |
4,7±1,1 |
25,0 |
1,000 |
|
CD3+CD8+CD95+ |
85,9±2,5 |
84,7±2,6 |
24,0 |
0,921 |
|
CD3+CD8+CD69+ |
4,9±1,4 |
4,3±1,3 |
22,5 |
0,765 |
|
CD16/56+ |
21,3±2,5 |
17,3±3,5 |
16,0 |
0,358 |
|
CD3+CD16/56+ |
5,1±0,6 |
9,7±2,4* |
17,5 |
0,416 |
|
СD16dim56bright (от NK) |
6,8±2 |
7,8±2,3 |
19,5 |
0,634 |
|
СD16bright56dim (от NK) |
92,1±1,7 |
89,8±3,3 |
15,5 |
0,359 |
|
Granzyme B (от NK) |
85,1±1,9 |
65,2±10* |
22,5 |
0,765 |
|
CD335+ (от NK) |
40,3±6,6 |
30,2±7,6 |
23,5 |
0,842 |
|
CD19+ |
6,7±1,1 |
9,5±1,1* |
15,0 |
0,305 |
|
DN (CD3+CD4-CD8-) |
2,9±0,4 |
3,4±0,8 |
11,5 |
0,146 |
|
DP (CD3+CD4+CD8+) |
0,6±0,2 |
1,1±0,6 |
22,5 |
0,765 |
|
% фагоцитирующих гранулоцитов |
93,5±2,4 |
97,2±1,2 |
18,5 |
0,479 |
|
% фагоцитирующих моноцитов |
83,9±3,7 |
80,3±5,2 |
22,0 |
0,765 |
|
CD3+CD4+/CD3+CD8+ |
1,4±0,2 |
1,4±0,2 |
19,5 |
0,546 |
Примечание: * - статистически достоверные различия между показателями III и IV стадий; ** - статистически достоверные различия в зависимости от наличия ЦОК (р<0,05).
Как видно из таблицы, при IV стадии МРЛ количество ЦОК было выше, чем при III, что сопровождается статистически значимыми различиями ряда показателей клеточного иммунитета. Отмечено более высокое количество NKT- и В-лимфоцитов у больных IV стадии по сравнению с III стадией, наряду с более низким уровнем активированных Т-лимфоцитов как среди CD3+CD4+, так и среди CD3+CD8+ клеток, а также с маркерами ранней (CD38, CD25) и поздней (CD95, HLA-DR) активации. Кроме того, при IV стадии ниже, чем при III, было количество активированных натуральных киллеров, экспрессирующих Granzyme В.
Анализ выборки пациентов с наличием и отсутствием ЦОК у больных с МРЛ выявил достоверные различия по уровням активированных Т-лимфоцитов обеих основных субпопуляций (CD4+CD38+, CD8+HLA-DR), которые были ниже при наличии ЦОК; при этом уровень CD3+CD8+ лимфоцитов с фенотипом «наивных» клеток (CD8+CD45RA+CD62L+) у больных с ЦОК оказался выше.
Результаты корреляционного анализа позволили выявить ряд различий коэффициентов корреляции между показателями иммунного статуса больных МРЛ и НМРЛ с уровнем ЦОК. Так, при МРЛ отмечены прямая связь с уровнем ЦОК количества наивных СD4 клеток (r=0,5) и обратная – с уровнем CD3+CD4+ клеток памяти (r=-0,6) и активированных (CD3+СD4+CD95+) лимфоцитов (r=-0,7). Разнонаправленные связи выявлены между уровнем ЦОК и характеристиками функциональной активности NК-лимфоцитов, причем перфорин демонстрирует прямую сильную связь (r=0,9), а гранзим В – умеренную обратную (r=-0,6). НМРЛ характеризуется прямой связью уровня ЦОК с процентом CD3+, CD3+CD8+ клеток (r=0,8) и сильной обратной - с количеством CD3+CD8+ клеток памяти (r=-0,7). Показана корреляция уровня ЦОК с количеством активированных CD3+CD4+CD25+ лимфоцитов (r=0,6) и CD3+CD4+HLA-DR+(r=0,9), несмотря на обратную корреляцию с общим уровнем CD4+ клеток (r=-0,7) и ее отсутствие с Tregs. Уровень ЦОК при НМРЛ обратно коррелирует с активностью фагоцитарного звена, включая как нейтрофильный (r=-0,9), так и макрофагальный фагоцитоз (r=-0,5). Как при МРЛ, так и при НМРЛ уровень ЦОК обратно коррелирует с количеством Т-лимфоцитов памяти, хотя при МРЛ она выявлена с CD4+ (r=-0,6), а при НМРЛ – с CD8+ клетками (r=-0,7).
Рассмотрение корреляционных связей уровня ЦОК с иммунологическими показателями больных различных стадий позволило установить при III стадии отрицательные связи количества моноцитов (r=-0,5), фагоцитирующих гранулоцитов (r=-0,7) и активированных CD3+/CD4+/CD38+ (r=-0,5). При IV стадии выявлены отрицательные связи уровня ЦОК с процентом фагоцитирующих моноцитов (r=-0,8) и положительная – с количеством перфорин-содержащих натуральных киллеров (r=0,6).
Заключение
У обследованных больных РЛ выявляемость ЦОК с применением методики CellSearch® при НМРЛ/аденокарциномах была выше, чем при МРЛ/НЭО. Отмечено выраженное преобладание количества ЦОК при МРЛ по сравнению с НМРЛ и у больных генерализованным РЛ по сравнению с местнораспространенным. Выявлен ряд соответствий уровня ЦОК и показателей иммунного статуса, некоторые подтверждены корреляционным анализом. Как при МРЛ, так и при НМРЛ различия обнаруживались не в основных субпопуляциях Т, В, NK-клеток и не среди T-regs, а в субпопуляциях активированных Т-лимфоцитов, Т-клеток памяти, функционально активных NK-клеток.
Работа поддержана грантом РФФИ № 16-34-00244мол_а «Оценка взаимного влияния уровня циркулирующих опухолевых клеток и параметров иммунного статуса у больных раком легкого».
Библиографическая ссылка
Златник Е.Ю., Бахтин А.В., Новикова И.А., Селютина О.Н., Шульгина О.Г., Золотарёва Е.И., Черникова Е.Н., Бакулина С.М., Исаева Р.Г. ПОКАЗАТЕЛИ КЛЕТОЧНОГО ИММУНИТЕТА И КОЛИЧЕСТВА ЦИРКУЛИРУЮЩИХ ОПУХОЛЕВЫХ КЛЕТОК У БОЛЬНЫХ МЕЛКОКЛЕТОЧНЫМ И НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО ПРИ РАЗЛИЧНОЙ РАСПРОСТРАНЕННОСТИ И ГИСТОГЕНЕЗЕ ОПУХОЛЕЙ // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26375 (дата обращения: 01.02.2026).



