Дихлорэтан (ДХЭ), широко применяющийся в промышленности в качестве растворителя отравляющих веществ, для обезжиривания и чистки одежды, оказывает плейотропное повреждающее воздействие на организм человека [3; 13; 14]. Наиболее часто негативному влиянию ДХЭ подвергаются работники химических производств хлорорганического синтеза [3; 11]. При длительном воздействии даже незначительных доз ДХЭ отмечается негативное влияние на гепатобилиарную, нервную, эндокринную, иммунную системы, а также усиление процессов резорбции в костной ткани с формированием остеопении и остеопороза [4; 5; 8; 14]. Рядом авторов показана эффективность нанодисперсной аморфной формы кальция глюконата (Кальций-МАГа) для коррекции остеотоксического действия ДХЭ [5; 6; 9].
С другой стороны, актуальным остается поиск возможных путей коррекции иммуноповреждающего действия ДХЭ, вносящего существенный вклад в развитие инфекционных осложнений и смертность при интоксикации [3; 4; 8]. Особый интерес привлекает состояние полиморфноядерных лейкоцитов (ПМЯЛ), которые, являясь одной из универсальных мишеней токсического воздействия, выступают в качестве чувствительных индикаторов тканевого гомеостаза, чутко реагируют на разнообразные влияния факторов внешней среды и производственной деятельности [2; 7; 12]. Цитохимический анализ ферментных систем, изучение биоцидности ПМЯЛ позволяет оценить процессы клеточного метаболизма, их координацию при воздействии повреждающих агентов, эффективность проводимой коррекции этих нарушений, а также способствует пониманию механизмов адаптации и компенсации в организме [2; 7; 12].
Учитывая возможность эффективной коррекции Кальций-МАГом остеоповреждающего действия ДХЭ, представляется значимым изучить его влияние на иммунотоксическое влияние токсиканта. Кроме того, учитывая нефротоксичность ДХЭ, с одной стороны, а также важную роль в процессах остеосинтеза и известную иммуномодулирующую активность рыбьего жира (Рж) - с другой, большой интерес представляет влияние сочетанного применения Кальций-МАГа и Рж на состояние иммунной системы при интоксикации ДХЭ [3; 9; 11; 15].
В связи с этим нами изучено влияние нанодисперсной аморфной формы кальция глюконата — Кальций-МАГа (СаМАГ) и его комбинации с рыбьим жиром (Рж) на функциональную активность ПМЯЛ в условиях хронической интоксикации дихлорэтаном.
Материалы и методы исследования
Эксперименты выполнены на 60 белых половозрелых неинбредных крысах-самках массой 180-200 г. Животные были разделены на 4 группы: 1-я группа - контроль (интактные животные), 2-я группа – животные, получавшие ДХЭ, 3-я группа – животные, получавшие ДХЭ и Кальций-МАГ (ДХЭ+СаМАГ), 4-я группа – животные, получавшие ДХЭ, Кальций-МАГ и рыбий жир (ДХЭ+СаМАГ+Рж).
ДХЭ вводили животным внутрижелудочно ежедневно с помощью специального зонда в течение 60 дней из расчета 0,082 мг/100 г массы, в суммарной дозе 0,1 ЛД50 в оливковом масле [10]. Животные контрольной группы получали адекватный объем оливкового масла.
Кальций-МАГ (СаМАГ) вводили подопытным животным в оливковом масле в виде суспензии в дозе 253 мг/кг массы в день в течение последнего месяца опыта. В эксперименте использовали кальций-МАГ — механоактивированную аморфную форму кальция глюконата, полученного согласно патенту на изобретение [6]. По данным комплексного физико-химического анализа, после механоактивации (измельчения в энергонапряженном устройстве - активаторе) размер частиц составляет 50-300 нм, происходит переход исходного кристаллического порошка в рентгеноаморфное состояние [9]. Кальций-МАГ прошел государственную регистрацию, имеет сертификат № 77.99.23.3.У.8864.10.08, позволяющий использовать его для профилактических и лечебных целей.
Рыбий жир (Рж) вводили подопытным животным внутрижелудочно в дозе 0,05 мл/ 200 г крысы ежедневно в течение последних 30 дней опыта.
Животные содержались в стандартных условиях вивария с естественным световым режимом, на стандартной диете лабораторных животных (ГОСТР 50258-92), с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях, а также Правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 51000.4-96) согласно Приказу МЗ РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP).
Определяли количество лейкоцитов, нейтрофилов и лимфоцитов в периферической крови, интенсивность кислородзависимого метаболизма (индуцированный НСТ-тест), антимикробную активность ПМЯЛ в условиях функционирования и блокады (азидом натрия) кислородзависимых факторов микробицидности в отношении грибов Candida albicans, активность миелопероксидазы (МП), кислой фосфатазы (КФ), щелочной фосфатазы (ЩФ) и содержание катионных белков (КБ) в ПМЯЛ [12]. Результаты регистрировали на следующий день после окончания введения ДХЭ.
Статистическую обработку проводили с использованием методов вариационной статистики [1], пакета программ Statistica 8.0. Проверку на нормальность распределения данных выполняли с помощью критерия Шапиро-Вилка. Оценку значимости различий проводили, вычисляя медиану и межквартильный интервал. Дисперсионный анализ проводили с помощью Н-критерия Краскела-Уоллиса, для множественных сравнений использован Q-критерий Дана. Критический уровень значимости р для статистических критериев принимали равным 0,05. Данные в тексте представлены в процентах к контролю.
Результаты и обсуждение
Установлено, что длительное, в течение 60 дней, введение ДХЭ приводило к формированию лейкопении (число лейкоцитов снизилось до 71,93% по отношению к контролю, р=0,0015), преимущественно за счет снижения числа нейтрофилов (до 58,04%, р=0,0040) при уменьшении и числа лимфоцитов (до 72,60%, р=0,0034) (рис. A, B, C).
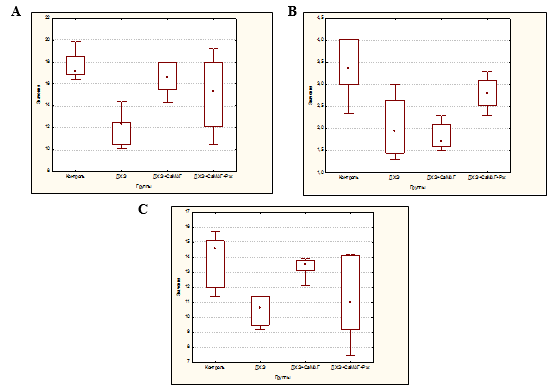
Влияние Кальций-МАГа и его комбинации с Рж на содержание лейкоцитов (A), нейтрофилов (B) и лимфоцитов у экспериментальных животных при интоксикации ДХЭ
Воздействие ДХЭ оказывало также негативное влияние на микробицидность ПМЯЛ. Наблюдалось угнетение как оксидантных, так и неоксидантных механизмов киллинга ПМЯЛ (индекс инактивации (ИИ) составил 74,55% и 66,49% соответственно). Отмечено снижение интенсивности образования активных форм кислорода (АФК) в ПМЯЛ при сохранении активности МП (табл. 1). Это свидетельствует о подавлении пероксидазонезависимых оксидантных факторов микробицидности ПМЯЛ. Угнетение кислороднезависимых механизмов фунгицидности нейтрофилов сопровождалось падением уровня катионных белков в них (табл. 1).
Интоксикация ДХЭ приводила к резкой активации кислой фосфатазы в ПМЯЛ: процент КФ-позитивных клеток увеличился на 70%, а СЦК – почти в 2 раза по сравнению с интактными животными (табл. 2).
Таблица 1
Влияние Кальций-МАГа и его комбинации с Рж на содержание миелопероксидазы и катионных белков в ПМЯЛ при интоксикации ДХЭ (в % к контролю)
|
Показатель |
ДХЭ |
ДХЭ+СаМАГ |
ДХЭ+СаМАГ+Рж |
|
|
Миелоперок-сидаза |
ПА |
82,35 [76,47 – 97,06] p1= 0.3611 |
70,59 [52,94 – 85,29] p1 = 0,0009 p2 = 1,0000 |
86,76 [79,41 – 97,06] p1 = 0,5052 p2 = 1,0000 p3 = 0,4536 |
|
СЦК |
81,91 [75,53 – 85,11] p1 = 0,0821 |
67,55 [61,70 – 77,66] p1≤ 0,00001 p2 = 0,2866 |
88,30 [80,85 – 92,55] p1 = 0,5262 p2 =1,0000 p3 = 0,0569 |
|
|
Катионные белки |
ПА |
59,18 [5306 – 69,39] p1≤ 0,00001
|
84,69 [74,49 – 89,29] p1 = 0,0009 p2 = 0,7672 |
97,96 [93,88 – 102,04] p1 = 1,0000 p2 = 0,0002 p3 = 0,1372 |
|
СЦК |
71,38 [50,00 – 73,91] p1 = 0,0015 |
88,41 [78,26 – 92,75] p1 = 0,9045 p2 = 0,4244 |
114,86 [109,06 – 122,83] p1 = 0,7777 p2 ≤ 0,00001 p3 = 0,0077 |
|
Примечание: достоверность отличий Р1 – от контроля, P2 – от ДХЭ, P3 – от ДХЭ+СаМАГ
ПА – процент активных ПМЯЛ, СЦК - средний цитохимический коэффициент
Повышение активности КФ может быть обусловлено повреждающим воздействием и коррелирует с временем экспозиции токсических факторов [12]. Разнонаправленное изменение активности МП и КФ, выявленное в наших исследованиях, может свидетельствовать о нарушении взаимосвязи и сопряженности гранулярных ферментативных процессов, отражать нарушение функционального состояния клетки, и прежде всего ее микробоцидного потенциала [2; 12].
При изучении активности ЩФ была выявлена тенденция к снижению процента ЩФ-положительных клеток, в то время как СЦК не отличался от контроля (табл. 2).
Применение Кальций-МАГа как индивидуально, так и в комбинации с Рж нормализовало уровень лейкоцитов в периферической крови (число лейкоцитов составило 97,08% (p=1,0000) и 89,47% (p=0,9454) соответственно). В случае изолированного использования Кальций-МАГа это достигалось преимущественно за счет повышения числа лимфоцитов (до 92,47%, p=1,0000), а в комбинации с Рж наблюдалось равномерное увеличения числа нейтрофилов (до 83,33%, p=1,0000) и лимфоцитов (до75,34%, p=0,2818) (рис. A, B, C).
Таблица 2
Влияние Кальций-МАГа и его комбинации с Рж на активность кислой и щелочной фосфатазы в ПМЯЛ при интоксикации дихлорэтаном (в % к контролю)
|
Показатель |
ДХЭ |
ДХЭ + Кальций-МАГ |
ДХЭ + Кальций-МАГ + Рж |
|
|
Кислая фосфатаза |
ПА |
173,58 [158,49 – 188,68] p1 ≤ 0,00001 |
124,53 [103,77 – 133,96] p1 = 0,8355 p2 = 0,0013 |
139,62 [132,08 – 150,94] p1 = 0,0014 p2 = 0,9002 p3 = 0,3742 |
|
СЦК |
195,49 [153,38 – 209,02] p1 = 0,00002 |
109,77 [100,00 – 153,38] p1 = 1,0000 p2 =0,0043 |
153,76 [148,12 – 157,52] p1 = 0,0064 p2 = 1,0000 p3 = 0,2456 |
|
|
Щелочная фосфатаза |
ПА |
69,23 [53,85 – 86,81] p1 = 0,6515 |
28,57 [16,48 – 43,96] p1= 0,0029 p2 =0,7457 |
92,31 [72,53 – 105,49] p1 = 1,0000 p2 = 1,0000 p3 = 0,0225 |
|
СЦК |
81,67 [66,67 – 85,00] p1= 1,0000 |
43,33 [26,67 – 55,00] p1= 0,0206 p2 =0,5199 |
100,0 [83,33 – 123,33] p1 = 1,0000 p2 = 1,0000 p3 = 0,0074 |
|
Примечание: достоверность отличий Р1 – от контроля, P2 – от ДХЭ, P3 – от ДХЭ+СаМАГ
ПА – процент активных ПМЯЛ, СЦК - средний цитохимический коэффициент
Использование Кальций-МАГа не устраняло депрессию токсикантом кислородзависимых механизмов киллинга ПМЯЛ (КОЕ - 135,29% (p=0,0174), ИИ - 78,57%).
Кальций-МАГ восстанавливал интенсивность образования АФК в ПМЯЛ (индуцированный НСТ-тест): процент активных клеток составил 125,0% (р=1,0000), а индекс активации – 116,67% (р=0,1669). Однако цитохимически было выявлено статистически значимое снижение активности МП в ПМЯЛ (табл. 1). Полученные данные свидетельствуют о восстановлении активности пероксидазонезависимых механизмов оксидантного киллинга нейтрофилов.
Сочетанное применение Кальций-МАГа и Рж полностью устраняло негативное влияние ДХЭ на активность оксидантных микробицидных систем ПМЯЛ (ИИ составил 86,61%), что достигалось восстановлением как пероксидазозависимых, так и пероксидазонезависимых механизмов биоцидности нейтрофилов (табл. 1).
В условиях же блокады оксидантных факторов микробицидности использование Кальций-МАГа и его комбинации с Рж восстанавливало активность неоксидантных механизмов киллинга нейтрофилов (ИИ составил 86,73% и 90,27% соответственно), что сопровождалось повышением уровня КБ в ПМЯЛ (табл. 1).
Применение Кальций-МАГа полностью устраняло активацию КФ, вызванную токсикантом (табл. 2), что может быть обусловлено нормализующим влиянием Кальций-МАГа на проницаемость клеточных и субклеточных мембран нейтрофилов. В то же время активность ЩФ в группе животных, получавших Кальций-МАГ, была снижена (табл. 2).
Совместное применение Кальций-МАГа и Рж ослабляло, но не устраняло активацию КФ в нейтрофилах, в то время как активность ЩФ не отличалась от таковой у интактных животных (табл. 2).
Выводы
Таким образом, использование Кальций-МАГа, эффективного средства коррекции остеопении и остеопороза при хронической интоксикации ДХЭ [5], и его комбинации с Рж существенно уменьшает негативное влияние ДХЭ на количественные и качественные показатели функциональной активности ПМЯЛ: устраняет лейкопению, восстанавливает интенсивность кислородзависимого метаболизма, улучшает микробицидную способность, нормализует ряд показателей метаболической и ферментативной активности этих клеток. Большая эффективность выявлена при сочетанном использовании препаратов коррекции.
Библиографическая ссылка
Муфазалова Н.А., Меньшикова И.А., Камилов Ф.Х., Муфазалова Л.Ф., Ахмадуллина Г.Х. ВЛИЯНИЕ НАНОДИСПЕРСНОЙ АМОРФНОЙ ФОРМЫ КАЛЬЦИЯ ГЛЮКОНАТА И ЕЕ КОМБИНАЦИИ С РЫБЬИМ ЖИРОМ НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ НЕЙТРОФИЛОВ ПРИ ИНТОКСИКАЦИИ ДИХЛОРЭТАНОМ // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26358 (дата обращения: 20.12.2025).



