Рак прямой кишки продолжает оставаться одной из наиболее актуальных проблем в современной онкологии. Он занимает положение в десятке наиболее часто встречаемых злокачественных опухолей – 5 место у мужчин и 6–7 место у женщин. Увеличение за последние 10 лет удельного веса колоректального рака в общей структуре злокачественных заболеваний в мире с 9 % до 13 % является очевидным этому подтверждением [2].
Имеются данные об эндо- и экзогенных факторах, оказывающих влияние на весь организм и его подсистемы в концепции канцерогенеза колоректального рака. Отмечено действие на орган-мишень, клеточный аппарат и микроокружение. В дальнейшем развиваются генетические мутации и неконтролируемая пролиферация клеток [8]. Особое значение имеет микроокружение в формировании колоректального рака и роль иммунологического ответа опухоли и макроорганизма [3].
Отправной точкой приложения начальной реализации опухолевых изменений являются эпителиальные клетки слизистой оболочки, разнородные по составу и функции [10]. На подавление опухолевого роста и направлена лучевая терапия. Она способствует также и подавлению циркулирующих опухолевых клеток, значению которых при колоректальном раке в последние годы уделяется большое внимание [4].
Современные технологии лучевой терапии позволяют получить высокий ответ на проводимое лечение (полная регрессия опухоли), уменьшение частоты и интенсивности острых лучевых повреждений: тяжелого раннего токсического мукозита (3–4 степени), использование объемно-модулированной лучевой терапии арками (VMA – Rapid.Arc) позволяет уменьшить время проведения одного сеанса лучевой терапии по сравнению с IMRT с 20 до 3–5 минут [6]. Химиолучевое лечение в предоперационном периоде приводит к увеличению сфинктеросохраняющих операций без увеличения числа послеоперационных осложнений, возможность получить в ряде наблюдений (до 16,6 % пациентов) полный гистологический ответ [9].
Работы последних лет убеждают, что при облучении в режиме динамического фракционирования дозы наблюдали менее выраженные лучевые реакции, как во время лечения, так и при его завершении. Повышение суммарной дозы с добавлением радиомодификаторов увеличивает частоту полных ответов при приемлемом уровне токсичности. При этом отмечено уменьшение болевого синдрома, купирование кровотечений [1,5].
Подход к лечению рака прямой кишки является мультидисциплинарным. Хирургия рака прямой кишки включает в последние годы следующие моменты: сохранение функции без ухудшения онкологических результатов и применение все более расширенных хирургических вмешательств. Лучевая или химиолучевая терапия при различных методиках фракционирования убедительно доказывает свою целесообразность [7].
Все вышеизложенное дало основание провести исследование по сопоставлению результатов лечения пролонгированной лучевой терапии и короткого курса.
Целью исследования явился анализ результатов предоперационной лучевой терапии рака прямой кишки при пролонгированном и коротком курсе.
Для решения вопроса о преимуществах короткого и пролонгированного курса лучевой терапии нами были проанализированы ретроспективные данные о 119 пациентах с резектабельным локализованным и местно-распространенным раком прямой кишки, прошедшим лечение в РНИОИ с применением современных технологий с 2013 по 2015 год.
Были поставлены следующие задачи:
- изучить переносимость пациентами лечения;
- сравнить объемы хирургических вмешательств и число послеоперационных осложнений;
- изучить непосредственные и отдаленные результаты лечения.
Больные были разделены на две группы: 67 пациентам проведена предоперационная пролонгированная химиолучевая терапия и 52 пациентам проведен предоперационный короткий курс лучевой терапии (РОД 5 Гр, 5 фракций, СОД 25 Гр). Распределение больных по полу и возрасту было сопоставимо. В группе с пролонгированным курсом ЛТ превалировали пациенты с пораженными л/узлами – почти 63 %. По гистологическому типу опухоли были представлены в большинстве случаев умеренно дифференцированной аденокарциномой. Проводилась оценка переносимости данных вариантов лечения.
Материалы и методы исследования. В объем облучения включали область первичного очага и зоны регионарного метастазирования. То есть в объем GTV включалась опухоль, удаляемая во время операции, а в объем CTV-мезоректум (регионарные л/у). Точность воспроизведения условий лучевой терапии контролировалась с помощью систем визуализации и набора устройств для иммобилизации пациента. Преимуществом 3D перед 2D планирования являлось более оптимальное дозное распределение, где максимум облучения приходится на орган мишень, после чего идет значительный спад дозы, позволяющий снизить нагрузку на окружающие органы и ткани и уменьшить риск токсических явлений. Результаты терапии в дальнейшем оценивали с применением эндоскопических, МРТ, морфологических методов исследования. Проводилась ДНК-цитометрия в удаленной опухоли. В дни лучевой терапии проводили химиотерапию. В дни лучевой терапии назначали капецитабин 1650 мг/м² внутрь. Облучение выполнялось на ускорителе 6 МэВ Unique фирмы «Varian», РОД 2 Гр, СОД 50 Гр. После облучения через 6–8 недель выполняли хирургическое вмешательство. Короткий курс лучевой терапии проводился 5 дней, РОД 5 Гр., СОД 25 Гр. Хирургическое лечение выполнялось через 1–5 дней после окончания лучевой терапии. За 2013–2015 годы в отделении радиологии было пролечено 354 пациента с раковыми опухолями прямой кишки.
Результаты и их обсуждение. В период проведения неоадъювантного лечения все пациенты удовлетворительно переносили назначенный курс, во всех случаях ЛТ была завершена в запланированном объеме. После окончания пролонгированного курса лучевые реакции наблюдались чаще и были более выраженными: в 64 % после пролонгированного курса и в 36,5 % после короткого. Однако через 6–8 недель наблюдалось купирование реакций и непосредственно к операции больные подходили с минимальным количеством их проявлений и отмечались реже в два раза, чем после короткого курса. При оценке лейкопении и анемии, в группе с пролонгированным курсом больные исходно были с худшими показателями крови: 15 % и 5,8 % соответственно. Но на фоне сопроводительной терапии и уменьшении кровотечений из прямой кишки на конец лечения состояние больных не ухудшилось. А после перерыва лейкопения и анемия III степени не отмечены. Клинический эффект от проводимой ХЛТ выражался, как правило, в значительном уменьшении, а в ряде случаев полном исчезновении, клинических симптомов опухолевого поражения прямой кишки. Наибольшая положительная динамика отмечена в группе с пролонгированным курсом в виде уменьшения болей и уменьшения кровянистых выделений. Одной из основных целей пролонгированного курса ХЛТ являлось уменьшение размеров опухоли прямой кишки.
При выполнении эндоскопического исследования после проведения пролонгированной лучевой терапии через 6–8 недель отмечалось уменьшение экзофитного компонента опухоли, вплоть до образования язвы, уменьшения протяженности опухоли и увеличение диаметра просвета прямой кишки. В группе с коротким курсом отмечался отек слизистой оболочки и незначительное уменьшение опухоли.
В группе больных с раком прямой кишки, которым проводилась пролонгированная лучевая терапия, протяженность опухоли уменьшилась в 1,7 раза. Расстояние от ануса до нижнего края опухоли увеличилось с 6,3 см до 7,6 см. А при проведении короткого курса лучевого лечения протяженность опухоли и расстояние до нижнего края опухоли остались прежними или изменения расстояния не происходило. В группе с локализацией опухоли в нижнеампулярном отделе после пролонгированного курса лучевой терапии в процессе лечения медиана расстояния от Z-линии увеличивалась в 2,5 раза, что давало возможность обеспечить условия для выполнения большего числа сфинктерсохраняющих вмешательств. По данным МРТ-исследования лечебный патоморфоз выражался в виде уменьшения опухоли и нарастания фиброзной ткани, увеличение расстояние от края опухоли до мезоректальной фасции, в сокращении метастатических л/у. При оценке клинических результатов по данным МРТ-исследования через 6–8 недель после завершения ХЛТ полный клинический регресс был достигнут у 14,9 % пациентов. Частичный регресс выявлен в 56,7 % случаев, стабилизация в 28,4 %. После завершения курсов лучевой терапии, как пролонгированной, так и короткофокусной выполняли оперативные вмешательства. При сравнении объемов оперативного вмешательства у больных с локализацией опухоли в нижнеампулярном отделе сфинктеросохраняющие операции в группе с пролонгированной химиолучевой терапией были выполнены в 26 % случаев, в группе с коротким курсом в 6 %. В процессе выполнения хирургического этапа лечения каких-либо особенностей в сравниваемых группах не отмечено. При анализе особенностей послеоперационного периода общее количество осложнений в сравниваемых группах практически не отличалось – 15,6 % и 13,5 % соответственно.
Таким образом, проведение различных вариантов предоперационного лечения не выявило различий влияния на течение репаративных процессов. Доказательством проводимой терапии явилось морфологическое исследование операционного материала. Морфологические изменения в группе больных с коротким курсом сводились к некробиотическим и дистрофическим процессам в опухоли, незначительной десмопластической реакции стромального компонента. Сохранялся высокий пролиферативный (Ki-67) и апоптический (p 53) потенциал опухоли. Патоморфоз опухоли на проводимое лечение I–II степени достигал 95 %.
Длительный курс ХЛТ вызывал в опухоли значительные изменения, которые заключались в некробиотических и дистрофических и апоптатических процессах, выраженной воспалительной реакции, обширных очагах развития фиброзной ткани на месте опухоли, замещающей паренхиматозный компонент. Маркер пролиферативной активности Ki 67 и апоптотический индекс Р53 были снижены (рис.1).
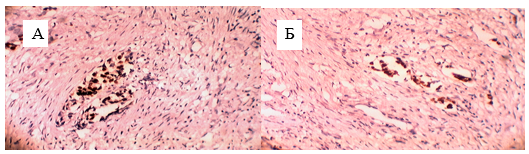
Рис. 1. Патоморфоз после пролонгированного курса: А – экспрессия Ki-67,
Б – экспрессия Р 53
В фиброзной ткани наблюдали образование петрификатов. (рис. 2). Патоморфоз достигал IV степени в 17 % наблюдений и в 72 % случаев – III степени.
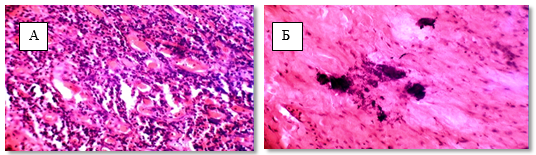
Рис. 2. Патоморфоз после пролонгированного курса: А – 4 степень стромальный компонент, Б – 4 степень петрификаты
Учитывая сроки проведения операции после крупных фракций, незначительное повреждающее действие лучевой терапии, была проведена ДНК-цитометрия.
Исследование ДНК-цитометрии удаленных во время операции опухолей прямой кишки, показало значительное снижение злокачественного потенциала опухоли после крупнофракционной лучевой терапии, определяемое по достоверному снижению темпа пролиферации клеток опухоли вследствие снижения доли клеток в S-фазе и снижению в 1,6 раза индекса пролиферации опухоли.
После пролонгированной лучевой терапии не обнаружено столь выраженных изменений при ДНК-топометрическом анализе, что, вероятно, обусловлено исследованием через 6–8 недель после окончания лечения. К этому времени, по всей видимости, уже происходит восстановление пролиферативной активности оставшихся после лучевой терапии опухолевых клеток. Эти данные свидетельствуют о недопустимости превышения интервалов между этапами лечения.
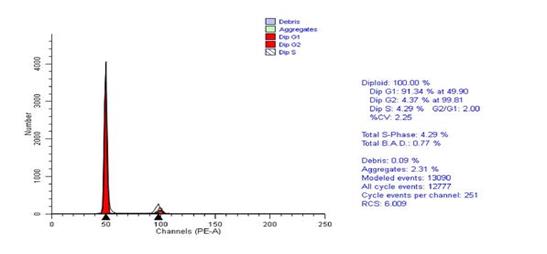
Рис.3. Гистограмма распределения по фазам клеточного цикла. Короткий курс
о недопустимости превышения интервалов между этапами лечения.
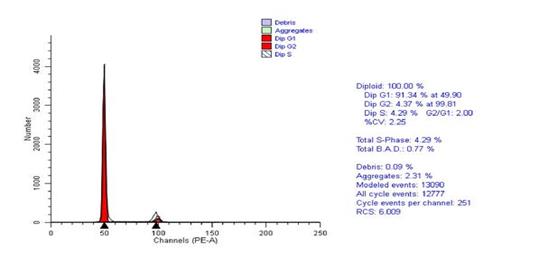
Рис. 4. Гистограмма распределения по фазам клеточного цикла. Пролонгированный курс
Общее число рецидивов в группе с пролонгированной ЛТ составило 6,25 %, в группе с коротким курсом 6,5 %.
Больше половины рецидивов в обеих группах составили опухоли, локализующиеся в нижнеампулярном отделе. Из пациентов с опухолями нижнеампулярного отдела в группе с пролонгированной лучевой терапией (27 пациентов) отмечено 7,4 % рецидивов. В группе с коротким курсом лучевой терапии в 11,8 % случаев отмечены рецидивы с опухолями нижнеампулярного отдела в сроки от 12 до 15 месяцев. В этих наблюдениях у больных были опухоли с исходными метастазами в регионарных л/у. Отдаленные метастазы были диагностированы у 4,7 % пациентов в группе с ПЛТ, у 6,5 % в группе с КЛТ в сроки от 13 до 35 месяцев. Все пациенты имели подтвержденные исходно метастазы в регионарных лимфатических узлах.
Несмотря на тенденцию к увеличению применения неоадъювантной пролонгированной ХЛТ, короткий курс лучевой терапии не дает худшие результаты лечения. Последнее обстоятельство находит свои доказательства в отсутствии существенных различий в показателях безрецидивной выживаемости и отдаленного метастазирования, послеоперационных осложнений. Дифференцированное применение того или иного подхода зависит от целей предоперационного лечения.
Заключение. Таким образом, проведенное исследование позволяет сделать следующее заключение о целесообразности применения того или иного курса предоперационного лечения.
Пролонгированная лучевая терапия показана:
- Пациентам с опухолями, требующим регресса.
- Пациентам с опухолями, локализующимися в нижнеампуллярном отделе, так как дает возможность проведения сфинктеросохраняющих операций и отмечается меньшее количество рецидивов при данной локализации.
- Пациентам с Т4, а также при пораженных лимфатических узлах с любым Т.
Короткий курс крупнофракционной лучевой терапии показан:
- Пациентам с опухолями Т3N0, не требующим регресса, когда предоперационной лечение не может повлиять на объем хирургического вмешательства.
- Пациентам, которым невозможно проведение пролонгированного курса.
Библиографическая ссылка
Гусарева М.А., Розенко Л.Я., Непомнящая Е.М., Новикова И.А., Ульянова Е.П. НЕОАДЪЮВАНТНАЯ ЛУЧЕВАЯ ТЕРАПИЯ РАКА ПРЯМОЙ КИШКИ // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26352 (дата обращения: 07.01.2026).



