Актуальность. Хирургическое лечение вертикально- и ротационно-нестабильных повреждений таза, а также позвоночно-тазовых диссоциаций на сегодняшний день остается актуальной проблемой травматологии и ортопедии. Золотым стандартом в стабилизации задних отделов таза является фиксация илиосакральными винтами, которая отличается малоинвазивностью и низкой травматичностью, относительной технической простотой исполнения и широким диапазоном показаний [5-7; 26]. Классическая технология введения илиосакральных винтов, предложенная в конце 80-х годов и доработанная в 90-х годах, предполагает использование рентгенологического контроля положения направляющей спицы и илиосакрального винта в четырёх стандартных проекциях: передне-задняя (обзорная) рентгенография таза, косые проекции: inlet и outlet, а также боковая проекция крестца [16; 22-24]. Однако наряду с положительными сторонами этого метода выход винта за пределы безопасной зоны и развитие таких осложнений, как повреждение корешков спинного мозга, продолжают оставаться частыми явлениями. По данным разных авторов, осложнения составляют от 6 до 20% [10; 12; 15; 24; 25]. Это связано с наличием ограниченной безопасной зоны для введения винтов и со сложностью ориентации вследствие индивидуальной геометрии крестца, прежде всего вследствие наличия слепых зон, таких как скаты боковых масс I крестцового (S1) позвонка; спинальный канал и корешковые каналы имеют изогнутую форму, визуализировать которые зачастую не представляется возможным. Кроме того, вогнутость передней поверхности крестца может послужить причиной затруднения интраоперационной ориентации по двумерным проекциям из-за присутствия на экране C-дуги нескольких теней, вводящих хирурга в заблуждение относительно истинных границ безопасной зоны [2; 17; 18]. Риск некорректного расположения илиосакральных винтов возрастает при дисморфии крестца [19], недостаточной репозиции [20], введении винта во S2 позвонок [9] и в случаях двухстороннего илиосакрального блокирования, когда уже введённый винт является препятствием для направляющей спицы. Все перечисленные причины делают безопасную зону для введения винтов узкой [10]. Компьютерная навигация и интраоперационная компьютерная томография (O-дуга) позволяют повысить точность проведения илиосакральных винтов и снизить риск осложнений [3; 4; 8; 13]. Однако эти методы не лишены своих недостатков, ключевым из которых является необходимость применения дорогостоящего оборудования и специально обученного персонала, вследствие чего указанные методы пока недоступны для большинства больниц, оказывающих помощь пациентам с повреждениями таза [14]. На сегодняшний день основным методом навигации при проведении илиосакральных винтов остаётся интраоперационная флюороскопия [5-7]. В последние годы появился ряд публикаций, авторы которых предлагают пересмотреть углы наклона рентгеновской трубки при выведении проекций inlet и outlet. Так, W.M. Ricci с соавторами (2010) измерили углы наклона клинически важных анатомических образований таза у 68 пациентов. Они определили средние значения углов наклона C-дуги для визуализации соответствующих образований, которые составили 25° каудального наклона (относительно вертикали) для проекции inlet и 60° краниального наклона для проекции outlet [21]. Graves M.L. и Routt M.L. Jr. (2011), выводя во время операции «идеальные», на их взгляд, проекции inlet и outlet и измеряя полученный угол наклона трубки, по результатам серии из 10 операций вычислили среднее значение для проекции inlet - 25°, а для проекции outlet – 42° [11]. Многие авторы между тем продолжают связывать значительный риск осложнений при илиосакральном блокировании с высокой вариабельностью формы крестца [2; 17; 19]. Большое разнообразие вариантов анатомического строения крестца и его пространственного расположения, по нашему мнению, не позволяет определить усреднённые значения для проекций inlet и outlet.
Цель исследования: разработать новую технологию навигации для илиосакрального блокирования с использованием интраоперационной флюороскопии в индивидуальных проекциях.
Материалы и методы. Изучена точность установки илиосакральных винтов и частота послеоперационных неврологических осложнений у 51 пациента, которым было проведено оперативное лечение повреждений таза, включающее введение илиосакральных винтов. Из исследования были исключены пациенты, которым илиосакральные винты вводились в условиях фиксации таза циркулярным аппаратом (в связи с трудностями выведения индивидуальных проекций, создаваемыми конструкциями аппарата), также исключались пациенты с остаточным вертикальным смещением половины таза на 1 см и более, пациенты с дисморфией крестца и случаи введения илиосакральных винтов в SII позвонок.
В выбранной группе вертикально-нестабильные повреждения наблюдались в 17 случаях в виде переломов боковой массы крестца, в 2 случаях – в сочетании с разрывом крестцово-подвздошного сочленения (в одном дополнительно с переломом задней подвздошной ости), в 1 случае отмечалось двустороннее повреждение с ротационно-нестабильным разрывом крестцово-подвздошного сочленения со второй стороны по типу «открытой книги».
Ротационно-нестабильные повреждения наблюдались у 27 пациентов (в 8 случаях – двусторонние) и были представлены:
а) повреждениями по типу «открытой книги» в 15 случаях - у 12 пациентов имели место разрывы крестцово-подвздошных сочленений, включая 3 двусторонних, 1 – с отрывным переломом задней подвздошной ости; у 3 пациентов переломы крестца, включая 2 косых перелома крестца и 1 трансфораминальный в сочетании с разрывом крестцово-подвздошного сочленения со второй стороны;
б) повреждениями по типу «закрытой книги» в 10 случаях (у 2 пациентов – имелись переломы подвздошной кости, у 8 пациентов – компрессионные переломы боковой массы крестца (у 4 пациентов из указанных 8 – с сагиттальным смещением по типу «оторванной ручки корзинки»), в 2 случаях повреждения таза от бокового сжатия сочетались с позвоночно-тазовой диссоциацией в виде U-образного перелома крестца (они также признавались двусторонними));
в) у двух пациентов имелись разнонаправленные двусторонние ротационно-нестабильные повреждения по типу «смятой книги».
Чистая позвоночно-тазовая диссоциация без повреждения передних отделов тазового кольца была выявлена у 4 пациентов и представлена в 3 случаях U-образными переломами крестца и в 1 случае H-образным переломом крестца.
Также у 3 пациентов с вертикальными деформациями таза перед остеосинтезом циркулярным аппаратом было выполнено илиосакральное блокирование со здоровой стороны для предупреждения ятрогенного повреждения интактного крестцово-подвздошного сочленения во время коррекции вертикального смещения в аппарате.
27 пациентов из 51 имели давность травмы более 3 недель.
51 пациенту было установлено 80 винтов, 10 пациентам выполнено двустороннее илиосакральное блокирование, 18 пациентам было введено по 2 винта в каждую повреждённую сторону (у 4 пациентов – по 2 винта с каждой стороны).
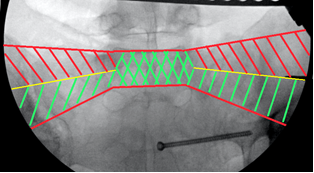
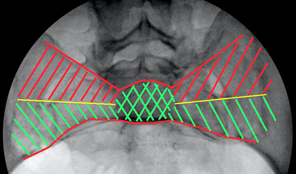
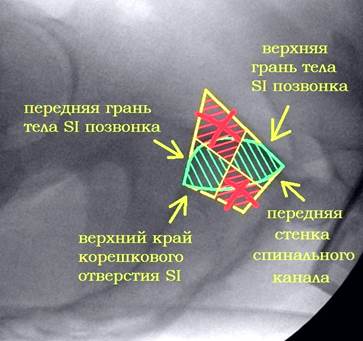
Для снижения риска выхода винтов за пределы безопасной зоны нами был разработан и применён способ навигации, основанный на индивидуализированной интраоперационной флюороскопической визуализации крестца (пат. 2584557 РФ) [1]. Использовались следующие ориентиры: 1 – передняя поверхность тела SI позвонка и его боковых масс – передняя проекция SI («истинный inlet») (рис. 3А, 6А). 2 – задняя поверхность тела SI позвонка или передняя стенка спинального канала на уровне верхней трети SI позвонка – задняя проекция SI («вход в спинальный канал», «спинальный inlet») (рис. 3Б, 6Б). 3 – верхняя кортикальная пластинка тела SI позвонка – верхняя проекция SI («истинный outlet») (рис. 3В, 6В). Перечисленные анатомические образования вместе с верхней стенкой переднего корешкового отверстия S1 позвонка, визуализируемой на проекции outlet, являются одновременно и границами безопасной зоны для введения винта, и важными ориентирами для навигации, поэтому их визуализация принципиальна для контроля положения винта.
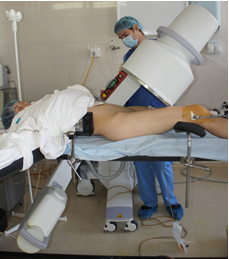
Описание технологии навигации. После выполнения анестезии и окончательной укладки пациента на операционном столе непосредственно перед процедурой введения илиосакральных винтов выполняли рентгенографию (флюороскопию) крестца в боковой проекции. Для этого C-дугу располагали сбоку от операционного стола строго перпендикулярно продольной оси крестца, правильность выведения боковой проекции проверялась по форме верхней грани тела SI позвонка и нижней грани тела LV позвонка (при отсутствии деформации в сегменте LV-SI). Смежные грани каждого из указанных позвонков должны были складываться в прямую линию. Кроме этого, обращалось внимание на концентричность контуров больших седалищных вырезок (при отсутствии деформации тазового кольца). На боковой проекции визуализировали контуры крестца: переднюю поверхность тела SI позвонка, переднюю стенку спинального канала на уровне верхней трети SI позвонка и верхнюю кортикальную пластинку тела SI позвонка. По боковой проекции крестца измеряли углы наклона указанных контуров поверхностей крестца относительно горизонтали. В качестве измерительного прибора в большинстве случаев использовали электронный уклономер и механический уклономер, собранный из планки и шкалы с отвесом от акушерского тазомера (рис. 1 А, Б). Также для этой цели был опробован смартфон, оснащённый гироскопом и соответствующим программным обеспечением (рис. 1В).
|
|
|
|
|
А |
Б |
В |
Рис. 1. Устройства для измерения углов: А – электронный уклономер, Б – механический уклономер, В – смартфон с гироскопом
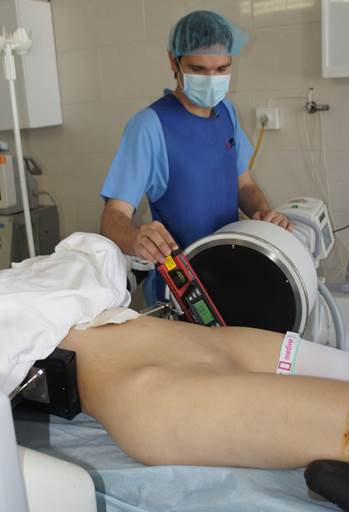
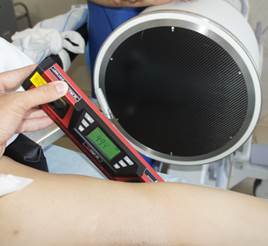
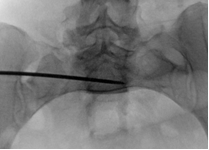
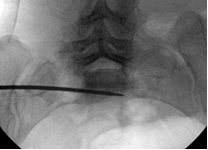
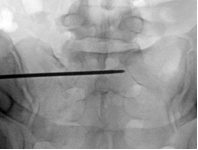
Для измерения углов уклономер помещался в поле зрения электронно-оптического преобразователя сбоку от таза (рис. 2 А-В). Его рентгенологическая тень накладывалась на тень крестца, при этом достигалось строго параллельное расположение рентгенопозитивной грани уклономера и соответствующего контура крестца, угол наклона которого измерялся (рис. 3 А-В), после чего считывали и записывали показания прибора.
Непосредственно перед введением илиосакрального винта с помощью уклономера в соответствии с полученными результатами измерений последовательно выводились три индивидуальные проекции (рис. 4 А-В). Угол наклона C-дуги для каждой проекции отмечался съёмными метками на шкале (рис. 5 А-В). Метки маркировались буквенными обозначениями: метка «В» соответствовала верхней грани тела SI позвонка (верхней проекции SI), «П» – передней грани тела SI позвонка (передней проекции SI), «З» – задней поверхности тела SI позвонка (передней стенке спинального канала) (задней проекции SI).
|
|
|
||
|
Б |
|||
|
|
|||
|
А |
В |
||
|
Рис. 2. Положение уклономера при измерении углов индивидуальных проекций: А – угол наклона передней поверхности SI позвонка, Б – угол наклона задней поверхности SI позвонка, В – угол наклона верхней грани SI позвонка |
|||
|
|
|
|
|
|
А |
Б |
В |
|
Рис. 3. Измерение углов наклона индивидуальных проекций на боковой проекции крестца:
А – передней, Б – задней, В – верхней
|
|
|
|
|
А |
Б |
В |
|
Рис. 4. Положение С-дуги при выполнении флюороскопии в индивидуальных проекциях с использованием уклономера: А – для передней проекции, Б – для задней проекции, В – для верхней проекции |
||
|
|
|
|
|
А |
Б |
В |
Рис. 5. Маркировка шкалы C-дуги метками в индивидуальных проекциях при флюороскопии: А – для передней, Б – для задней, В – для верхней проекции
Интраоперационный флюороскопический контроль проводился с помощью C-дуги, угол наклона которой изменяли в соответствии с полученными результатами измерений, ориентируясь по меткам на шкале. Уделялось внимание тому, чтобы при выведении индивидуальных проекций продольная ось C-дуги была строго перпендикулярной продольной оси крестца, а его рентгенологическая тень в каждой проекции находилась в центре экрана электронно-оптического преобразователя для предотвращения искажения изображения. Учитывая то, что индивидуальные проекции практически никогда не были ортогональными (взаимно перпендикулярными), при их выведении приходилось корректировать положение C-дуги, перемещая её вдоль тела пациента для того, чтобы крестец всегда оставался в центре экрана. В ряде случаев, чтобы сократить время и количество снимков, требуемое для достижения нужных проекций, положение колёсного шасси C-дуги для каждой проекции отмечалось маркерными метками на полу, и в процессе смены проекций C-дугу перемещали в соответствии с этими метками.
Также соблюдалась правильность ротационного положения тела пациента на операционном столе, критерием которого являлось расположение остистых отростков крестцовых и нижних поясничных позвонков по средней линии позвоночного столба. При невозможности придать телу пациента требуемое положение, правильность рентгенологических проекций корректировалась за счёт поворота C-дуги в горизонтальной плоскости (относительно тела пациента) или наклона операционного стола до достижения симметричности рентгеновского изображения.
При выполнении рентгенографии крестца в индивидуальных проекциях под определёнными углами чётко визуализировались соответствующие границы безопасной зоны для введения винта: передняя, задняя и верхняя. По этим ориентирам контролировалось положение направляющей спицы и илиосакрального винта (рис. 6 А-В).
|
|
|
|
|
А |
Б |
В |
Рис. 6. Интраоперационный контроль положения направляющей спицы по индивидуальным проекциям: А – в передней проекции визуализирована передняя грань тела SI позвонка, Б – в задней – спинальный канал, В – в верхней – верхняя граница тела SI позвонка
На передней проекции передний кортекс тела I крестцового позвонка и боковых масс ниже скатов складывается на рентгенограмме в явную, хорошо определяемую тень, легко отличимую от всех прочих, посторонних теней (рис. 6А), ориентирование по этой тени позволяет избежать перфорацию передней стенки тела SI позвонка и нижней половины его боковых масс. Рентгенологический контроль под углом наклона спинального канала (в задней проекции) позволяет объективно визуализировать просвет спинального канала на уровне верхней трети SI позвонка для предотвращения проникновения в него винта при его расположении в указанной зоне (рис. 6Б), а контроль под углом наклона верхнего края тела SI позвонка (в верхней проекции) позволяет избежать проникновение винта за его пределы (рис. 6В).
Проблема визуализации в слепых зонах. Однако описанные выше проекции, позволяющие хорошо визуализировать переднюю, заднюю и верхнюю границы тела SI позвонка, практически бесполезны для визуализации таких слепых зон крестца, как скаты по передне-верхней поверхности боковых масс SI позвонка, на которых располагаются L5 корешки, и крестцовые корешковые каналы, по которым S1 корешки следуют из спинального канала к корешковым отверстиям, где выходят за пределы крестца (рис. 7 В, Г). Введение направляющих спиц и винтов в указанные зоны чревато повреждением L5 и S1 корешков. При этом ни стандартные проекции (прямая, outlet и inlet), ни индивидуальные проекции не позволяют в пределах слепых зон определить, выходит ли винт за пределы костной ткани или нет, так как на любой из этих проекций винт будет накладываться на рентгенологическую тень крестца, проекционно находясь в границах костной ткани, даже если будет иметь место перфорация кортикальной пластинки. Рентгенологически не представляется возможным вывести контуры кости в слепых зонах на передне-задних проекциях в связи с пологим расположением и изогнутой их формой. У пациента, лежащего на операционном столе, расположение корешковых каналов S1 и скатов боковых масс крестца может быть очень близко к горизонтальному, во время операции такой угол наклона C-дуги недостижим.
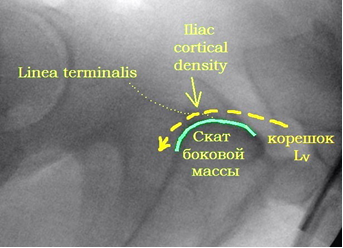
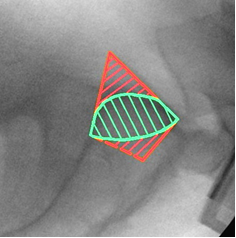
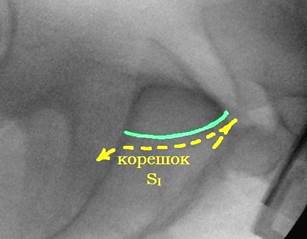
По литературным данным [12; 21], единственной проекцией, на которой можно визуализировать скаты боковых масс крестца и верхние стенки корешковых каналов, остаётся боковая проекция крестца (рис. 7А). При выполнении этой проекции поверхность ската складывается в полукруглую тень, направленную своей выпуклостью кпереди и кверху и как бы «отрезающую» верхне-передний угол тела SI позвонка (рис. 7В). Передне-верхний скат боковой массы крестца находится на одном уровне с тазовой поверхностью крыла подвздошной кости и плавно в неё переходит. Поэтому пограничная линия (linea terminalis) подвздошной кости, а также зона повышенной костной плотности подвздошной кости (iliac cortical density) может служить хорошим ориентиром для определения тени поверхности ската боковой массы, поскольку является её продолжением на боковой проекции таза. Верхняя стенка корешкового канала также представлена полукруглой тенью, только её выпуклость направлена книзу и кзади, она «отсекает» задне-нижний угол тела SI позвонка (рис. 7Г). Таким образом, безопасная зона на боковой поверхности крестца, ограниченная двумя полукруглыми линиями, приобретает каплевидную или эллипсовидную форму (рис. 7Б).
|
|
|
|
А |
В |
|
|
|
|
Б |
Г |
Рис. 7. Рентгенологический контроль в боковой проекции крестца:
А – вид крестца в боковой проекции, Б – четырёхугольный контур SI позвонка и границы безопасной зоны эллипсовидной формы, В – визуализация ската боковой массы крестца, Г – визуализация S1 корешкового канала
В нашем исследовании адекватная визуализация передне-верхнего контура (ската) боковых масс крестца и контуров верхних стенок корешковых каналов SI на боковой проекции крестца была возможна только у небольшой части пациентов. У пациентов с повышенной массой тела иногда невозможно было различить даже контуры самого крестца. Кроме того, контроль в боковой проекции возможен только при строго поперечном положении винта, а при косом расположении винта последний неизбежно пересекает в рентгеновском изображении контуры опасных зон, что затрудняет интерпретацию визуальной информации. Всё выше изложенное ограничивает пределы использования ориентации по боковой проекции при введении илиосакральных винтов.
Концепция передне-нижнего и задне-верхнего коридоров безопасности. В процессе изучения рентгеноанатомических особенностей крестца и детального анализа случаев осложнений, связанных с выходом винта за пределы безопасной зоны, в качестве альтернативы традиционному центральному расположению илиосакральных винтов нами определена концепция условного разделения SI позвонка на два этажа (верхний и нижний), в каждом из которых соответственно выделяется коридор, наиболее безопасный для введения илиосакральных винтов: передний коридор – для нижнего этажа, задний – для верхнего (рис. 8 А, Б).
|
|
|
|
А |
Б |
Рис. 8. Разделение SI позвонка на этажи и коридоры:
А – верхний и нижний этаж, Б – передний и задний коридоры
Учитывая наличие на уровне SI позвонка таких слепых зон, как скаты боковых масс крестца в передне-верхнем отделе SI позвонка и корешковые каналы в задне-нижнем его отделе, расположение илиосакральных винтов в этих зонах расценивалось как опасное и признавалось нежелательным. В дальнейшем илиосакральные винты вводились в двух коридорах безопасности: передне-нижнем и задне-верхнем. Флюороскопический контроль в индивидуальных проекциях применялся для точного позиционирования направляющей спицы и илиосакрального винта в выбранном коридоре. Для контроля положения винта в передне-нижнем коридоре использовалась визуализация передней стенки SI позвонка и верхней стенки переднего S1 корешкового отверстия. Для контроля положения винта в задне-верхнем коридоре визуализировалась верхняя грань тела SI позвонка и боковой массы крестца и задняя грань тела SI позвонка (передняя стенка спинального канала на этом уровне) (рис. 9). Сущность навигации заключалась во введении направляющей спицы на определённом расстоянии, например на расстоянии диаметра винта от двух чётко выводимых ориентиров, ограничивающих коридор безопасности с двух сторон (спереди и снизу для передне-нижнего коридора, сзади и сверху для задне-верхнего коридора). Исходя из ширины коридора безопасности на данном уровне при расположении винта на заданном расстоянии, например от передней стенки этого коридора, автоматически определяется его положение и относительно противоположной (задней) стенки, которую на данном уровне вывести не представляется возможным.
|
|
Рис. 9. Задне-верхний и передне-нижний коридоры безопасности и ориентиры, используемые для контроля положения винта
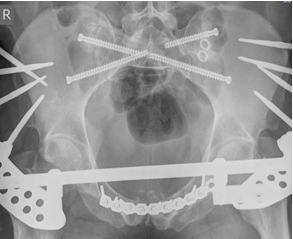
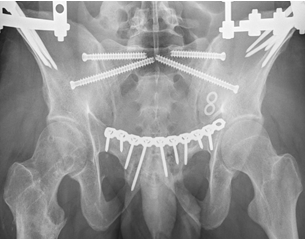
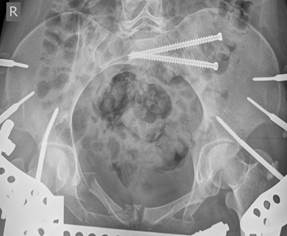
Одним из преимуществ данной концепции является возможность введения в SI позвонок двух разнонаправленных илиосакральных винтов (передне-нижнего и задне-верхнего). Использование индивидуальных проекций позволяет корректно расположить винты со значительными углами наклона к поперечной оси SI позвонка и на достаточно большом расстоянии друг от друга, что теоретически увеличивает стабильность фиксации по сравнению с двумя традиционными поперечными винтами, расположенными близко друг к другу (рис. 10 А, Б).
|
|
|
|
А |
Б |
Рис. 10. Рентгенограммы таза после введения винтов в задне-верхнем и передне-нижнем коридорах безопасности: А – проекция inlet, Б – проекция outlet
Результаты и обсуждение
Весь комплекс предоперационных мероприятий по измерению углов наклона индивидуальных проекций и нанесения разметки на шкалу C-дуги занимал от 3 до 17 минут, в среднем время подготовки составило 7,82 минуты.
В результате исследования были получены величины углов наклона для верхней поверхности тела SI позвонка (верхняя проекция SI, «истинная» проекция outlet): диапазон значений составил от 30° до 66° относительно горизонтали (диапазон 36°, среднее значение 48,71°); для передней поверхности тела SI позвонка (передняя проекция SI, «истинная» проекция inlet) – от 58° до 90° (диапазон 32°, среднее значение 71,26°); для передней стенки спинального канала на уровне SI (задняя проекция SI, «спинальный inlet») – от 35,5° до 70° (диапазон 34,5°, среднее значение 50,13°). Угол наклона передней стенки спинального канала на уровне SI отличался от угла наклона передней поверхности тела SI позвонка на 8-36° (в среднем на 21,13°), что не позволяло одновременно выводить оба этих ориентира на одной усреднённой проекции.
На введение одного илиосакрального винта с использованием индивидуальных проекций затрачивалось от 5 до 50 минут, в среднем время процедуры составило 20,1 минуты.
Всем пациентам в послеоперационном периоде было проведено исследование неврологического статуса в сравнении с дооперационным состоянием, а также была выполнена контрольная компьютерная томография таза с количественной оценкой корректности расположения илиосакральных винтов. Проникновение винта в противоположное крестцово-подвздошное сочленение, включая выход в заднее крестцово-подвздошное пространство, а также расположение винта в диастазе перелома или посттравматическом дефекте боковой массы крестца не расценивались как выход за пределы безопасной зоны.
В 44 (55%) случаях введения винтов у 25 пациентов винты располагались строго в пределах костной ткани. В 27 (33,75%) случаях введения винтов у 19 пациентов была выявлена краевая перфорация винтом кортекса крестца или подвздошной кости без значительного выхождения винта из безопасной зоны (< 1 мм): в 16 случаях – передней стенки боковой массы крестца, в 4 случаях – спинального канала на уровне SI, в 7 случаях – стенки S1 радикулярных каналов, в 2 случаях – внутренней поверхности крыла подвздошной кости (в некоторых случаях отмечалось наличие перфорации кортекса в двух локализациях у одного винта). В 8 (10%) случаях введения винтов (у 7 пациентов) отмечалась пенетрация винтом стенки крестца или подвздошной кости с выходом за пределы безопасной зоны на расстояние до 1/2 диаметра винта (< 3,6 мм): в 3 случаях – в области боковой массы крестца, в 1 случае – в области верхней замыкательной пластинки тела SI позвонка, в 3 случаях - в спинальный канал на уровне SI, в 1 случае – в S1 радикулярный канал, в 1 случае – по внутренней поверхности крыла подвздошной кости. Во всех указанных случаях не было выявлено ухудшения неврологического статуса по сравнению с дооперационным.
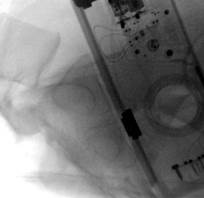
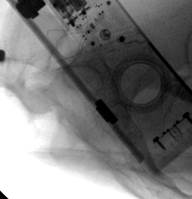
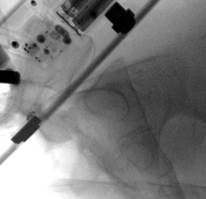
У 1 пациентки (1,96% случаев лечения или 1,25% случаев введения винтов) на контрольных компьютерных томограммах была выявлена протрузия одного винта в области ската ипсилатеральной боковой массы крестца более чем на 1/2 диаметра винта (> 3,6 мм) (рис. 11 А-Г). Мальпозиция сопровождалась неврологической симптоматикой в виде нейрогенной боли вследствие ирритации L5 корешка, появившейся после операции. Указанная пациентка была прооперирована по поводу повреждения от бокового сжатия с выраженной компрессией и фрагментацией боковой массы крестца, и сохраняющимся ротационным смещением половины таза. Причиной ошибки в навигации явилось изменение формы, рентгенологической плотности и пространственного расположения костных ориентиров. Неврологические расстройства в течение 2 недель после операции купировались консервативными методами, ревизионного хирургического вмешательства не потребовалось. Представленный случай мальпозиции наблюдался на начальном этапе освоения метода.
|
|
|
|
|
|
Рис. 11. Рентгенограммы таза и компьютерная томография после операции у пациентки с мальпозицией илиосакрального винта - перфорация винтом ската боковой массы крестца: А, Б – проекции inlet и outlet, В, Г – сканы компьютерной томографии
Выводы
1. Предложенный способ навигации за счёт индивидуализации метода контроля и концепция передне-нижнего и задне-верхнего коридоров безопасности позволяют снизить риск мальпозиций илиосакральных винтов, улучшить результаты лечения пациентов с нестабильными повреждениями таза.
2. Диапазон значений углов индивидуальных тазовых проекций («истинных» inlet'а и outlet'а), полученных в результате измерения непосредственно на операции, в нашей серии составил соответственно 32° и 36°, из чего следует, что усреднённые проекции не могут быть альтернативой индивидуальным. Значения углов наклона индивидуальных inlet'а и outlet'а у некоторых пациентов значительно (более 40°) отличались от углов наклона стандартных косых тазовых проекций.
3. Предложенная индивидуальная задняя проекция, визуализирующая спинальный канал на уровне верхней трети SI позвонка («спинальный inlet»), позволяет более точно контролировать положение винтов в задне-верхнем коридоре. Угол наклона этой проекции в нашей серии отличался от угла наклона передней проекции («истинного» inlet'а) на 8-36° (в среднем на 21,13°), что не позволяет заменить эти две проекции одной усреднённой.
4. При краевых выходах илиосакральных винтов (до 1/2 диаметра винта) за пределы костной ткани в области корешковых каналов или передне-верхних скатов боковых масс крестца в нашем исследовании не отмечалось неврологических осложнений.
5. Наличие остаточного смещения при недостаточной репозиции является фактором риска для мальпозиции илиосакральных винтов, требует тщательного предоперационного планирования и точной техники выполнения манипуляции.
Библиографическая ссылка
Близнец Д.Г., Рунков А.В., Кочетков В.В. ИСПОЛЬЗОВАНИЕ ИНДИВИДУАЛЬНЫХ ПРОЕКЦИЙ ДЛЯ ИНТРАОПЕРАЦИОННОГО КОНТРОЛЯ ПОЛОЖЕНИЯ ИЛИОСАКРАЛЬНЫХ ВИНТОВ И КОНЦЕПЦИЯ КОРИДОРОВ БЕЗОПАСНОСТИ // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26294 (дата обращения: 12.03.2026).
DOI: https://doi.org/10.17513/spno.26294










 А
А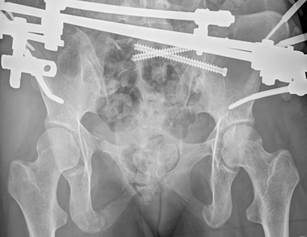 Б
Б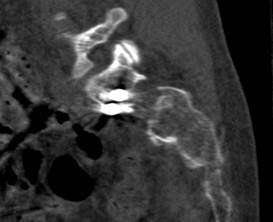 В
В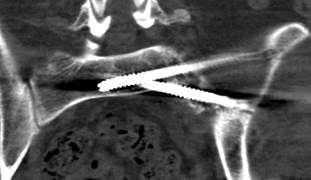 Г
Г