В настоящее время большое количество исследований посвящено роли субклинической ВМИ в генезе преждевременных родов [9-15]. При невынашивании беременности по исследованиям зарубежных и отечественных авторов морфологические признаки ВМИ выявляются в 50–60 % случаев [7, 9, 13, 14]. Причиной ВМИ во время беременности может стать генитальная инфекция нижнего отдела репродуктивного тракта (восходящий путь инфицирования), а также персистенция микроорганизмов в эндометрии у женщин с хроническим эндометритом в анамнезе [5, 9, 14]. Вызывая локальный и/или системный воспалительный ответы, инфекционные агенты могут стать причиной прерывания беременности на любом сроке, формирования плацентарной недостаточности, ВУИ плода и новорожденного.
Более важными во время беременности, чем непосредственное воздействие возбудителя инфекционного процесса, являются реакции материнской иммунной системы в ходе реализации противоинфекционного ответа [5]. На современном этапе обсуждается патогенез преждевременных родов, ассоциированных с инфекционным фактором. Воздействие бактериальных эндотоксинов через TLRs вызывает усиленную продукцию хемокинов и цитокинов, активацию протеаз, лейкоцитарную инфильтрацию децидуальной ткани и плодных оболочек, что в конечном итоге приводит к преждевременному началу родовой деятельности, преждевременному разрыву плодных оболочек (ПРПО), раскрытию шейки матки [2, 5]. Сегодня представлены современные доказательства влияния микробной инвазии амниотической полости, оксидантного стресса и клеточного апоптоза на повышение активности в околоплодных водах матриксных металлопротеиназ (ММП) [2, 4]. Кроме участия в деградации плодных оболочек и их преждевременном разрыве, ММП расщепляют коллаген и эластин во внеклеточном матриксе цервикального канала, способствуя его расширению [1, 4, 7].
Хронический воспалительный процесс в матке изначально оказывает негативное влияние на формирование плаценты, нарушая процессы плацентации и полноценного ангиогенеза ворсинчатого дерева [5, 6, 8]. Усиление выброса цитокинов в ответ на инфекцию может инициировать эффекторные функции цитотоксических клеток, макрофагов и нейтрофилов, способствуя повреждению плацентарных барьеров [8]. Сведения литературы об участии цитокинов в реакциях гемостаза дают основание предположить, что повышение провоспалительных цитокинов у беременных во многом определяет нарушения коагуляционного гомеостаза и микроциркуляции в маточно-плацентарном бассейне, что в дальнейшем приводит к развитию фетоплацентарной недостаточности (ФПН) и досрочному прерыванию беременности [5, 8].
Трудности, связанные с исследованиями морфологического субстрата во время беременности, являющегося непосредственным индикатором нарушений в фетоплацентарном комплексе, в частности развития внутриматочного воспаления, диктуют необходимость разработки неинвазивных методов, позволяющих прогнозировать реализацию гестационных осложнений. Учитывая патогенез изучаемого осложнения, в комплекс обследования беременных женщин целесообразно включать оценку иммунологических показателей.
Цель нашего исследования – разработать модель прогноза преждевременных родов у женщин с внутриматочной инфекцией (ВМИ).
Материалы и методы исследования
Проведено когортное проспективное исследование, в которое вошли 327 беременных женщин, взятых методом сплошной выборки. Комплексное обследование включало оценку анамнестических данных и результатов клинических, микробиологических, инструментальных, иммунологических методов исследования. Забор материала для микробиологического и иммунологического исследования проводился на сроке 12–16 недель беременности. Работа проходила на базах ГБУЗ ОПЦ и ГБУЗ ГКБ № 8 г. Челябинска, НИИ иммунологии ФГБОУ ВО ЮУГМУ в период с 2012 по 2015 год. Клинико-лабораторное обследование беременных женщин проводилось согласно приказу Минздрава России № 572н от 1 ноября 2012 г. «Об утверждении Порядка оказания медицинской помощи по профилю акушерство и гинекология».
Для определения микробного пейзажа нижнего отдела репродуктивного тракта использовалась технология «Фемофлор-16», основанная на проведении полимеразной цепной реакции (ПЦР) «в режиме реального времени» с количественной и качественной характеристикой нормальной и условно-патогенной флоры. Исследование проводилось с использованием набора реагентов «Фемофлор 16» фирмы «ДНК-Технология» (Россия). Инструментальное обследование включало: эхографическое исследование плода и допплерометрию (на ультразвуковых сканерах AlokaSSD 3500 и Logiq 7 pro); кардиотокографию плода и наружную гистерографию (аппарат Oxford sonic aid team care); простую и расширенную кольпоскопию (видеокольпоскоп «Sensitec-SLC», Китай).
Материалом для иммунологического исследования были периферическая кровь и цервикальная слизь. В периферической венозной крови определяли: абсолютное число лейкоцитов, лейкоцитарную формулу, субпопуляции лимфоцитов (T-лимфоциты, Т-хелперы, Т-цитотоксические, NK-лимфоциты, В-лимфоциты) и нейтрофилов (CD66b, CD62L и CD11b), факторы гуморального иммунитета (IgA, M, G, ЦИК, компоненты комплемента (С3/С5)), уровни ингибитора тканевого фактора (TFPI), ангиотензина–II, эндотелина (1-21).В периферической крови и цервикальной слизи изучалась функциональная активность нейтрофилов (лизосомальная активность, внутриклеточная кислородзависимая бактерицидность в НСТ-тесте, фагоцитоз, формирование внеклеточных ловушек), оценивались уровни цитокинов (IL-1β, IL-8, IL-17, IL-4, IL-10, RAIL-1, IF-Y,TGF-β), sTREM-1 (растворимая форматриггерного рецептора-1 миелоидных клеток), альфа-дефензинов 1-3, белка BPI (humanbactericidalpermeabilityincreasingprotein), sVE-кадгерина. Отдельно, в выделенной фракции определялась функциональная активность моноцитов (лизосомальнаю, НСТ-редуцирующая, фагоцитарная активность, количество внеклеточных ловушек).
После родов во всех случаях проводилось морфологическое исследование последов. Диагноз ВМИ ставился на основании выявления признаков, отражающих различные обще-патологические процессы в плаценте: воспаление, расстройство кровообращения, нарушение адаптации. Воспалительные изменения выражались в характерной клеточной инфильтрации различных структур плаценты: хориальной пластинки, базальной и париетальной децидуальных оболочек, амниона, стромы ворсин.
На первом этапе работы была изучена диагностическая ценность анамнестических, клинических, инструментальных и лабораторных показателей у женщин с морфологически верифицированной ВМИ. Все 327 женщин с учетом результатов морфологического исследования последов после родов были разделены на две группы: в I группу вошли 130 женщин с ВМИ, во II группу – 197 женщин без ВМИ. На втором этапе у 130 пациенток с ВМИ те же показатели были вновь оценены уже в зависимости от исхода беременности. С данной целью все пациентки c морфологическим подтверждением данного диагноза (130 женщин) были разделены на две подгруппы. В IA группу вошли 109 женщин, роды у которых произошли в срок, во IB группу – 21 женщина с преждевременными родами.
Обработка полученных данных проводилась общепринятыми методами вариационной статистики с использованием статистического пакета SPSSStatistsc 17.0. Для оценки статистической значимости различий был использован критерий χ2 и точный тест Фишера. Для изучения изолированного влияния каждого фактора с учетом его взаимосвязи с другими и выбора наиболее значимых предикторов риска преждевременных родов у женщин с ВМИ был проведен регрессионный анализ. Все предикторы являлись дихотомическими переменными. Была построена модель логистической регрессии (метод построения – пошаговый с включением переменных в модель), рассчитывались коэффициенты уравнения регрессии В и exp (В). Для изучения иммунологических предикторов были отобраны показатели, имеющие достоверные отличия между группами женщин со своевременными и преждевременными родами на фоне ВМИ, после чего определялась их диагностическая ценность с помощью ROC-анализа и расчета показателей чувствительности и специфичности теста.
Результаты
На первом этапе работы были установлены клинико-иммунологические критерии внутриматочной инфекции (ВМИ) у беременных женщин [3]. С данной целью после родов был проведен сопоставительный анализ результатов комплексного обследования 327 женщин, проведенном во II триместре, с заключениями морфологического исследования последов. Гистологические признаки внутриматочного воспаления были выявлены в 39,8 % случаев (130), при этом у женщин, родивших в срок – в 36,7 % (109), у женщин с преждевременными родами – в 77,8 % (21) случаев. После построения модели логистической регрессии, были установлены пять независимых маркеров диагностики ВМИ во время беременности: отягощенный акушерско-гинекологический анамнез (2 и более искусственных абортов, неразвивающиеся беременности, самопроизвольные выкидыши, преждевременные роды в анамнезе); стойкая угроза прерывания; наличие цервицита; изменения в структуре плаценты и количестве околоплодных вод по данным УЗИ; нарушение маточно-плодового кровотока по допплерометрии. Каждому маркеру был присвоен 1 балл. При сумме 4–5 баллов – риск наличия ВМИ составил 81–100 %. При сумме 1–3 балла тот же риск был не выше 76 % и требовал дополнительного обследования пациенток, в качестве которого были использованы иммунологические показатели периферической крови и цервикальной слизи. Наилучшими показателями чувствительности и специфичности (ROC-анализ) обладали следующие показатели: 1β>1,75пг/мл, IL-10<3,8 пг/мл, IL-17>1,2 пг/млв периферической крови и sVEкадгерин<6 пг/мл, α-дефензины < 155.000 пг/мл в цервикальной слизи. Также был проведен дискриминантный анализ иммунологических показателей, на основании которого была построена математическая модель и разработана программа прогнозирования ВМИ у беременных женщин.
На втором этапе работы после анализа результатов клинического, микробиологического, инструментального обследования женщин в зависимости от исхода беременности, были установлены факторы риска преждевременных родов на фоне ВМИ. Был также проведен регрессионный анализ с построением модели логистической регрессии (построение модели было остановлено на шестом шаге, R2 модели составил 0,447, р<0,00001). В результате в модель вошли шесть переменных: преждевременные роды в анамнезе, угроза прерывания беременности в I триместре; патологическая обсемененность нижнего отдела репродуктивного тракта Gardnerella vaginalis, Enterobacteriaceae / Staphylococcus spp.; наличие хронической субкомпенсированной и декомпенсированной плацентарной недостаточности (ХПН). Результаты приведены в таблице.
Модель логистической регрессии для прогноза преждевременных родов у женщин с ВМИ
|
Коэффициент уравнения регрессии В |
Стандартная ошибка коэффициента SE(B) |
р |
|
|
Преждевременные роды в анамнезе |
4,265 |
1,512 |
0,005 |
|
Угроза в I триместре |
3,018 |
1,219 |
0,013 |
|
Gardnerella vaginalis |
3,733 |
1,236 |
0,003 |
|
Enterobacteriaceae / Staphylococcusspp. в титрах>104 ГЭ/ мл |
4,094 |
1,485 |
0,006 |
|
ХПН субкомпенсированная и декомпенсированная |
4,245 |
1,501 |
0,005 |
|
Constant |
-8,365 |
2,235 |
0,000 |
Было установлено, что шесть переменных являются значимыми независимыми факторами риска преждевременных родов у беременных женщин с ВМИ. Также был предпринят поиск иммунологических предикторов. После проведения ROC-анализа мы выявили значимые качественные и количественные иммунологические критерии в периферической крови и цервикальной слизи у женщин с преждевременными родами, ассоциированными с ВМИ. Было установлено, что в IB группе женщин достоверные изменения касались тех же иммунологических показателей, которые имели диагностическую ценность для расчета риска наличия ВМИ, но с еще более выраженными отклонениями от референтных значений «нормы». Вместе с тем были выделены дополнительные иммунологические предикторы, которыми стали: лизосомальная активность моноцитов > 212 у.е., НСТ-спонтанная активность нейтрофилов > 37 %, IL-8 > 2,25 пг/мл,IFN-γ > 6,4 пг/мл, IL-10<3,5 пг/мл, эндотелин> 0,60 пг/млв периферической крови; общее количество лейкоцитов>30×109/л., лизосомальная активность нейтрофилов>177 у.е., IL-8 > 2175 пг/мл, IL-4 < 4 пг/мл, IFN-γ < 25 пг/мл,BPI< 80000 пг/мл, α-дефензины< 115000 пг/мл в цервикальной слизи.
Таким образом, у женщин с ВМИ, у которых в последующем произошли преждевременные роды, был установлен высокий «провоспалительный ответ» клеток врожденного иммунитета периферической крови и цервикальной слизи на фоне дефицита противомикробных пептидов. Повышение уровня эндотелина в периферической крови у женщин с преждевременными родами не противоречит данным, полученным в эксперименте и доказывающим влияние данного пептида на тонус гладкомышечной мускулатуры матки через активацию ММП-1 [15].
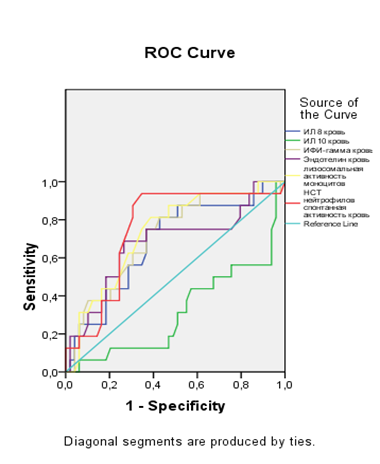
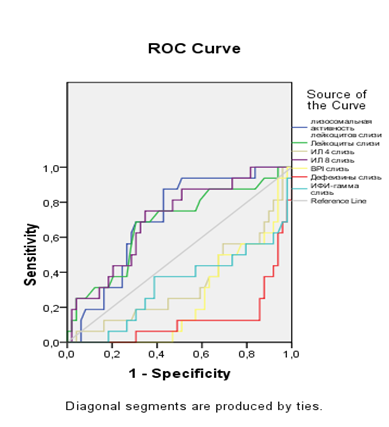
ROC-кривые для показателей периферической крови и цервикальной слизи
Для удобства использования построенных нами многофакторных моделей в клинической практике, была создана программа для ПЭВМ (свидетельство о государственной регистрации программы для ЭВМ № 2016660265 от 09 сентября 2016).
Заключение. Морфологические признаки внутриматочного воспаления были установлены в 39,8 % случаев (130) среди всех родивших, при этом в 77,8 % (21) среди женщин с преждевременными родами. На первом этапе обследования беременных пациенток мы считаем оправданным определение степени риска наличия ВМИ, используя клинико-анамнестические, микробиологические, инструментальные и иммунологические данные. У всех женщин с высоким риском наличия ВМИ необходимо одновременно рассчитывать также и риск преждевременных родов. С этой целью в клинической практике может быть использована «Программа прогнозирования внутриматочной инфекции и ассоциированных с внутриматочной инфекцией преждевременных родов у беременных женщин». Своевременно установленные предикторы изучаемых осложнений позволят обосновать этиопатогенетический подход к тактике ведения пациенток из группы высокого риска для улучшения перинатальных исходов.
Библиографическая ссылка
Долгушина В.Ф., Курносенко И.В., Мезенцева Е.А., Феклюнина Е.С., Асташкина М.В. ПРОГНОЗ ПРЕЖДЕВРЕМЕННЫХ РОДОВ У БЕРЕМЕННЫХ ЖЕНЩИН С ВНУТРИМАТОЧНОЙ ИНФЕКЦИЕЙ // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26268 (дата обращения: 17.02.2026).



