В периферической крови здоровых людей определяется до 0,001 мг/кг свободного липополисахарида, или эндотоксина грам-негативной микрофлоры. Существование системной физиологической эндотоксинемии необходимо для адекватной стимуляции миелопоэза, системы гемостаза, иммунитета. В 1993 г. Яковлев М.Ю. постулировал «системную эндотоксинемию» как физиологический феномен наличия эндотоксина в кровотоке у практически здоровых людей и «эндотоксиновую агрессию» как универсальный фактор патогенеза многих заболеваний человека [10].
Эндотоксин (ЭТ) грам-негативной микрофлоры человека, антиэндотоксиновые антитела (АЭА) и сывороточные противомикробные антитела (СПА) играют важную роль в патогенезе многих заболеваний [2, 5]. Например, в работе А.Р. Умеровой установлены ассоциации между содержанием АЭА, АТ к E. coli и Protaeus. spp. в сыворотке крови, ФНО-α и рядом клинико-лабораторных показателей при хроническом гепатите и циррозе печени с точки зрения выраженности синдрома эндогенной интоксикации. Это позволило обосновать проведение дезинтоксикационной терапии [9].
При ОКС и ИМ имеются доказательства о наличии выраженной эндогенной интоксикации (ЭИ) и нарушений как эндотоксинового статуса, так и гуморального антибактериального иммунитета. В российском исследовании (НИИ кардиологии ТНЦ СО РАМН совместно с НИИ онкологии ТНЦ СО РАМН, Томск) была изучена динамика основных показателей эндогенной интоксикации в первые 2 недели после начала ИМ, а также определена их роль в оценке тяжести данной патологии. В крови больных ИМ определялись так называемые альбуминовые показатели и выраженность токсемии, что позволяло в течение несколько минут после поступления оценить тяжесть состояния пациентов и позволяло выделять лиц, которым необходимо более интенсивное наблюдение и лечение. Показана высокая эффективность лимфосана в уменьшении признаков интоксикации и ферментемии у больных ОКС без стойкого подъема сегмента ST [3].
Имеются данные о патогенетической роли ЭТ, АЭА и СПА при физических перегрузках и стрессах [7]. Острый коронарный синдром (ОКС) можно рассматривать как модель заболевания, сопровождающегося острым стрессом. Обращают на себя внимание параллели между стрессом при ОКС и стрессом, имеющим место при спорте максимальных достижений. При сравнении показателей ЭИ в плазме крови и антиэндотоксинового иммунитета у спортсменов и неспортсменов после физической нагрузки, сопровождающейся или не сопровождающейся утомлением. Во всех группах до нагрузки была выявлена эндотоксинемия, максимально у легкоатлетов. Концентрация сывороточных АЭА коррелировала с эндотоксиновой нагрузкой организма. Во всех группах обследуемых была установлена способность к гуморальному антительному ответу с синтезом антиэндотоксиновых антител. Однако у легкоатлетов с развившимся утомлением после физической нагрузки титры АЭА значительно (до 30 %) снижались по сравнению с другими группами. Это указывало на относительную недостаточность гуморального звена антиэндотоксинового иммунитета у легкоатлетов в подготовительном периоде, то есть ещё до физической нагрузки [6, 8]. Выявленные корреляции, вероятно, могут иметь место при любом стрессе, у различных групп здоровых и больных лиц. Исследования, посвященные нарушениям параметров иммунной системы, оказывающим влияние на течение и осложнения у пациентов с Q-инфарктом миокарда, а также влиянию персистирующих, в частности, герпесвирусных, инфекций лишь частично перекликаются с изучаемой проблемой [1, 4]. В целом, роль АЭА, АКА и динамика их концентраций при ОКС практически не отражена в литературе.
Цель исследования: определить особенности иммунного ответа на эндотоксин на основе изучения уровней антител к гликолипиду хемотипа Re штамма Salmonellaminnesota R595 и значение последних для прогнозирования течения хронического гепатита, цирроза печени, острого коронарного синдрома.
Материалы и методы исследования. За период 2013–2015 гг. было обследовано 136 больных ОКС в возрасте от 35 до 84 лет, в среднем 58,47±0,93 лет. Критериями включения в исследование было наличие направительного диагноза ОКС, подтверждённого с помощью комплекса лабораторно-инструментальных методов исследования, входящих в соответствующий Российский национальный стандарт, отсутствие предшествующих нарушений ритма и ХСН, не связанных с ИБС, пороков сердца, кардиомиопатий, а также отсутствие тяжёлых конкурирующих и/или сопутствующих заболеваний со стороны других органов и систем в фазе обострения или декомпенсации, отсутствие летальных исходов при нахождении в стационаре. Больные отбирались в случайном порядке. Контрольная группа состояла из 42 здоровых лиц.
У больных ОКС и здоровых контролей были определены АЭА к гликолипиду S. MinnesotaRE-595 (Sigma, USA) и антител к липополисахаридному антигенному комплексу E. coliO14 (АКА) в сыворотках крови на 3–5 и на 14–17 день заболевания методом твёрдофазного иммуноферментного анализа (ИФА). АЭА и АКА определяли при помощи ИФА-тест-системы конъюгата протеина А с пероксидазой хрена на полистироловых планшетах, сенсибилизированных соответствующими микробными антигенами. При исследовании антител методом ИФА стандартные этапы выполнялись согласно инструкции, а учёт результатов проводился с помощью фотометрирующего устройства при длине волны 492 нм. Метод определения является строго количественным, результаты выражались в мкг/мл. Наборы для иммуноферментного определения антител произведены отделом иммунологии и биохимии Казанского НИИ эпидемиологии и микробиологии Роспотребнадзора.
Содержание лактоферрина измерялось в сыворотке крови методом твердофазного ИФА с помощью набора производства ЗАО «Вектор-Бест», г. Новосибирск. Количественно реакция оценивалась при измерении оптической плотности калибровочных проб не позднее 20 мин после остановки ферментативной реакции на спектрофотометре «Мультискан ЕХ» фирмы “Labsystems” (Финляндия) при длине волны 450 нм. Была построена калибровочная кривая соотношения оптической плотности (ось ординат) и концентрации лактоферрина в образцах (ось абсцисс). Полученная концентрация лактоферрина определялась в нанограммах на миллилитр (нг/мл).
Статистическая обработка проводилась с помощью программ SPSS 18.0 и электронных таблиц Exсel (MS Office 2010), с вычислением достоверности различий между группами по критерию p (p<0,05) и определением коэффициентов корреляции r по Пирсону.
Результаты исследования и их обсуждение. У здоровых лиц сывороточные АЭА определялись в концентрации 8,0±0,38 мкг/мл, а при ОКС – 7,49±0,56 мкг/мл. Концентрации АЭА в общей группе больных ОКС достоверно не отличались ни при ОКС без подъема ST (ОКС-ST0), составляя 7,77±0,38 мкг/мл, ни при ОКС с подъемом сегмента ST (ОКС-ST↑) – 7,00±1,20 мкг/мл (ниже, чем в контроле на 14,3 %, p> 0,05).
При оценке разброса «минимум – максимум» в общей группе ОКС концентрация АЭА варьировала в широких пределах – от 3,73 до 18,49 мкг/мл. При ОКС ST↑ она составила 1,02–4,62 мкг/мл, а при ОКС ST0 – 3,73–18,49 мкг/мл.
В зависимости от уровня АЭА больные ОКС распределялись на три подгруппы, в том числе:
1 подгруппа – концентрация АЭА ниже нормы (< 7,62 мкг/мл) – 81,8 %;
2 подгруппа – концентрация АЭА в пределах нормы (7,62–8,38 мкг/мл) – 3,3 %;
3 подгруппа – концентрация АЭА выше нормы (> 8,38 мкг/мл) – 15,2 %.
Таким образом, установлена выраженная неоднородность группы больных ОКС по концентрации АЭА. Обращает на себя внимание то, что у большинства больных ОКС уровень АЭА был ниже нормы. Было проведено сравнение между группами больных ОКС с высоким и низким уровнями АЭА, после разделения обследованных больных по медиане концентрации антител.
В 1 группе (низкий уровень АЭА) концентрация антигликолипновых антител составляла 4,99±0,23 мкг/мл против 10,00±0,83 мкг/мл во 2 группе (высокий уровень АЭА). По этому показателю группы различались с высокой степенью достоверности (p< 0,01).
Больные с высоким уровнем АЭА были моложе, чем с низким (52,0±1,7 лет < 61,0±2,3 лет, p< 0,05). Выявлено достоверное преобладание случаев ПИКС у больных с повышенным уровнем АЭА (44 % > 0%, p< 0,01). Возможно, эти больные «благополучно» пережили перенесённый ранее ИМ, в то время как у группы с низким уровнем АЭА ИМ случался впервые, т.е. выживших после перенесённого ранее ИМ среди них не было. Наблюдалась тенденция к большей встречаемости артериальной гипертензии в группе больных ОКС с низкими уровнями АЭА (68 % > 56 % в общей группе гипертоний, p> 0,05), а также ФК ХСН по NYHA (1,56 ± 0,13 > 1,16±0,07, p> 0,05). Негативные изменения на ЭКГ также коррелировали преимущественно с низким уровнем АЭА (табл. 1).
Таблица 1
Различия по параметрам ЭКГ у больных ОКС с высоким и низким уровнями АЭА (%)
|
Параметр |
Высокийуровень АЭА |
Низкий уровень АЭА |
|
Желудочковая экстрасистолия* |
0 |
16 |
|
AV блокада 2–3степени |
0 |
8 |
|
Гипертрофия левого желудочка |
40 |
48 |
|
Коронарная недостаточность в бассейне левой коронарной артерии |
63,2 |
73,9 |
|
Коронарная недостаточность в бассейне правой коронарной артерии |
36,8 |
17,4 |
Примечание: *p< 0,05.
Данные ЭхоКГ указывали на тенденцию к снижению ФИ и более выраженную диастолическую дисфункцию у больных с низкими уровнями АЭА. Выявлена прямая корреляция между концентрацией АЭА и развитием гиперкинетического синдрома (r = 0,70, p< 0,01), и обратная – с наличием гипокинезии миокарда (r = –0,41, p = 0,07). У пациентов с низкими АЭА были более выраженные показатели лизиса кардиомиоцитов КФК и КФК-МВ (рис.1).
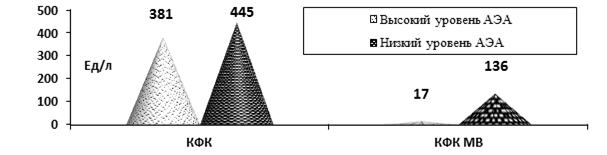
Рис. 1. Показатели лизиса кардиомиоцитов КФК и КФК МВ при ОКС у больных ОКС с низким и высоким уровнями АЭА (p > 0,05)
Таким образом, имелась тенденция к более тяжёлому течению ОКС при наличии низких концентраций АЭА (p<0,05).
Интерес представляет изменения уровней АЭА при ОКС в динамике. Исходно низкие уровни АЭА у большинства пациентов – до 30 % по сравнению со здоровыми лицами – могут указывать на повышенное потребление АЭА в реакции связывания эндотоксина, поступающего преимущественно из кишечника. При этом на место расходуемых АЭА должны приходить denovoсинтезируемые АТ. Фактически спустя две недели после дебюта ОКС концентрация АЭА достоверно нарастает (p< 0,05). Наблюдается повышение уровня АЭА как в общей группе больных ОКС, так и в группах с высоким и низким уровнями. Однако при исходно высокой концентрации АЭА регистрируется умеренное повышение АЭА (примерно на 20 % от исходного), тогда как при исходно низкой концентрации АЭА это увеличение практически двукратное (табл. 2).
Таблица 2
Динамика уровня АЭА у больных ОКС с исходно высоким (1) и низким (2) уровнями АЭА при поступлении и через 2 недели после поступления
|
Параметр |
ОКС (общая группа) |
(1) |
(2) |
|
АЭА при поступлении |
7,50±0,56 |
10,00±0,83 |
4,99±0,23 |
|
АЭА через 2 недели после поступления |
10,78±1,54 |
12,12±2,67 |
8,53±0,81 |
|
Рост концентрации АЭА |
Рост на 43,7 % (p < 0,05)1 |
Рост на 21,2 % (p > 0,05)1 |
Рост на 70,9 % (p < 0,01)1 |
Примечание: 1p по сравнению с исходной величиной.
Известно, что при стрессе и воспалении активизируется цитокиновый каскад, который в том числе будет стимулировать синтез антител безотносительно их природы. Наличие большой концентрации неспецифических стимуляторов антителогенеза в крови (цитокинов и т.д.) и поликлональной активации В-лимфоцитарного звена иммунитета может объяснять увеличение концентрации АЭА при ОКС.
ОКС всегда сопровождается лейкоцитозом: это и реакция на стресс, и на процессы, связанные с некрозом миокарда и асептическим воспалением при развитии ИМ. В связи с этим была отслежена динамика уровня лейкоцитов и СОЭ у больных ОКС с низким и высоким уровнями АЭА при поступлении и спустя 14 дней (табл. 3).
В то время как вначале в обеих группах был примерно одинаковый уровень лейкоцитов, спустя 14 дней в группе с высоким уровнем АЭА лейкоцитоз снизился на 3 %, т.е. практически не изменился, а СОЭ даже снизился на 61,1 %. В группе с низким уровнем антител лейкоцитоз достоверно вырос на 50,8 %, а СОЭ увеличилось с примерно 8,5 до 16 мм/ч, т.е. на 93,5 %.
Таблица 3
Динамика уровня лейкоцитов и СОЭ у больных ОКС с исходно высоким (М1) и низким (М2) уровнями АЭА
|
Параметр |
М1±m1 |
M2±m2 |
|
Лейкоцитоз (×1012/л) при поступлении |
8,98±0,50 |
9,02±0,57 |
|
Лейкоцитоз (×1012/л) через 2 недели после поступления* |
8,67±0,51 (↓3 %) |
13,60±0,75 (↑50,8 %) |
|
СОЭ (мм/ч) при поступлении |
11,65±1,95 |
8,44±1,61 |
|
СОЭ (мм/ч) через 2 недели после поступления |
7,00±1,67 (↓61,1 %) |
16,33±8,13 (↑93,5 %) |
Примечание: *p< 0,05 между группами М1 и М2.
У больных ОКС при динамическом исследовании установлено снижение уровня лактоферрина (ЛФ), острофазового показателя с определенным протективным потенциалом (рис. 2).
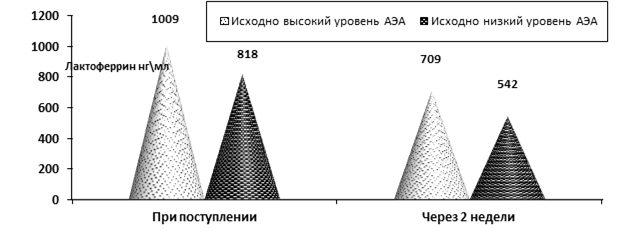
Рис. 2. Изменения уровня лактоферрина при ОКС у больных ОКС с исходно низким и высоким уровнем АЭА при поступлении и через 2 недели после поступления (p < 0,05)
Наиболее вероятной причиной снижения концентрации ЛФ представляется активное участие данного белка в процессах нейтрализации эндотоксинов, образующихся при ОКС.
У пациентов с ОКС и низким уровнем АЭА наблюдаются более низкие концентрации остальных АТ к сапрофитной и условно-патогенной микрофлоре, а в группе с высокими АЭА, наоборот, почти во всех случаях более высокие (табл. 4).
Таблица 4
Уровни сывороточных антител к сапрофитной и условно-патогенной микрофлоре у больных ОКС с высоким (М1) и низким (М2) уровнями АЭА
|
Параметр (норма) |
M1±m1 |
М2±m1 |
|
АТ к Strept. spp. (13,5±0,56 мкг/мл)* |
12,21±2,33 |
5,70±0,96 |
|
АТ к Ps. aeruginosa. (14,2±1,4 мкг/мл) |
10,30±1,17 |
8,12±0,69 |
|
АТ к Protaeusspp. (11,53±0,56 мкг/мл) |
9,35±0,66 |
10,03±0,77 |
|
АТ к E. coli (14,1±0,42 мкг/мл) * |
25,64±3,79 |
15,36±2,54 |
|
АТ к Staph. spp. (6,7±1,1 мкг/мл) |
14,57±3,24 |
11,30±2,30 |
|
АТ к Kl. pneum. (24,9±0,88 мкг/мл) |
25,12±2,38 |
23,67±2,60 |
|
АТкCandida albicans (24,7±0,72 мкг/мл) |
22,29±1,51 |
22,40±1,48 |
Примечание: *p<0,05 по сравнению с M1±m1 и/или М2±m1 (выделено).
При сравнении в динамике уровней АТ, например к E. coli, при ОКС у большинства пациентов обнаруживается незначительное нарастание концентрации данных антител при их исходно высокой концентрации, а при исходно низком – выраженное увеличение концентрации их за время наблюдения (две недели). Аналогичным образом изменяются концентрации и ряда других AT, в частности к Kl. pneum., Ps. aeruginosa, Staph. spp., Strept. spp (табл. 5).
Таблица 5
Динамика концентраций АТ у больных ОКС с высоким (М1) и низким (М2) уровнями АЭА и АТ к E.coli. при поступлении в стационар (1) и через 2 недели (2)
|
Параметр (норма) |
М1±m1 (1) |
М1±m1 (2) |
M2±m2 (1) |
M2±m2 (2) |
|
АЭА (8,00±0,38 мкг/мл) |
9,32±0,951 |
10,77±1,97 |
5,67±0,28 |
10,84±0,01↑2 |
|
АТ к Kl. pneum. (24,9±0,88 мкг/мл) |
23,97±2,49 |
26,34±3,83 |
24,82±2,50 |
62,67±0,01↑2 |
|
АТк Candida albicans (24,7±0,72 мкг/мл) |
22,81±1,54 |
25,85±0,31 |
21,88±1,45 |
26,27±0,01↑ |
|
АТ к Ps. aeruginosa. (14,2±1,4 мкг/мл) |
9,40±1,23 |
9,51±1,53 |
9,02±0,65 |
17,80±0,01↑2 |
|
АТ к Protaeusspp. (11,53±0,56 мкг/мл) |
8,76±0,691 |
11,63±1,06↑3 |
10,62±0,70 |
7,25±0,01 |
|
АТ к E. coli (14,1±0,42 мкг/мл) |
31,13±3,681 |
21,58±3,38↓3 |
9,87±0,16 |
56,82±0,01↑2 |
|
АТ к Staph. spp. (6,7±1,1 мкг/мл) |
17,03±3,351 |
7,40±1,58↓3 |
8,84±1,84 |
9,70±0,01↑ |
|
АТ к Strept. spp. (13,5±0,56 мкг/мл) |
14,10±2,181 |
11,15±2,11 |
3,80±0,49 |
29,40±0,01↑2 |
Примечания: 1p < 0,05 между М1±m1 (1) и M2±m2 (1); 2p<0,05 между М2±m2 (1) и M2±m2 (2); 3p<0,05 между М1±m1 (1) и M1±m1 (2).
Титры многих АТ при ОКС положительно коррелируют между собой. Иными словами, если у больного повышен один из СПА, например к Streptococcuspneum., то высока вероятность того, что будут повышены и концентрации иных антител, и наоборот. Особенно это заметно в отношении АЭА (r=0,604, p< 0,01), АТ к E. Coli (r=0,812, p< 0,01) и Kl. pneum. (r=0,447, p< 0,01), которые с высокой степенью достоверности и высокой корреляционной зависимостью связаны с концентрацией АТ к Strept. spp. В меньшей степени данный феномен наблюдается и в отношении маркёров Chlam. pneum. (АТIgA, r = 0,429, p< 0,013), Myc. pneum (АТIgA, r = 0,371, p < 0,034; АТIgM, r = 0,465, p< 0,006), Herpessimplex (АТIgM, r = 0,414, p < 0,017) и Epstein – Barrvirus (АТIgG, r = 0,326, p <0,064). Данное явление не говорит о том, что все эти АТ в равной степени принимают участие в патогенезе ОКС или что у больного обязательно одновременно имеются ассоциации всех вышеназванных микроорганизмов. Полученные цифры могут отражать общие особенности и направленность гуморального иммунного ответа у больных ОКС, его изменения в острый период заболевания. Причина подобных особенностей может скрываться в генетической гетерогенности больных ОКС, которые становятся заметными лишь в больших группах и при параллельном исследовании многих параметров, связанных с гуморальным иммунитетом.
Выводы. При остром коронарном синдроме у 81,8 % больных при поступлении в стационар уровень антиэндотоксиновых антител был ниже нормы. При этом выявлялась тенденция к более тяжёлому течению заболевания (p > 0,05). Через 14 дней после дебюта ОКС обнаруживается нарастание концентрации антител к E. coli на 21,2 % (p > 0,05) при их исходно высокой концентрации, а при исходно низкой – увеличение на 70,9 % (p < 0,01). Обнаружена прямая корреляция между концентрациями антител к E. coli и антиэндотоксиновых антител (r = 0,51, p < 0,01). При динамическом исследовании у больных ОКС установлено снижение уровня лактоферрина (ЛФ). Полученные данные указывают на патогенетическую роль АЭА, антител к E. сoli. и лактоферрина при ОКС.
Библиографическая ссылка
Дедов А.В., Панов А.А. СЫВОРОТОЧНЫЕ АНТИЭНДОТОКСИНОВЫЕ АНТИТЕЛА У БОЛЬНЫХ ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26265 (дата обращения: 04.02.2026).



