Дихлорэтан (ДХЭ) широко применяется в промышленности, в хлорорганическом синтезе, в качестве растворителя отравляющих веществ, а также для обезжиривания и чистки одежды [11]. Острые отравления ДХЭ возможны при авариях на химических объектах, что сопровождается попаданием токсиканта в почву, воздух, воду [4; 10; 11]. Наиболее часто длительному негативному влиянию ДХЭ подвергаются работники химических производств хлорорганического синтеза [4; 11].
Рядом авторов показано негативное влияние интоксикации ДХЭ на состояние гуморального, клеточного иммунитета, антителозависимую клеточную цитотоксичность, а также способность вызывать апоптоз клеток иммунной системы [4; 13-15]. Иммуноповреждающее действие ДХЭ вносит значительный вклад в развитие инфекционных осложнений и смертность при интоксикации [4].
Особого внимания заслуживает проблема повреждающего воздействия ДХЭ на полиморфноядерные лейкоциты (ПМЯЛ) и мононуклеарные фагоциты, поскольку они осуществляют неспецифическую защиту организма, активно участвуют в процессах как врожденного, так и приобретенного иммунитета, а также реагируют на малейшие изменения состояния организма, что позволяет использовать фагоцитарные реакции в качестве индикатора для оценки состояния всей иммунной системы в целом [1; 3; 6; 7].
Известно, что одним из основных механизмов повреждающего действия хлорсодержащих экотоксикантов является активация процессов свободнорадикального перекисного окисления липидов [5; 8; 14; 15]. Следовательно, оксидативный стресс, развивающийся при воздействии хлорсодержащих токсикантов, может существенно нарушить антимикробную активность фагоцитов, молекулярную основу которой составляет продукция активных форм кислорода [3; 9].
В связи с этим целью исследования явилось изучение влияния дихлорэтана на некоторые показатели периферической крови, кислородзависимый метаболизм полиморфноядерных лейкоцитов (ПМЯЛ) и перитонеальных макрофагов (ПМФ), биоцидную способность, активность миелопероксидазы, кислой и щелочной фосфатазы и содержание катионных белков в ПМЯЛ и ПМФ.
Материал и методы исследования
Эксперименты выполнены на 30 белых неинбредных крысах массой 180-200 г, содержавшихся в стандартных условиях вивария. Животные были разделены на 2 группы: 1-я группа - контроль (интактные животные), 2-я группа – животные, получавшие ДХЭ. ДХЭ вводили животным внутрижелудочно ежедневно с помощью специального зонда в течение 60 дней в суммарной дозе 50 мг/кг (0,1 ЛД50) в оливковом масле [10]. Контрольная группа животных получала только оливковое масло. Результаты регистрировали на следующий день после окончания введения ДХЭ.
Животные содержались в стандартных условиях вивария с естественным световым режимом, на стандартной диете лабораторных животных (ГОСТР 50258-92), с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях, а также правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 51000.4-96) и согласно Приказу МЗ РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP).
Определяли количество лейкоцитов, нейтрофилов и лимфоцитов в периферической крови, интенсивность кислородзависимого метаболизма (спонтанный и индуцированный НСТ-тест), антимикробную активность ПМЯЛ и ПМФ в условиях функционирования и блокады (азидом натрия) кислородзависимых факторов микробицидности в отношении грибов Candida albicans, активность миелопероксидазы (МП), кислой фосфатазы (КФ), щелочной фосфатазы (ЩФ) и содержание катионных белков (КБ) в ПМЯЛ и ПМФ [12].
Результаты НСТ-теста оценивали после 30 минут инкубации суспензии ПМЯЛ в 0,1%-ном растворе нитросинего тетразолия (Chemapol) морфологическим методом. В окрашенных метиловым зеленым мазках определяли процент активных клеток (содержащих гранулы восстановленного диформазана) и индекс активации (степень активации в перераспределении на 1 фагоцит). Показатели вычисляли для интактной суспензии фагоцитов (спонтанный НСТ-тест) и в процессе фагоцитоза частиц латекса (индуцированный НСТ-тест).
Антимикробную активность определяли по числу колониеобразующих единиц (КОЕ) микробов (С. albicans, штамм 2), выросших через 3 суток на среде высева. Контролем служил высев микроба из среды реакции, не содержащей фагоцитирующих клеток (ПМЯЛ). Инактивирующую активность фагоцитов выражали в процентах микробных клеток, инактивированных фагоцитами (индекс инактивации, ИИ).
Активность МП, КФ, ЩФ и КБ оценивали по интенсивности окраски (пользуясь 5-балльной шкалой), вычисляли процент активных клеток в мазке (ПА) и средний цитохимический коэффициент (СЦК) по G. Astaldi, L. Verga [12]: СЦК=(1а+2в+3с+4d) / 100, где 0-4 – интенсивность окраски, а, в, с, d – количество ПМЯЛ с соответствующей интенсивностью окраски [12].
Статистическую обработку проводили с использованием методов вариационной статистики [2], пакета программ Statistica 8.0. Проверку на нормальность распределения данных выполняли с помощью критерия Шапиро-Вилка. Оценку значимости различий проводили, вычисляя медиану и межквартильный интервал. Дисперсионный анализ проводили с помощью Н-критерия Краскела-Уоллиса, для множественных сравнений использован Q-критерий Дана. Критический уровень значимости р для статистических критериев принимали равным 0,05. Данные в тексте представлены в процентах к контролю (неинбредные животные).
Результаты исследования и их обсуждение
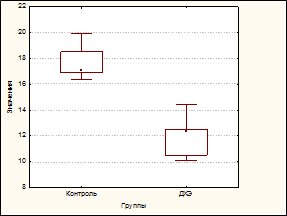
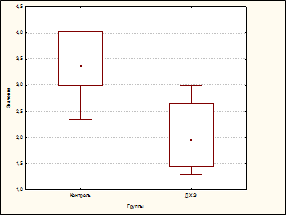
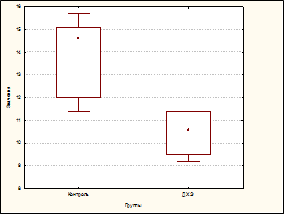
Длительное, в течение 60 дней, воздействие низких доз ДХЭ (в суммарной дозе 0,1 ЛД50) приводило к развитию у экспериментальных животных лейкопении (число лейкоцитов снизилось до 71,93% по отношению к контролю, р=0,0017), формирование которой было обусловлено преимущественно снижением числа нейтрофилов (до 58,04%, р=0,0017). Отмечалось также и уменьшение числа лимфоцитов (до 72,60%, р=0,0026) (рис. A, B, C).
 А
А
 B
B
 C
C
Влияние дихлорэтана на содержание лейкоцитов (A), нейтрофилов (B) и лимфоцитов у экспериментальных животных
Известно, что в нейтрофильных гранулоцитах существует два бактерицидных механизма: кислородзависимый и кислороднезависимый. Первый связан с функционированием миелопероксидазной системы ПМЯЛ.
В связи с этим на первом этапе нами была изучена активность кислородзависимых механизмов киллинга нейтрофилов. В группе животных, подвергшихся воздействию ДХЭ, было выявлено увеличение числа КОЕ (до 141.91%, p=0,0009), в результате ИИ снизился до 74,55% (по отношению к контролю). Это свидетельствует о подавлении токсикантом оксидантных механизмов микробицидности ПМЯЛ.
Изучение интенсивности образования активных форм кислорода (АФК) (индуцированный НСТ-тест), которым принадлежит важная роль в механизмах кислородзависимого киллинга, выявило их снижение: процент активных клеток составил 75,0% (p=0,0153), а индекс активации –72,22% (p=0,0312). В то же время активность МП в нейтрофилах, как было установлено при цитохимических исследованиях, несколько уменьшалась, не достигая, однако, статистической значимости: процент МП-позитивных клеток, как и средний цитохимический коэффициент (СЦК), снизились на 20% по сравнению с таковыми у интактных животных (табл.).
Влияние дихлорэтана на содержание миелопероксидазы и катионных белков в нейтрофилах и макрофагах (в % к контролю)
|
Пока-затель |
Нейтрофилы |
Макрофаги |
||
|
Процент активных клеток |
Средний цитохимический коэффициент |
Процент активных клеток |
Средний цитохимический коэффициент |
|
|
МП |
82,35 [76,47 – 97,06] р = 0,3611 |
81,91 [75,53 – 85,11] р = 0,0821 |
77,55 [68,37 – 84,69] р = 0,0034 |
62,07 [57,47 – 74,71] р = 0,00003 |
|
КБ |
59,18 [53,06 – 69,39] р ≥ 0,00001 |
71,38 [50,00 – 73,91] р = 0,0015 |
69,89 [65,59 -78,49] р = 0,0082 |
72,67 [59,30 – 75,58] р = 0,0450 |
Примечание: достоверность отличий р – от контроля.
Полученные данные свидетельствуют о подавлении токсикантом кислородзависимой биоцидной системы ПМЯЛ с преимущественным угнетением пероксидазонезависимых механизмов микробицидности нейтрофилов.
При изучении фунгицидной способности нейтрофилов в условиях блокады кислородзависимых механизмов киллинга наблюдалось увеличение числа КОЕ до 158,21% (p=0,0003). В результате ИИ снизился до 65,49% (по отношению к контролю).
Известно, что кислороднезависимый механизм биоцидности нейтрофильных гранулоцитов определяется потенциалом антимикробных катионных белков нейтрофилов, которые, кроме того, играют важную роль в развитии многих защитно-приспособительных и патологических процессов [12].
В связи с этим на следующем этапе было изучено содержание неферментных КБ в ПМЯЛ. Установлено существенное (статистически значимое) снижение уровня КБ в ПМЯЛ: процент КБ-положительных клеток снизился почти в два раза, а СЦК – на 30% по сравнению с интактными животными (табл.). Это свидетельствует об угнетении неоксидантных механизмов микробицидности ПМЯЛ.
Длительное воздействие низких доз ДХЭ приводило и к изменению активности фосфатаз в нейтрофилах. Так, установлено статистически значимое повышение активности кислой фосфатазы: процент КФ-активных клеток (ПА) составил 173,58% (p≤0,00001), а СЦК – 195,49% (p=0,00002). В то же время активность щелочной фосфатазы статистически значимо не изменялась, хотя отмечалась тенденция к ее снижению.
Выявленное повышение активности кислой фосфатазы, одного из основных маркеров лизосом, совпадает с известными данными об устойчивом росте активности кислой фосфатазы нейтрофилов при воздействии хлорированных углеводородов, что указывает на усиление катаболических процессов в элементах гемопоэза [12]. Также повышение активности фермента, возможно, обусловлено повышением проницаемости субклеточных мембран нейтрофилов с учетом механизма повреждающего воздействия ДХЭ.
При цитоэнзимохимической оценке состояния клеток большее значение имеют не показания активности отдельных ферментов, а дискоординация их активности, поскольку это свидетельствует о нарушении взаимосвязи и сопряженности ферментативных процессов в клетке.
Учитывая, что кислая фосфатаза, как и МП, содержится в азурофильных гранулах ПМЯЛ, выявленное отсутствие корреляции в их содержании (тенденция к снижению активности МП и резкая активация КФ) может отражать разобщение гранулярных ферментативных процессов, характеризующих чувствительность клетки к повреждающему воздействию [3; 12].
Воздействие токсиканта оказывало негативное влияние и на антимикробную активность и мононуклеарных фагоцитов. В условиях функционирования кислородзависимых биоцидных систем ПМФ установлено увеличение числа КОЕ до 134,68% (p=0,0034), в результате ИИ составил 81,78% (по отношению к контролю). Это сопровождалось снижением образования АФК в условиях индукции: процент активных клеток составил 77,33% (p=0,0098), а индекс активации –73,33% (p=0,0015). Цитохимически было выявлено снижение почти на 30% активности МП в ПМФ (табл.).
Также наблюдалось подавление неоксидантных микробицидных систем мононуклеарных фагоцитов, о чем свидетельствовало повышение числа КОЕ до 182,22% (p≤0,00001), в результате ИИ составил 72,59%. Это сопровождалось глубоким снижением уровня КБ в ПМФ (табл.). Полученные данные свидетельствуют об угнетении токсикантом оксидантных и неоксидантных механизмов микробицидности ПМФ.
Цитоэнзимохимические исследования не выявили статистически значимых изменений активности кислой и щелочной фосфатаз, наблюдалась лишь тенденция к повышению активности щелочной фосфатазы в ПМФ.
Изменения активности МП, КБ, кислой и щелочной фосфатазы являются отражением изменения функциональной активности фагоцитов, о чем свидетельствует падение бактерицидной способности этих клеток в условиях длительного воздействия низких доз ДХЭ и согласуются с известными данными о развитии вторичных иммунодефицитных состояний при воздействии промышленных экотоксикантов.
Особенно ценно, что цитохимические нарушения могут предшествовать клиническим проявлениям воздействия профессиональных вредностей и служить маркером развития ранних нарушений в состоянии здоровья работающих, которые рассматриваются как предпатологические.
Выводы
Таким образом, хроническая интоксикация экспериментальных животных ДХЭ приводит к развитию лейкопении, формирование которой обусловлено преимущественно снижением числа нейтрофилов. Количественные нарушения клеток фагоцитарного звена сопровождаются качественными изменениями функционального состояния нейтрофилов и мононуклеарных фагоцитов. Это проявляется падением интенсивности оксидантного метаболизма клеток, подавлением оксидантных и неоксидантных механизмов микробицидности, что сопровождается снижением в них активности миелопероксидазы (ПМФ) и уровня катионных белков (ПМЯЛ и ПМФ). Выявленные изменения показателей цитоэнзимохимической активности фагоцитов отражают тяжесть повреждающего воздействия длительного поступления в организм низких доз ДХЭ.
Библиографическая ссылка
Муфазалова Н.А., Меньшикова И.А., Камилов Ф.Х., Муфазалова Л.Ф. ПОВРЕЖДАЮЩЕЕ ВОЗДЕЙСТВИЕ ДИХЛОРЭТАНА НА МОРФОФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ФАГОЦИТОВ // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26249 (дата обращения: 01.02.2026).



