Молочнокислые бактерии, согласно литературным данным [1; 3; 6-8; 10; 11], способны подавлять рост патогенных и условно-патогенных микроорганизмов. Антимикробная активность молочнокислых бактерий определяется наличием различных веществ. Так, бактерицидные свойства Lactobacillus acidophilus обусловлены наличием специфических антибиотических веществ, действие которых усиливает совместное присутствие молочной, уксусной и пропионовой кислот [8], Lactocoсcus lactis ВКПМ-В-7699, согласно данным [1], – продуцированием бактериоцина (низина). А подавление роста Salmonella enterica serovar Enteritidis молочнокислой бактерией Lactobacillus kefir достигается за счет большого содержания белков S-слоя [10]. В работах S. Resta-Lenert и К. Е. Barrett [11] было показано, что Lactobacillus acidophilus и Lactobacillus rhamnosus GG обладают антитоксическим и антимикробным эффектом в отношении Clostridium difficile и Escherichia coli, а Streptococcus thermophilus и Lactobacillus plantarum в отношении Escherichia coli за счет продуцирования молочной кислоты.
Имеются сведения, что антимикробной активностью обладают экзополисахариды различных микроорганизмов: ксантан (полисахарид бактерии Xanthmonas campestris) [3], среди которых в отношении молочнокислых экзополисахаридов есть единичные сведения: ЭПС-содержащая закваска (сочетающая Bifidobacterium longum B379М и Propionibacterium shermanii KM 186 и их полисахариды) [6], лаксаран (экзополисахарид молочнокислой бактерии Lactobacillus delbruekii spp. buigaricus) [3].
В связи с этим представлялось интересным изучить антимикробные свойства экзополисахаридов (ЭПС) молочнокислых бактерий Streptococcus thermophilus и Lactococcus lactis В-1662.
Материалы и методы исследования
Объектами исследования служили ЭПС, выделенные нами ранее [4] из Streptococcus thermophilus и Lactococcus lactis В-1662. Культура Streptococcus thermophilus была получена из ФГБНУ «Всероссийский научно-исследовательский институт молочной промышленности» (г. Москва), Lactococcus lactis В-1662 – из Всероссийской коллекции микроорганизмов (г. Пущино-на-Оке).
Выделение ЭПС осуществляли по методу J. Cerning с соавт. [9] в нашей модификации.
Антимикробную активность культур ЭПС S. thermophilus и L. lactis В-1662 определяли, используя метод диффузии в агар [5]. Для этого питательную среду (МПА) в количестве 20 мл разливали в чашки Петри, затем наслаивали 2 мл 0,8%-ного агара, содержащего 0,2 мл соответствующей микробной взвеси (106 кл/мл). После застывания агара в лунки вносили по 0,1 мл водного раствора изучаемого ЭПС в концентрации 0,06% и 0,6% [2].
Пробы инкубировали в термостате при температуре, соответствующей температуре выращивания взятых в эксперимент микроорганизмов.
В качестве тест-микробов использовали микроорганизмы, относящиеся к различным таксономическим группам (табл. 1).
Таблица 1
Микроорганизмы, используемые в работе
|
Микроорганизмы |
Место получения |
|
Escherichia coli 113-13 |
Коллекция кафедры микробиологии и физиологии растений СГУ им. Н.Г. Чернышевского |
|
E. coli АТСС 25922 |
Музей кафедры микробиологии, вирусологии и иммунологии СГМУ им. В.И. Разумовского |
|
Staphylococcus aureus 209-P |
Музей кафедры микробиологии, вирусологии и иммунологии СГМУ им. В.И. Разумовского |
|
Pseudomonas aeruginosa АТСС 27853 |
Музей кафедры микробиологии, вирусологии и иммунологии СГМУ им. В.И. Разумовского |
|
Klebsiella pneumoniae K2 |
Музей кафедры микробиологии, вирусологии и иммунологии СГМУ им. В.И. Разумовского |
|
Xanthomonas campestris 610 |
Коллекция ризосферных бактерий ИБФРМ РАН |
|
Xanthomonas campestris 611 |
Коллекция ризосферных бактерий ИБФРМ РАН |
|
Pseudomonas aeruginosa АТ-31 |
Коллекция ризосферных бактерий ИБФРМ РАН |
|
Bacillus subtilis 262 |
Коллекция ризосферных бактерий ИБФРМ РАН |
|
Candida albicans 223 |
Музей кафедры микробиологии, вирусологии и иммунологии СГМУ им. В.И. Разумовского |
|
Candida albicans 13108 |
Музей культур Саратовский НИВИ Россельхозакадемии |
Результаты исследования и их обсуждение
В настоящей работе изучали антимикробные свойства ЭПС Streptococcus thermophilus, Lactococcus lactis В-1662, которые были выделены нами ранее [4]. Экзополисахариды S. thermophilus и L. lactis В-1662 представляли собой порошки светло-коричневого цвета, без запаха, не имеющие в своем составе белок и другие примеси, с молекулярной массой 10 кДа и 20 кДа соответственно [4].
В качестве тест–микробов использовали культуры, относящиеся к различным таксономическим группам: E. coli 113-13 и АТСС 25922, P. aeruginosa ATCC 27853 и АТ-31, S. aureus 209-P, K. pneumoniae K2, B. subtilis 262, X. campestris 610 и 611, C. albicans 223 и 13108.
При изучении антибактериального действия ЭПС S. thermophilus в концентрациях 0,06% и 0,6% было обнаружено угнетение роста таких бактерий, как E. coli 113-13 и АТСС 25922, S. аureus 209-P, K. pneumoniae K2 (рис. 1), P. aeruginosa АТ-31 и АТСС 27853, X. cаmpestris 610 и 611. Однако ЭПС, взятый в концентрации 0,6%, оказывал большее бактерицидное действие. Диаметр стерильных зон составлял 21–40 мм (табл. 2).
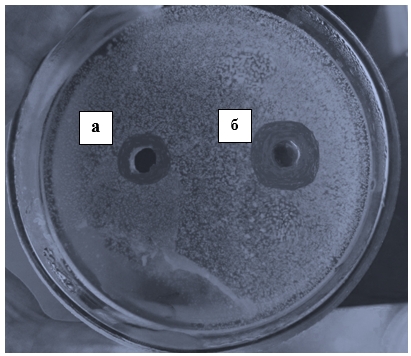
Рис. 1. Влияние ЭПС Streptococcus thermophilus (а – 0,06%, б – 0,6%) на рост Klebsiella pneumoniae K2
Таблица 2
Влияние экзополисахарида Streptococcus thermophilus на рост некоторых микроорганизмов
|
Культуры микроорганизмов |
Наличие зон подавления роста, мм |
|
|
Концентрация ЭПС |
||
|
0,06% |
0,6% |
|
|
Lactobacillus delbruekii spp.buigaricus |
- |
- |
|
Lactococcus lactis B-1662 |
- |
- |
|
Streptococcus thermophilus |
- |
- |
|
Escherichia coli 113-13 |
12,2+0,5 |
23,7+0,5 |
|
Escherichia coli АТСС 25922 |
12,0+0,5 |
21,0+0,5 |
|
Staphylococcus aureus 209-P |
12,7+0,5 |
20,5+0,5 |
|
Pseudomonas aeruginosa АТСС 27853 |
13,0+0,5 |
23,5+0,5 |
|
Pseudomonas aeruginosa АТ-31 |
13,5+0,5 |
22,7+0,5 |
|
Klebsiella pneumoniae K2 |
24,0+0,5 |
40,2+0,5 |
|
Bacillus subtilis 262 |
- |
- |
|
Xanthomonas campestris 610 |
14,7+0,5 |
22,0+0,5 |
|
Xanthomonas campestris 611 |
15,0+0,5 |
21,5+0,5 |
|
Candida albicans 223 |
- |
- |
|
Candida albicans 13108 |
- |
- |
* Примечание: отсутствие угнетения роста (-).
Предварительными исследованиями, проводимыми нами ранее с клетками S. thermophilus, из которых был выделен ЭПС [7], было показано, что стрептококки обладали бактерицидными свойствами. Клетки проявляли угнетающее действие в отношении этих же тест-культур, что и ЭПС. Исходя из этого, вполне очевидно предположить, что угнетающее действие на рост бактерий мог оказывать ЭПС S. thermophilus.
Изучение влияния ЭПС L. lactis В-1662 на рост тест-культур показало, что данный биополимер при концентрации 0,6% оказывал антимикробное воздействие на S. aureus 209-P, P. aeruginosa АТ-31 и АТСС 27853, B. subtilis 262, X. cаmpestris 610 и 611 (рис. 2), а при концентрации 0,06% еще и на E. coli 113-13 и АТСС 25922 (табл. 3).

Рис. 2. Влияние ЭПС Lactococcus lactis В-1662 (а – 0,06%, б – 0,6%) на рост Xanthomonas campestris 611
Таблица 3
Влияние экзополисахарида Lactococcus lactis В-1662 на рост некоторых микроорганизмов
|
Культуры микроорганизмов |
Наличие зон подавления роста, мм |
|
|
Концентрация ЭПС |
||
|
0,06% |
0,6% |
|
|
Lactobacillus delbruekii spp.buigaricus |
- |
- |
|
Lactococcus lactis B-1662 |
- |
- |
|
Streptococcus thermophilus |
- |
- |
|
Escherichia coli 113-13 |
- |
18,5+0,5 |
|
Escherichia coli АТСС 25922 |
- |
18,0+0,5 |
|
Staphylococcus aureus 209-P |
12,0+0,5 |
21,0+0,5 |
|
Pseudomonas aeruginosa АТСС 27853 |
11,7+0,5 |
18,5+0,5 |
|
Pseudomonas aeruginosa АТ-31 |
12,0+0,5 |
18,2+0,5 |
|
Klebsiella pneumoniae K2 |
- |
- |
|
Bacillus subtilis 262 |
11,8+0,5 |
19,0+0,5 |
|
Xanthomonas campestris 610 |
12,0+0,5 |
18,0+0,5 |
|
Xanthomonas campestris 611 |
11,7+0,5 |
18,5+0,5 |
|
Candida albicans 223 |
- |
- |
|
Candida albicans 13108 |
- |
- |
* Примечание: отсутствие угнетения роста (-).
Так же как и ЭПС S. thermophilus, ЭПС лактококка, взятый в концентрации 0,6%, оказывал большее бактерицидное действие, чем в концентрации 0,06%. Диаметр стерильных зон составлял 12-21 мм (табл. 3). Однако диаметр стерильных зон при влиянии ЭПС лактококка был меньше, чем при влиянии ЭПС стрептококка. Ранее нами было показано [7], что клетки L. lactis В-1662 проявляли бактерицидные свойства в отношении этих же тест-микробов. Вполне возможно предположить, что угнетающее действие на рост бактерий мог оказывать, как и в случае ЭПС S. thermophilus, ЭПС L. lactis В-1662.
Для изучения возможной фунгицидной активности ЭПС S. thermophiles были взяты грибы Candida albicans 223 и 13108. Как показали результаты экспериментов, ЭПС стрептококка не оказывал угнетающего действия на рост этих грибов.
При исследовании влияния ЭПС L. lactis В-1662 на рост C. albicans 223 и 13108 также не было обнаружено угнетения роста этих штаммов.
Таким образом, полученные результаты свидетельствуют о том, что ЭПС молочнокислых бактерий Streptococcus thermophilus и Lactococcus lactis В-1662 обладают в разной степени способностью угнетать рост некоторых бактерий, в том числе и условно-патогенных, однако на изучаемых грибах это свойство не обнаруживалось.
Основываясь на полученных результатах, мы предполагаем, что антибактериальное действие молочнокислых бактерий, наряду с другими веществами (молочная кислота, антибиотики и др.), может обуславливаться и такими биополимерами, как полисахариды.
Библиографическая ссылка
Урядова Г.Т., Фокина Н.А., Карпунина Л.В. ИЗУЧЕНИЕ АНТИМИКРОБНЫХ СВОЙСТВ ЭКЗОПОЛИСАХАРИДОВ МОЛОЧНОКИСЛЫХ БАКТЕРИЙ // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26226 (дата обращения: 17.02.2026).



