Своевременное выявление ДН у больных с сахарным диабетом 1 типа (СД1) представляет собой важную медико-социальную проблему в связи с неблагоприятным прогнозом у данной категории пациентов. В соответствии с существующим алгоритмом микроальбуминурия является основным диагностическим тестом для выявления ДН [1]. Однако существуют сведения о структурных изменениях в почках уже на первых этапах развития СД1 [5]. При этом не разработаны диагностические критерии структурно-функциональных нарушений в почках у пациентов с СД1 на стадии НАУ.
У больных с СД на этапе раннего диабетического повреждения возможна дисфункция тубулярного аппарата, которая может формироваться до структурно-функциональных изменений в клубочках почек [2]. Существуют литературные источники, рассматривающие N-ацетил-β-D-глюкозаминидазу, нейтрофильный желатиназо-ассоциированный липокаин и печеночную форму белка, связывающего жирные кислоты, как показатели, способные служить маркерами доклинической диагностики ДН [6; 8], однако данные о роли сердечной формы белка, связывающего жирные кислоты (HFABP), как признака повреждения почек у больных с СД единичны [10, 11].
Важное значение в развитии ДН играют и такие биомолекулы, как интерлейкин-6 (IL-6) и интерлейкин-8 (IL-8) [8, 14]. При этом имеются противоречивые сведения об уровне IL-6 и в сыворотке крови и моче по мере прогрессирования ДН [12, 13], а литературные данные об IL-6 и IL-8 как маркерах снижения фильтрационной функции почек у больных СД1 весьма ограничены [7].
Следует также отметить, что в основе развития ДН лежит нарушенная внутрипочечная гемодинамика, оценка состояния которой возможна при помощи ультразвукового исследования почечных артерий. В связи с этим является актуальным определение диагностических критериев ранней стадии ДН у пациентов с СД1 по данным дуплексного сканирования артерий почек.
Помимо теста на МАУ для диагностики ХБП у лиц с СД1 необходимо определение скорости клубочковой фильтрации (СКФ) [1]. При этом установлено, что наиболее точным методом для оценки СКФ является динамическая нефросцинтиграфия [3].
Цель исследования – определить диагностическую эффективность лучевых и лабораторных показателей как маркеров ранней диагностики ДН у больных с СД1.
Материалы и методы
Комплекс исследований выполнен в НИИ кардиологии, Томский НИМЦ, а также на кафедрах эндокринологии и диабетологии, лучевой диагностики и лучевой терапии ФГБОУ ВО СибГМУ Минздрава России в течение 2013-2016 гг. Протокол исследования одобрен Локальным Этическим комитетом ФГБОУ ВО СибГМУ Минздрава России (регистрационный номер протокола 3309; дата проведения заседания – 29 апреля 2013 г.).
В исследование было включено 140 пациентов. Все пациенты подписали информированное согласие с планом диагностических мероприятий.
87 больных с СД1 составили основную группу. Половой состав: 48 мужчин (55,2%) и 39 женщин (44,8%)) в возрасте 28,0 (24,0-36,8)лет, имеющих стаж заболевания - 13,0 (7,0-20,0) лет. Диагноз СД устанавливался на основании диагностических критериев СД и других нарушений углеводного обмена (ВОЗ, 1999 г.). Критерии включения в основную группу: диагноз СД1, возраст от 18 до 55 лет, наличие добровольного информированного согласия на участие в исследовании. Критерии исключения: кетоацидоз, нефротический синдром, вирусные и аутоиммунные гепатиты в анамнезе, повышение уровня печеночных трансаминаз более чем в 2,5 раза по сравнению с верхней границей нормы любой этиологии, кардиоваскулярные заболевания (ИБС, сердечная недостаточность, врожденные пороки сердца, эмболия легочной артерии), инфекции мочевыводящих путей, гипотиреоз, нейродегенеративные заболевания головного мозга, терапия тестостероном, системные коллагенозы, беременность.
Группа сравнения представлена 22 больными с верифицированным диагнозом эссенциальной АГ (14 мужчин (63,9%) и 8 женщин (36,4%)) в возрасте 32,5 (26,8-36,5) лет, имеющих стаж эссенциальной АГ - 11,5 (8,3-14,8) лет. Критериями включения в группу сравнения: диагноз эссенциальной АГ, наличие добровольного информированного согласия на участие в исследовании. Критерии исключения: наличие нарушений углеводного обмена, диагноз симптоматической АГ, и другие критерии исключения, аналогичные таковым для пациентов с СД1.
Контрольная группа состояла из 31 здорового добровольца в возрасте 25,0 (24,0-27,0) лет, из них 14 мужчин и 17 женщин без нарушений углеводного обмена и не имеющих диагноза АГ, сопоставимых с основной группой и группой сравнения по полу, возрасту, антропометрическим данным. Критерии исключения были аналогичны критериям, описанным для больных с СД1 и пациентов с эссенциальной АГ.
Методы лучевой диагностики были представлены ультразвуковым дуплексным сканированием почечных артерий (ПА) и ДНСГ. УЗИ артерий почек выполнялось с использованием аппарата ALOKA SSD-5500 PROSOUND и конвексного, спектрального датчиков (частота сканирования 3,5 MHz). Методом импульсной допплерометрии оценивался почечный кровоток в стволовых, сегментарных, междолевых и дуговых ПА. Скоростные и резистивные показатели почечной гемодинамики рассчитывались на уровне правой и левой почек, а также по данным общего количества обследованных почек. Определялись показатели: максимальная (Vmax), минимальная (Vmin) скорости кровотока, индекс резистивности (RI), систоло-диастолическое соотношение (S/D).
Больным с СД1 и эссенциальной АГ выполнялась ДНСГ на двухдетекторной гамма-камере (ОФЭКТ) Philips Bright View с использованием радиофармпрепарата 99mTc-ДТПА (Пентатех, Россия). Радиофармпрепарат (РФП) вводился внутривенно в дозе 74 МБк. ДНСГ проводилась в течение 20 мин в режиме 2 кадр/мин. Были получены сцинтиграммы с изображением почек в различные временные интервалы. Оценивали такие показатели как время максимального накопления РФП (Tmax), период полувыведения РФП (T½), остаток РФП на 20 мин исследования, вклад каждой почки в фильтрацию. Кроме того, осуществляли определение СКФ – общую и раздельно для левой и правой почки, для расчета которых использовались данные об активности шприца до и после инъекции РФП.
Расчет СКФ проводился по данным ДНСГ (СКФсцинти), а также с использованием формул Кокрофта-Голта, MDRD, EPIcreat., Hoek, EPIcyst. и EPIcreat-cyst. Сывороточную концентрацию цистатина С оценивали методом иммуноферментного анализа (ИФА) на анализаторе «SUNRISE», Tecan (Австрия) с использованием набора фирмы BioVendor Human Cystatin C. Стадия ХБП выставлялась в соответствии с величиной СКФ. ХБП С1 была диагностирована у 39 человек (44,83%), ХБП С2 – у 27 человек (31,03%) и ХБП С3а – у 21 человека (24,14%).
Уровень сердечной формы белка, связывающего жирные кислоты (HFABP), в сыворотке крови и в моче определялся с использованием наборов фирмы Вектор-Бест (Россия), IL-6 в сыворотке – Platinum ELISA фирмы Bioscience, IL-8 в моче - Ветор-Бест (Россия) методом ИФА. Результаты мочевой экскреции HFABP и IL-8 приводились к величине экскретируемого креатинина.
Статистическая обработка данных проводилась с помощью пакета статистических программы SPSS 11.5. Соответствие нормальному закону распределения признаков проверяли с помощью критерия Шапиро-Уилка. Количественные признаки, соответствующие нормальному распределению, представлены в виде среднего значения M и стандартного отклонения SD (M±SD), несоответствующие нормальному закону распределения - в виде медианы Ме и 25-го, 75-го перцентилей (Me(O1-Q3)). Качественные признаки представлены в виде количества наблюдений и процентных долей (n, %). Для межгруппового сравнения независимых выборок применяли непараметрический критерий Манна-Уитни либо параметрический критерий Стьюдента в соответствии с видом распределения признака. Взаимосвязь признаков изучали с помощью рангового корреляционного анализа Спирмена. Критический уровень значимости α при проверке статистических гипотез в исследовании принимался равным 0,05. C целью определения диагностической эффективности HFABP и показателей ультразвукового дуплексного сканирования ПА как маркеров ранней стадии ДН выполнялся ROC-анализ с определением площади ROC-кривой и оценкой диагностической чувствительности и специфичности.
Результаты
Больные основной группы и группы сравнения не имели статистически значимых отличий по антропометрическим данным, возрасту, полу, сывороточному содержанию мочевины и цистатина С, стажу СД1 и эссенциальной АГ, показателям систолического АД (САД) и диастолического АД (ДАД).
Пациенты подгрупп НАУ, МАУ и ПУ были сопоставимы по полу, антропометрическим данным, уровням тощаковой и постпрандиальной гликемии, содержанию HbA1C в сыворотке, при этом больные с ПУ были старше и имели статистически значимо более высокие показатели креатинина, мочевины, цистатина С, общего холестерина, ЛПНП, ТГ в сыворотке, САД, ДАД.
У пациентов с СД1 подгруппы ПУ обнаружены статистически значимо более низкие показатели СКФ по данным формул Hoek, EPIcyst и EPIcreat-cyst по сравнению с аналогичными параметрами у лиц с НАУ и МАУ.
Анализ гемодинамических показателей у обследуемых лиц показал, что пациенты с СД1 имели статистически значимо более высокие параметры Vmax, RI и S/D на уровне сегментарных (p=0,028; p<0,001; p<0,001, соответственно), междолевых (p=0,018; p=0,029; p=0,024, соответственно) и дуговых ПА (p=0,046; p=0,002; p=0,002, соответственно) по сравнению с лицами контрольной группы и более низкие величины Vmax (p=0,025) и Vmin (p=0,045) на уровне стволовой ПА по сравнению с больными с эссенциальной АГ.
Важными представляются результаты сравнительной оценки кровотока почек у больных СД1 в соответствии со стажем заболевания, согласно которым у больных СД1 с длительность заболевания 5-10 лет определялось статистически значимое повышение Vmax и Vmin на уровне стволовых (p<0,001; p=0,001, соответственно), сегментарных (p=0,001; p=0,034, соответственно), междолевых (p=0,011; p=0,021, соответственно) и дуговых (p<0,001; p=0,004, соответственно) по сравнению с лицами, стаж СД1 которых был менее 5 лет.
Оценка данных гемодинамики почек у пациентов СД1 в зависимости от стадии ХБП показала статистически значимое снижение Vmax в стволовых и сегментарных ПА у больных с ХБП3а по сравнению с таковыми у лиц с ХБП1 (p=0,044; p=0,043) и ХБП2 (p=0,003; p=0,044). Динамика значений Vmin в стволовых, сегментарных, междолевых и дуговых ПА имела ту же тенденцию. При этом показатели RI и S/D достоверно увеличивались по мере прогрессирования стадии ХБП на протяжении всего артериального русла почек.
Результаты расчета СКФ по данным ДНСГ выявили более высокие показатели СКФ в левой почке (p=0,031) и общей СКФ (p=0,028) у больных с СД1 по сравнению с пациентами с эссенциальной АГ. При этом имели место более высокие показатели T1/2 в правой почке у пациентов с СД1, имеющих ПУ, по сравнению с подгруппой НАУ (p=0,017). Значение T½ в правой и левой почках у больных с ХБП3а по сравнению со значением T½ у лиц с ХБП1 и ХБП2 было более высоким (p=0,011; p=0,028; p=0,011; p=0,025, соответственно).
Результаты наших исследований по изучению уровня HFABP и IL-6 в сыворотке, а также HFABP и IL-8 в моче у больных с СД1, эссенциальной АГ и здоровых лиц опубликованы ранее [4]. Наиболее высокие показатели HFABP и IL-6 в сыворотке, а также HFABP и IL-8 в моче наблюдались у пациентов с СД1 с протеинурией, ХБП3а и длительностью заболевания более 20 лет. По результатам оценки уровня HFABP в моче у пациентов с СД1 в соответствии со стадией ДН и здоровых добровольцев особо важными для ранней диагностики ДН представляются статистически значимо более высокие показатели мочевой экскреции HFABP у больных с НАУ по сравнению с лицами контрольной группы (p<0,001).
Для повышения степени доказательности исследования и определения диагностической эффективности изучаемых лучевых и лабораторных маркеров ДН был применен ROC-анализ.
Первоначально была оценена диагностическая эффективность мочевой экскреции HFABP как маркера ранней стадии ДН у больных с СД1. Проведение ROC анализа было направлено на поиск отрезной точки, позволяющей отнести пациента к группе пациентов с СД1, имеющих стадию НАУ, или к группе здоровых лиц без СД1. Отрезная точка выбрана путем максимизации доли больных, которую тест позволяет правильно отнести к соответствующей группе (точность теста). Рассчитаны чувствительность (доля лиц с положительным результатом теста среди больных с СД1 на стадии НАУ) и специфичность (доля лиц с отрицательным результатом теста среди здоровых лиц). Дифференциально-диагностическим критерием между больными с СД1 на стадии НАУ и лицами контрольной группы явился уровень мочевой экскреции HFABP 0,123нг/ммоль и более при наличии СД1 типа на стадии НАУ (чувствительность 93%; специфичность 87%). ROC-кривая мочевой экскреции HFABP у больных с СД1 на стадии НАУ представлена на рис. 1. Площадь под ROC-кривой равная 0,866 свидетельствует об очень хорошем качестве модели.
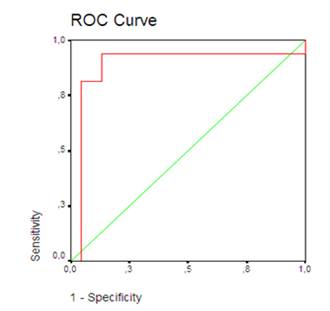
Рис. 1. ROC-кривая мочевой экскреции HFABP у больных с СД1 на стадии НАУ (AUC=0,886)
Далее была проведен ROC-анализ показателей УЗИ почечных артерий у больных с СД1 со стажем заболевания 5-10 лет и до 5 лет, по результатам которого параметрами, имеющими наибольшую чувствительность и специфичность, явились Vmax в сегментарных, междолевых и дуговых ПА, а также Vmin в дуговых ПА.
Дифференциально-диагностическими критериями между больными СД1, имеющими стаж заболевания от 5 до 10 лет, и лицами с длительностью СД1 до 5 лет явились:
- величина Vmax на уровне сегментарных ПА 47,5см/с и более у лиц со стажем заболевания 5-10 лет (чувствительность 76,2%, специфичность 69,3%);
- величина Vmax на уровне междолевых ПА 32,5 см/с и более у пациентов с длительностью СД1 от 5 до 10 лет (чувствительность 78,4%, специфичность 68,8%);
- величина Vmax на уровне дуговых ПА 25,5 см/с и более у пациентов с СД1 со стажем заболевания 5-10 лет (чувствительность 79,6%, специфичность 69,7%);
- величина Vmin на уровне дуговых ПА 10,5 см/с и более у пациентов с СД1 со стажем болезни от 5 до 10 лет (чувствительность 78,9%, специфичность 65,2%).
Таким образом, ранними маркерами нарушения почечной гемодинамики у больных СД1 со стажем 5-10лет явилось повышение Vmax в сегментарных ПА 47,5см/с и более; Vmax в междолевых ПА - 32,5см/с и более, Vmax в дуговых ПА - 25,5см/с и более; Vmin в дуговых ПА - 10,5см/с и более.
ROC-кривые показателей Vmax в сегментарных, междолевых, дуговых ПА и Vmin в дуговых ПА представлены на рис. 2.
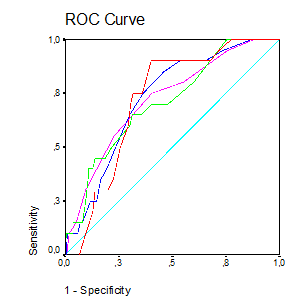
Рис. 2. ROC-кривые параметров УЗИ почечных артерий у больных СД1 со стажем заболевания 5-10лет: --- Vmax в сегментарных ПА (AUC=0,735); --- Vmax в междолевых ПА (AUC=0,736); --- Vmax в дуговых ПА (AUC=0,765); --- Vmin в дуговых ПА (AUC=0,729)
Для определения ассоциаций между изучаемыми лучевыми и лабораторными показателями, а также оценки их связей с клинико-лабораторными параметрами у больных с СД1 был проведен корреляционный анализ.
Так, были выявлены корреляции уровня HFABP в сыворотке и моче, IL-8 в моче: положительные - с величиной альбуминурии (r=0,384, p=0,007; r=0,670, p<0,001; r=0,596, p<0,001 соответственно), стажем СД1 (r=0,286, p=0,036; r=0,489, p<0,001; r=0,341, p=0,010, соответственно), степенью дислипидемии, RI, S/D; отрицательные - с величиной СКФ, Vmax и Vmin в ПА разного уровня. Определялись также положительные корреляционные связи между сывороточной концентрацией IL-6 и альбуминурией (r=0,312, p=0,026), стажем СД1 (r=0272, p=0,027), атерогенными фракциями липидов.
Обнаруженные корреляционные связи позволяют констатировать, что прогрессирование ДН с нарастанием альбуминурии, степени дислипидемии, стажа заболевания, снижением фильтрационной функции почек сопровождается повышением сывороточной концентрации HFABP и мочевой экскреции HFABP и IL-8. Выявлена также закономерность, в соответствии с которой увеличение RI и S/D, а также снижение Vmax и Vmin на уровне ПА разного калибра ассоциировано с нарастанием уровня HFABP в сыворотке, а также HFABP и IL8 в моче. Тем самым полученные корреляции доказывают многофакторный генез ДН и указывают на важную роль таких патогенетических процессов, как нарушение почечной гемодинамики, тубулярное повреждение и хроническое низкоинтенсивное воспаление в развитии ДН.
Были также определены корреляции между показателями СКФ по данным ДНСГ СКФ по данным расчетных формул (таблица). Так, СКФсцинти наиболее сильно коррелировала с СКФ Hoek (r=0,534; p=0,002), СКФ EPIcreat-cyst (r=0,525; p=0,002) и СКФ EPIcyst (r=0,504; p=0,004), при этом связь с СКФ Кокрофт-Голт (r=0,215; p=0,034) и СКФ MDRD (r=0,202 p=0,041) была менее выраженной. Тем самым, проведенный корреляционный анализ позволил ранжировать расчетные формулы по степени точности оценки СКФ по сравнению с СКФ сцинти. Так, наиболее точными явились СКФ Hoek, СКФ EPIcreat-cyst, СКФ-EPIcyst.
Корреляционные связи СКФ по данным ДНСГ и расчетных формул
|
СКФ Hoek |
СКФ-EPIcyst |
СКФ-EPIcreat-cyst |
СКФ Кокрофт-Голт |
СКФ MDRD |
|
|
СКФсцинти общая |
r=0,534 p=0,002 |
r=0,504 p=0,004 |
r=0,525 p=0,003 |
r=0,215 p=0,034 |
r=0,202 p=0,041 |
Обсуждение
При сравнительном анализе значений Vmax и Vmin в стволовых ПА у лиц с СД1 и эссенциальной АГ обращают на себя внимание более высокие величины этих показателей на у больных с эссенциальной АГ. Данный результат, возможно, объясняется тем, что манифестация эссенциальной АГ ассоциирована с повышением АД и одновременным возникновением эндотелиальной дисфункции, что формирует гипертоническую нефропатию. Что касается больных с СД1, то дебют заболевания связан с метаболическими нарушениями, которые способствуют развитию эндотелиальной дисфункции, формированию ДН и последующему возникновению АГ, которая сама по себе вносит вклад в прогрессированием диабетического повреждения почек.
Представленные в данном исследовании результаты ROC-анализа позволили установить диагностическую эффективность исследуемых лучевых и лабораторных маркеров ДН у больных с СД1.
Особый интерес представляют показатели мочевой экскреции HFABP, свидетельствующие о повреждении почечных канальцев, возникающем еще до структурно-функциональных нарушений клубочкового аппарата почек. По нашим данным, уровень экскреции HFABP с мочой равный 0,123нг/ммоль и более, полученный в ходе проведения ROC-анализа, является ранним маркером ДН у больных с СД1 на стадии НАУ. По мере нарастания альбуминурии, стажа болезни, снижения фильтрационной функции почек содержание HFABP в сыворотке и моче, IL-6 в сыворотке и IL-8 в моче нарастает, что было доказано в ходе проведения корреляционного анализа. Повышение мочевой экскреции HFABP и IL-8, а также сывороточной концентрации IL-6 при увеличении уровня альбуминурии было продемонстрировано и в ряде зарубежных исследований [8, 10, 14].
Исследование почечной гемодинамики позволило обнаружить, что стаж СД1 5-10 лет ассоциирован с повышением Vmax и Vmin на уровне ПА всех калибров. Проведенный ROC-анализ показал, что ранними маркерами нарушения почечной гемодинамики у больных СД1 со стажем 5-10лет является величина Vmax в сегментарных ПА 47,5см/с и более; Vmax в междолевых ПА - 32,5см/с и более, Vmax в дуговых ПА - 25,5см/с и более; Vmin в дуговых ПА - 10,5см/с и более.
Корреляции гемодинамических параметров с молекулярными маркерами, а также клинико-лабораторными показателями у больных СД1, выявленные в данном исследовании, доказывают, что структурно-функциональные изменения почечного русла связаны с нарушением функции тубулярного аппарата почек и процессом хронического низкоинтенсивного воспаления и прогрессируют по мере увеличения стажа заболевания, стадии ХБП, уровня альбуминурии.
Заключение
Проведенное исследование позволило доказать возможность использования лучевых (величина Vmax в сегментарных ПА 47,5см/с и более; Vmax в междолевых ПА - 32,5см/с и более, Vmax в дуговых ПА - 25,5см/с и более; Vmin в дуговых ПА - 10,5см/с и более) и лабораторных (уровень мочевой экскреции HFABP 0,123нг/ммоль и более) параметров в качестве маркеров повреждения почек, обнаружение которых возможно на ранних стадиях формирования ДН.
Библиографическая ссылка
Ворожцова И.Н., Рыжикова Ю.А., Лукьянёнок П.И., Павленко О.А. ДИАГНОСТИЧЕСКАЯ ЭФФЕКТИВНОСТЬ ЛУЧЕВЫХ И ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ КАК МАРКЕРОВ РАННЕЙ ДИАГНОСТИКИ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 1-ГО ТИПА // Современные проблемы науки и образования. 2017. № 2. ;URL: https://science-education.ru/ru/article/view?id=26208 (дата обращения: 01.02.2026).
DOI: https://doi.org/10.17513/spno.26208



