Актуальной проблемой современной стоматологии является хронический пародонтит, который характеризуется высокой распространенностью, прогрессирующим течением и разрушительными последствиями для зубочелюстной системы человека [4, 7]. Современные источники литературы трактуют пародонтит как воспалительный процесс инфекционного, травматического и инфекционного характера, отягощенного чаще всего соматической патологией. Широкое распространение получила в последние годы цитокиновая концепция развития хронического воспаления в пародонте [6]. Выявлено повышение концентрации отдельных интерлейкинов (ИЛ-1β, ИЛ-2, ФНО-α, ИЛ-6, ИЛ-18) в сыворотке крови и в десневой жидкости (ДЖ) у пациентов с пародонтитом, установлена их роль в процессах воспаления, ремоделирования и резорбции костной ткани [1–5]. Проблема участия цитокинов остается до конца не решенной. Изучение иммунологических механизмов патогенеза хронического пародонтита позволяет сделать вывод о том, что клинические проявления заболевания в большей степени зависят от активности клеток иммунитета, чем от прямого воздействия микроорганизмов, и неадекватный иммунный ответ определяет патологические изменения при хроническом пародонтите [7,8,11–15].
Клиническими наблюдениями установлено частое сочетание соматической патологии с различными формами хронического генерализованного пародонтита (ХГП). Особое внимание в этом отношении привлекает системный остеопороз [1,3, 8–10]. Остеопоротические изменения скелета достаточно рано затрагивают кости челюсти, усугубляя деструкцию альвеолярной кости и соединительной ткани пародонта [1, 2, 10]. Увеличение тяжести хронического поражения пародонта происходит по мере снижения минеральной плотности кости [4]. Однако метаболические реакции, направленные на компенсаторное усиление остеогенеза альвеолярной кости, отличающегося высокой пластичностью, не могут не отражаться на деятельности системы регуляции обмена минеральных веществ в костной ткани в целом [6]. Хотя имеющиеся данные позволяют утверждать, что снижение минерализации скелета усиливают патологические изменения в пародонте, сложность и многогранность этой проблемы обуславливает необходимость проведения дальнейших исследований.
Одним из распространенных методов коррекции дефектов зубного ряда, применяемых в современной стоматологии, является дентальная имплантация. Вместе с тем, в условиях патологии пародонта, планирование и проведение дентальной имплантации вызывает определенные сложности. Успех имплантационного лечения хронического пародонтита связан с функциональным состоянием организма, а также характером течения местных и общих метаболических процессов при приживлении имплантатов. Несмотря на очевидный прогресс данного метода лечения, появляется все больше сведений о риске осложнений, особенно отдаленных. Чем более стабилен имплантат, и чем больше выражена его интеграция с костью, тем меньше вероятность развития инфекции. Важное значение при этом имеют особенности фосфорно-кальциевого обмена, метаболизма кости с характером течения раннего постимплантационного периода, играющих существенную роль в процессах интеграции имплантата. Ингибирование костной резорбции, активация минерализации и костеобразования могут оптимизировать остеоинтеграцию дентальных имплантатов. С этих позиций представляют интерес клинические исследования, демонстрирующие, что у пациентов с заболеваниями пародонта, приводящими к выпадению зубов, выявляются пониженные показатели минеральной плотности костной ткани.
Прогрессирование пародонтита приводит к значительной потере зубов, в связи с чем растет необходимость в дентальной имплантации, при которой необходимо учитывать как состояние минеральной плотности кости, так и данные цитокинового профиля ротовой жидкости.
Цель исследования – оценить уровень провоспалительных цитокинов десневой жидкости в зависимости от минеральной плотности кости (МПК) перед дентальной имплантацией.
Материал и метод исследования
Проведено комплексное обследование 121 пациента, обратившихся на клиническую базу кафедры терапевтической стоматологии с курсом ИДПО с целью дентальной имплантации. Использовали стандартные схемы обследования на основе рекомендаций ВОЗ (1985), рассчитывались индексы КПУ, ОНi-S, CPITN, PMA, проводили рентгенологические методы исследования – ортопантомографию (ОПТГ) на аппарате GRANEX(R)Novus и объемную томографию на рентгеновской установке PlanmedaProMax 3DMax (конусно-лучевой компьютерный томограф – КЛКТ).
Из 121 пациента 37 пациентов с хроническим генерализованным пародонтитом средней степени тяжести в возрасте 35–44 года составили основную группу исследования провоспалительных циткинов. Контрольную группу составили 37 пациентов той же возрастной группы без клинических признаков пародонтита.
Уровень провоспалительных цитокинов – интерлейкина 1-бетта (ИЛ-1β), интерлейкина – 6 (ИЛ-6) и фактора некроза опухолей альфа (ФНО α) определяли методом твердофазного иммуноферментного анализа (набор реагентов OOO «Цитокин», Санкт-Петербург) на полуавтоматическом анализаторе «Униплант». Материал для исследования цитокинов забирали из пародонтальных карманов в основной группе, в контрольной группе – из зубодесневой борозды с помощью бумажных штифтов.
Оценку МПК предплечья и большеберцовой кости у 74 пациентов основной и контрольной групп осуществляли с использованием прибора "Omniseinse 7000S@" фирмы "SunlightMedicalLtd" (Израиль), определяющего скорость прохождения ультразвуковой волны (SOS, м/с) и осуществляющего пересчет результатов по Т-критерию, согласно общеевропейской программе базы данных. При необходимости осуществляли двухэнергетическую рентгеновскую абсорбциометрию (ДХА) на аппарате "Explorer" (США) костей предплечья, проксимального отдела бедра и поясничного отдела позвоночника (L1-L4).
Статистическую обработку данных осуществляли с использованием пакета программ Statistica 6,0 (StatSoft), оценивали медиану (Ме), верхний и нижний квартили (Q1-Q3), рассчитывали статистическую значимость по U-критерию Манна – Уитни с поправкой Бонферрони.
Результаты исследования
В процессе сбора анамнеза у 121 пациента перед дентальной имплантацией, согласно критериям отбора, в исследуемую группу установили следующее: по возрасту моложе 35 лет и старше 44 лет было 15 человек, с хроническими заболеваниями в стадии обострения (желудочно-кишечного тракта, патологии сердечно-сосудистой системы, заболевания почек и др.) – 16 человек, сахарный диабет – 7 человек, онкозаболевания – 3 человека, системный остеопороз – 6 человек. При стоматологическом обследовании установлено потеря зубов более 3 на одной половине челюсти – у 6 человек, тяжелая степень тяжести пародонтита у 7 человек.
При изучении стоматологического статуса 60 предварительно санированных пациентов – кариес и его осложнения выявлены у 100 % обследованных. Интенсивность кариозного процесса – индекс КПУ составил – 6,81 ± 0,97, где П – 4,31 ± 0,86, У – 2,5 ± 1,08.
Нами установлено, что частота кариеса у мужчин и женщин были одинаковой. Показатели интенсивности кариеса зубов обследованных были умеренными и не отличались у мужчин и женщин.
У 60 обследованных установлена средняя степень тяжести хронического генерализованного пародонтита. Индекс ОНi – S составил 0,21 ± 0,07, индекс критерия оценки зубного налета – 0,06 ± 0,01, глубина карманов 3,6 ± 0,83.
На ОПТГ обследованных выявлено снижение высоты межзубных перегородок на 1/3, а в некоторых группах зубов на ½. На КЛКТ – снижение краевых отделов альвеолярных отростков челюстей до ½ длины корней зубов, разрушение замыкательной и кортикальной пластинки в боковых и фронтальных отделах верхней и нижней челюстей. Единичные пародонтальные карманы. Вторичное частичное отсутствие зубов.
Проведенные исследования позволили распределить пациентов основной группы на 3 подгруппы: 1 – с физиологическим уровнем МПК (Т-индекс более –1,0 SD); 2 – со сниженной МПК (Т-индекс ниже –1,0 SD, но более –2,5 SD); 3 – с выраженным снижением МПК (Т-индекс менее –2,5 SD). Первую группу составили 16 пациентов (43,24 %), вторую – 13 (35,14 %), третью – 8 (21,62 %). Таким образом, у 56,76 % больных ХГП было выявлено снижение МПК. В контрольной группе МПК составило Т-score > –1,0SD, т. е. на физиологическом уровне.
Проведены исследования содержания провоспалительных интерлейкинов у пациентов контрольной и основной групп и получены данные их содержания в жидкости десневой борозды и пародонтальных карманов (см. табл.).
Содержание провоспалительных цитокинов в различных участках зубодесневой борозды и пародонтальных карманов в зависимости от минеральной плотности костной ткани, Ме (Q1–Q3)
|
Состояние МПК |
Группы больных |
ИЛ-1β, пг/мл |
ИЛ-6, пг/мл |
ФНО-@, пг/мл |
|
Т-score > –1,0 n = 37 |
Контрольная группа |
4,55 [3,55–4,90] |
0,12 [0,09–0,15] |
0,84 [0,66–1,09] |
|
1-я подгруппа Т-score > –1,0 n=16 |
Основная группа |
9,95* [9,05–13,10] |
0,89* [0,82–1,45] |
1,80* [1,39–2,14] |
|
2-я подгруппа Т-score от –1,0 до –2,5; n = 13 |
Основная группа |
11,45* [9,80–14,40] |
1,28* [0,97–1,46] |
2,02* [1,46–2,18] |
|
3-я подгруппа Т-score < –2,5; n = 8 |
Основная группа |
13,75*,** [11,65–16,55] |
1,44*,** [1,04–1,87] |
2,26*,** [1,98–2,56] |
Примечание: *) р < 0,05 между содержанием цитокинов в контрольной и основной группе; **) р < 0,05 по сравнению с 1-й группой; ***) р < 0,05 – по сравнению со 2-й группой.
Показатели провоспалительных цитокинов в десневых бороздах пациентов контрольной группы были приняты за показатели нормы.
При ХГП в пародонтальных карманах увеличение уровней цитокинов выражено в разной степени. Содержание ИЛ-1ß и ФНО-α у всех 3 подгрупп пациентов повышалось более чем в 2 раза, а ИЛ-6 – в 7,5–8 раз по сравнению с контролем (рис. 1–3).
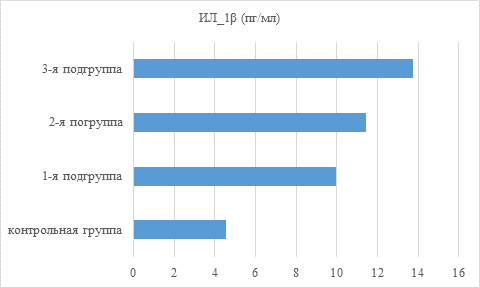
Рис. 1. Показатель содержания провоспалительного цитокина ИЛ-1ß в пародонтальных карманах пациентов основной и контрольной группы в зависимости от состояния минеральной плотности кости
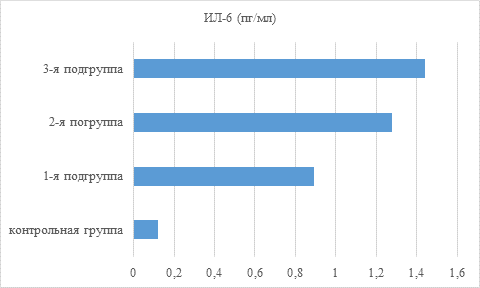
Рис. 2. Показатель содержания провоспалительного цитокина ИЛ-6 в пародонтальных карманах пациентов основной и контрольной группы в зависимости от состояния минеральной плотности кости
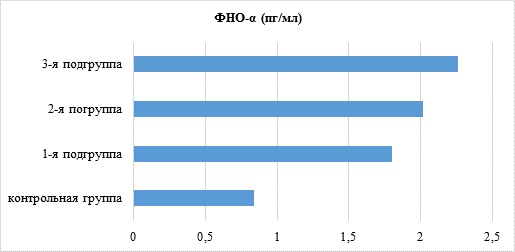
Рис. 3. Показатель содержания провоспалительного цитокина ФНО-α в пародонтальных карманах пациентов основной и контрольной группы в зависимости от состояния минеральной плотности кости
Статистически значимые различия в содержании цитокинов в пародонтальных карманах в зависимости от величины снижения МПК выявились между пациентами 1-й и 3-й подгрупп, характеризуя в определенной степени наличие патогенетических причинно-следственных связей развития ХГП и остеопенического синдрома.
Заключение
При ХГП содержание провоспалительных цитокинов в пародонтальных карманах прямо пропорционально увеличивается (ИЛ-1ß, ФНО-α более чем в 2 раза, а ИЛ-6 в 7,5–8 раз) по сравнению с десневой жидкостью в зубодесневых бороздах зубов без клинических признаков пародонтита у пациентов контрольной группы с физиологическим уровнем МПК. Показатели уровня провоспалительных цитокинов и минеральную плотность кости следует учитывать перед проведением дентальной имплантации.
Библиографическая ссылка
Шаймарданов Т.Н., Герасимова Л.П., Чемикосова Т.С., Камилов Ф.Х. ОЦЕНКА УРОВНЯ ПРОВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ У ПАЦИЕНТОВ С ХРОНИЧЕСКИМ ПАРОДОНТИТОМ В ЗАВИСИМОСТИ ОТ МИНЕРАЛЬНОЙ ПЛОТНОСТИ КОСТИ ПЕРЕД ДЕНТАЛЬНОЙ ИМПЛАНТАЦИЕЙ // Современные проблемы науки и образования. 2017. № 1. ;URL: https://science-education.ru/ru/article/view?id=26144 (дата обращения: 03.02.2026).



