Фитогормоны – вещества, контролирующие рост и развитие растений. Среди гормонов-стимуляторов роста выделяют три основные группы: ауксины, цитокинины и гиббереллины [1].
Ауксины – гормоны апекса побега и сигнализируют о его росте в сторону корневой системы, стимулируя ризогенез. Цитокинины, наоборот, синтезируются в апексе корня и свидетельствуют о его активном росте в сторону надземной части. Баланс ауксинов и цитокининов контролирует процессы деления клеток. Для влияния гиббереллинов характерно удлинение стебля и стимуляция прорастания семян [5].
Известно, что бактерии, мицелиальные грибы, а также водоросли - активные производители растительных гормонов. Фитогормональная активность некоторых связана с патогенностью [14], но тем не менее очень многие непатогенные микроорганизмы - эпифиты и педобионты - также активно синтезируют растительные гормоны. Большое количество исследований показывает, что такие микроорганизмы влияют на рост и развитие высших сосудистых растений, причем наблюдаются разнообразные эффекты – усиление ризогенеза, удлинение стебля и корня [9; 13]. Это указывает на вероятную особую роль фитогормональной активности в установлении коэволюционных связей между растениями и микроорганизмами в фитоценозах [7].
В отличие от бактерий и мицелиальных грибов экосистемная роль дрожжей мало изучена с точки зрения фитогормональной активности, но при этом представляет большой интерес, так как дрожжи являются типичными обитателями филлосферы и ризосферы, где их численность может достигать 107 КОЕ/г [2].
Только в последние годы появились данные, что дрожжи являются активными производителями 3-индолилуксусной кислоты (ауксина), не уступая по интенсивности синтеза мицелиальным грибам [10]. Было показано, что способность к синтезу ауксина среди дрожжей широко распространена – до 92% исследованных штаммов оказались активными [6]. Имеются также данные о стимулирующем влиянии ауксин-производящих дрожжей на рост инокулированных растений [12]. Что касается способности дрожжей к синтезу других фитогормонов, то об этом нет практически никакой информации.
Цель исследования: провести скрининг штаммов дрожжей на присутствие фитогормонов-стимуляторов в культуральной жидкости при помощи ВЭЖХ-МС/МС и изучить их влияние на рост проростков кресс-салата.
Объекты и методы
Мы провели исследование значительной (более 100 штаммов) выборки дрожжей на присутствие фитогормонов в культуральной жидкости. Идентификация штаммов проводилась на основании данных о нуклеотидной последовательности D1/D2 доменов рДНК по описанным ранее методикам [3]. Выделение штаммов проводилось в 2009-2015 годах, хранение штаммов осуществлялось в 15%-ном растворе глицерина при -20 ºС.
Для получения культуральной жидкости штаммы дрожжей в виде первоначального инокулята размером в 2 захвата петли инкубировали в микробиологических матрацах Greiner 200 на шейкере в течение 10 дней в термостате при 20 ºС. Среду для наработки культуральной жидкости приготовляли из расчёта 6,7 г азотной основы (Fluka) и 5 г глюкозы на один литр воды. После снятия с шейкера культуральную жидкость переносили во флаконы объемом 50 мл, центрифугировали в течение 10 мин при 11500 G и отбирали супернатант.
Для мониторинга мы выбрали самые распространенные в природе соединения из каждой группы растительных гормонов-стимуляторов роста: из ауксинов – 3-индолилуксусную кислоту (ИУК); из цитокининов – зеатин; из гиббереллинов – гиббереллиновую кислоту (ГА3).
Для экстракции ИУК и ГА3 культуральную жидкость подкисляли до pH=3 муравьиной кислотой и наносили на концентрирующий патрон С-18 500 мг фирмы Cromabond (США), пропуская со скоростью 1 капля/сек [11]. Патрон предварительно подготавливали последовательным пропусканием 5 мл воды и 5 мл этанола. Прошедшую через патрон культуральную жидкость отбрасывали, а гормоны смывали 5 мл смеси этанол–вода–муравьиная кислота (80:20:0,5% v/v) в отгонную колбу. Концентрирование осуществляли на роторном испарителе при 30 ºС и 50 оборотах в минуту, испаряя содержимое колбы до тех пор, пока на дне не оставалась одна капля воды (<0,5 мл). Остаток после испарения переносили в хроматографическую виалу объемом 1,5 мл, а в колбу добавляли 0,5 мл ацетонитрила и помещали в ультразвуковую ванну на 1 мин для отделения ИУК и ГА3 от стенок колбы. Ацетонитрил из колбы переносили в виалу, после чего снова добавляли в колбу 0,5 мл ацетонитрила и повторяли обработку. Если это было необходимо, то доводили содержимое виалы ацетонитрилом до 1,5 мл.
Количественное определение ИУК проводили на высокоэффективном жидкостном хроматографе Agilent 1200 series c квадруполь-времяпролетным масс-спектрометрическим детектором (6520 Accurate-Mass Q-TOF LC/MS Agilent Technologies). Источник ионизации – электроспрей (-), напряжение на входном капилляре – +2500V, напряжение на ячейке соударения 15V. Ионы - прекурсоры: ауксин - m/z=174,06; ГА3 – m/z=345,14. Колонка ВЭЖХ RP-8 3.5 мкм 4,6х200 мм. Скорость потока элюента 0.5 мл/мин. Подвижная фаза – муравьиная кислота 10 мМ и ацетонитрил (60:40 v/v). Объем вводимой пробы – 25 мкл. Температура термостата колонок – 30 ºС.
Для экстракции зеатина культуральную жидкость подкисляли до pH=3 муравьиной кислотой и наносили на катионит Dowex, пропуская со скоростью 1 капля/сек [8]. Патрон предварительно подготавливали последовательным пропусканием 5 мл этанола и 5 мл 1М муравьиной кислоты. Прошедшую через катионит культуральную жидкость отбрасывали, а зеатин смывали 6 мл 0,35М гидроксида аммония. Далее элюат нейтрализовывали муравьиной кислотой и наносили на концентрирующий патрон С-18 500 мг фирмы Cromabond (США), пропуская со скоростью 1 капля/сек. Патрон предварительно подготавливали последовательным пропусканием 5 мл воды и 5 мл этанола. Прошедшую через патрон пробу отбрасывали, а зеатин смывали 5 мл метанола. Концентрирование экстракта проводили так же, как для ИУК и ГА3.
Количественное определение зеатина проводили на вышеупомянутом хроматографе Источник ионизации – электроспрей (+), напряжение на входном капилляре – -3500 V, напряжение на ячейке соударения 15 V. Ион - прекурсор: m/z=220,12. Колонка ВЭЖХ RP-8 3,5 мкм 4,6х200 мм. Скорость потока элюента 0,5 мл/мин. Подвижная фаза – муравьиная кислота 10 мМ и ацетонитрил (60:40 v/v). Объем вводимой пробы – 10 мкл. Температура термостата колонок – 30 ºС.
Эксперимент с кресс-салатом проводили в чашках Петри (d=9см.), семена раскладывали по 10 штук на фильтровальную бумагу, смоченную культуральной жидкостью, разведенной в минеральной смеси Кнопа [4]. Эксперимент проводили в 5 повторностях. Разведения были от 1/1000 до 1/1000000, при меньших разведениях наблюдалось практически полное ингибирование роста проростков. В качестве контроля использовалась смесь Кнопа без добавки культуральной жидкости. Чашки с семенами помещались в термостат на трое суток при температуре 25 °С, после чего проводилось измерение длины корешков и стеблей миллиметровой линейкой. Затем проростки с удаленными остатками эндосперма помещались в доведенные до постоянной массы бюксы (один бюкс на вариант эксперимента) и высушивались при 50 °С в вакуумном шкафу в течение 3 суток. После высушивания бюксы взвешивались на аналитических весах.
Результаты и обсуждение
Мы выбрали 6 наиболее представительных штаммов, проявляющих высокую активность по различным гормонам: D41 - Metschnikowia pulcherrima, выделен в респ. Дагестан с листьев винограда; 327v - Rhodotorula mucilaginosa, выделен на острове Диксон со мха; 249-1v - Aureobasidium pullulans, выделен на Чукотке с поверхности мумии бизона; 2-15 - Saitozyma podzolica, выделен в Тверской области с поверхности мумии бизона; SH-19 - Pseudozyma hubeiensis, выделен на острове Шри-Ланка с поверхности растений; 25-10 - Candida trypodendroni, выделен во Вьетнаме из термитов. Измеренные концентрации фитогормонов приведены в таблице 1.
Таблица 1
Фитогормональная активность исследованных штаммов
|
№ штамма |
ИУК |
Зеатин |
ГА3 |
№ штамма |
ИУК |
Зеатин |
ГА3 |
|
|
мкг/л |
нг/л |
мкг/л |
нг/л |
|||||
|
D41 |
18693,3 |
3201,3 |
906,7 |
2-15 |
22206,7 |
0,0 |
0,0 |
|
|
249-1в |
766,7 |
260,0 |
340,0 |
SH-19 |
60,0 |
2386,7 |
0,0 |
|
|
327v |
7593,3 |
150,0 |
53,3 |
25-10 |
5033,3 |
0,0 |
460,0 |
|
Соответственно, штаммы D41, 249-1v и 327v проявляют высокую активность по всем трем гормонам и обозначаются как «первая группа» – наиболее важные. Сначала было исследовано влияние этих штаммов на рост кресс-салата, чтобы оценить весь возможный спектр эффектов. Оказалось, что культуральная жидкость данных штаммов вызывает сразу три эффекта: удлинение корня, удлинение стебля и увеличение общей массы проростков (рис. 1).
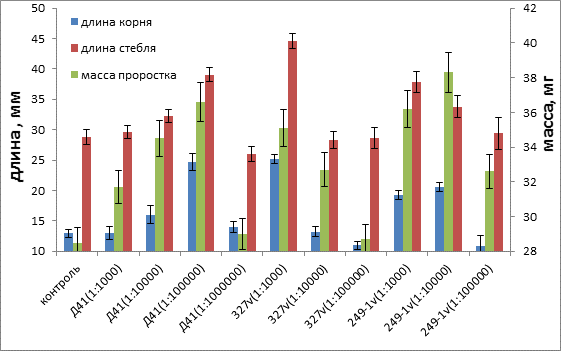
Рис. 1. Изменение длины (мм) корней и стеблей и массы (мг) проростков кресс-салата под влиянием культуральной жидкости штаммов D41, 327v и 249-1v в разных разведениях
Корень по сравнению с контролем увеличивается до 2 раз, стебель до 1,5 раз. До 35% увеличивается масса проростков. Наиболее активный продуцент ауксина штамм D41 проявляет максимальную стимуляцию длины корня при разведении 1:100000. Для достижения такого же эффекта культуральную жидкость штамма 327v достаточно развести в 1000 раз. Данный штамм хотя и синтезирует в ауксин, но значительно уступает штамму D41 по максимальной концентрации. Штамм 249-1v стимулирует рост корня заметно слабее, чем два других штамма, при этом он наименее активен в синтезе гормонов, в т.ч. и ауксина. По стимуляции длины стебля и общей массы проростка все штаммы похожи по величине максимальных эффектов, но для их достижения также требуются разные разведения культуральной жидкости (рис. 1).
Для оценки влияния отдельных гормонов в составе культуральной жидкости на рост кресс-салата было проведено фитотестирование штаммов «второй группы» - обладающих разным фитогормональным спектром.
Штамм 2-15 – высокоактивный производитель ауксина, но неспособен к синтезу зеатина и ГА3. Его культуральная жидкость вызывает стимуляцию роста корней более чем в три раза в разведении 1:100000, что превышает эффект штаммов из первой группы. При этом увеличения длины стебля не наблюдается. Максимальная прибавка к массе – порядка 16% также в разведении 1:100000, что в 2 раза меньше, чем наблюдалось у штаммов первой группы (рис. 2).
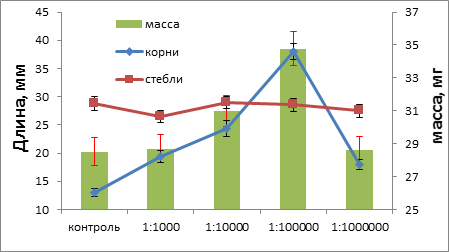
Рис. 2. Изменение длины (мм) корней и стеблей и массы (мг) проростков кресс-салата под влиянием культуральной жидкости штамма 2-15 в разном разведении
Культуральная жидкость штамма SH-19, активно синтезирующего зеатин, малоактивного производителя ИУК и не способного к синтезу ГА3, стимулирует удлинение стебля в 1,5 в максимальном разведении, что не уступает максимальному эффекту, наблюдаемому у штаммов первой группы. Также наблюдается небольшое, порядка 20%, удлинение корня в разведении 1:1000. Прибавка массы такая же, как у штамма 2-15, т.е. в 2 раза ниже, чем у штаммов первой группы (рис. 3).
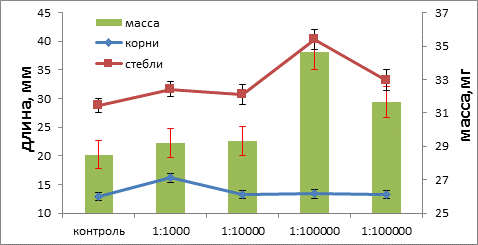
Рис. 3. Изменение длины (мм) корней и стеблей и массы (мг) проростков кресс-салата под влиянием культуральной жидкости штамма SH-19 в разном разведении
Штамм 25-10, активный производитель ГА3 и ИУК, но не способный к синтезу зеатина, в разведении 1:1000 стимулирует удлинение корня в 3,5 раза и одновременно увеличение массы проростков на 18% при отсутствии эффектов на корне, что примерно соответствует значениям, полученным для штамма 2-15, который также активно синтезирует ИУК и не продуцирует зеатин. В разведении 1:100000 штамм 25-10, не влияя на длину корня, стимулирует удлинение стебля в 1,5 раза, при этом масса проростка увеличивается более чем на 35%, т.е. как у штаммов первой группы. Возможно, этот эффект связан с присутствием ГА3в культуральной жидкости (рис. 4).
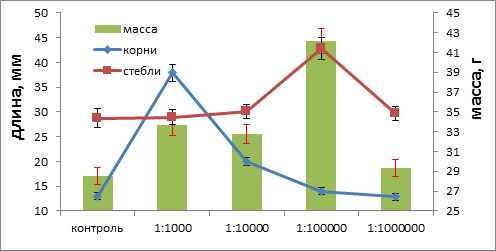
Рис. 4. Изменение длины (мм) корней и стеблей и массы (мг) проростков кресс-салата под влиянием культуральной жидкости штамма 25-10 в разном разведении
Интенсивность синтеза фитогормонов и выраженность эффектов на рост кресс-салата у разных штаммов дрожжей приведена в таблице 2 в обобщенной форме. Можно видеть, что стимуляция роста корня связана с присутствием ауксина, а на рост стебля влияют ауксин и гиббереллин. Значительное увеличение массы проростка также связано с присутствием гиббереллина. Необходимо учитывать, что фитогормоны действуют совместно, образуя баланс, определяющий эффекты. Нужно иметь в виду, что в культуральной жидкости присутствуют и другие биологически активные вещества, в частности фенольные соединения и органические кислоты, которые также влияют на рост растений. Тем не менее можно констатировать, что дрожжи оказывают разные эффекты на рост проростков, обладая при этом различной фитогормональной активностью. К тому же культуральная жидкость в экспериментах использовалась в большом разведении, когда многочисленные нецелевые соединения оказываются в низких концентрациях и их физиологическая активность должна быть слабо выражена.
Таблица 2
Проявление фитогормональной активности исследованными дрожжами и оказание эффектов на рост проростков кресс-салата
|
№ штамма |
ИУК |
Зеатин |
ГА3 |
Стимуляция корней |
Стимуляция стеблей |
Увеличение массы |
|
D41 |
+ |
+ |
+ |
+ |
+ |
+ |
|
249-1в |
+ |
+ |
+ |
+ |
+ |
+ |
|
327v |
+ |
+ |
+ |
+ |
+ |
+ |
|
2-15 |
+ |
- |
- |
+ |
- |
+/- |
|
SH-19 |
+/- |
+ |
- |
+/- |
+ |
+/- |
|
25-10 |
+ |
- |
+ |
+ |
+ |
+ |
Примечание: (+) - свойство ярко выражено; (+/-) - свойство слабо выражено; (-) - свойство не выражено.
Заключение
Показано, что дрожжи, так же как мицелиальные грибы и бактерии, активно синтезируют растительные гормоны: 3-индолилуксуную кислоту, зеатин и ГА3. Дрожжи, способные к синтезу одновременно трех фитогормонов, стимулируют рост корней и стеблей кресс-салата, а также вызывают увеличение массы проростков. Дрожжи, отличающиеся фитогормональным профилем, оказывают разные эффекты на рост кресс-салата. Культуральная жидкость штаммов, синтезирующих ИУК, вызывает удлинение корней, синтезирующих зеатин и ГА3 – удлинение стеблей. Также наблюдается увеличение массы проростков, но максимальных значений оно достигает у только штаммов, способных к синтезу ГА3. Чем выше концентрация фитогормонов в культуральной жидкости, тем большее разведение требуется для оказания максимального эффекта. Способность дрожжей синтезировать гормоны может быть использована при создании биологических удобрений и ростостимуляторов.
Библиографическая ссылка
Стрелецкий Р.А., Качалкин А.В., Федотов Г.Н. ВЛИЯНИЕ ДРОЖЖЕЙ-ПРОДУЦЕНТОВ ФИТОГОРМОНОВ НА РАЗВИТИЕ ПРОРОСТКОВ LEPIDIUM SATIVUM // Современные проблемы науки и образования. 2017. № 1. ;URL: https://science-education.ru/ru/article/view?id=26101 (дата обращения: 06.02.2026).



