В настоящее время композиции, содержащие различные формы серебра, все более активно внедряются в общехирургическую практику и применяются в виде повязок, мазей, гелей, растворов [3,6]. Интерес к таким препаратам, как к антисептическим агентам, объясняется высокой бактерицидной активностью нанокластеров серебра [13], сравнительно низкой токсичностью и избирательной активностью в отношении, преимущественно, патогенной микрофлоры [5]. В то же время результаты некоторых исследований не позволяют говорить об абсолютной безопасности имеющихся форм рассматриваемых препаратов [16] и демонстрируют их склонность к коагуляции под действием кислорода воздуха [8]. Это стимулирует дальнейший поиск новых форм нанокластеров серебра, устойчивых к воздействию неблагоприятных факторов внешней среды и обладающих высокой эффективностью при местном применении. Для достижения такого результата было разработано устройство [2], позволяющее получить гомогенные и стабильные при хранении коллоидные растворы [4] нанокластеров серебра с достаточной высокой антисептической активностью.
Цель работы
Оценка течения раневого процесса путем сравнительного анализа клеточного состава поверхностного слоя гнойных ран при их лечении новой формой нанокластерного серебра в условиях моделирования гнойной раны у лабораторных животных.
Материалы и методы
Объектом исследования послужили 30 кроликов-самцов массой 2,6–2,7 кг, которые были разделены на 3 группы: группа «К», в которой для лечения формируемых гнойных ран применялась мазь «Левомеколь», (n=10); группа «С», в которой использовался 5 % препарат «Аргогель», (n=10); группа «О» которой выполнялось лечение раствором нанокластерных частиц серебра в концентрации 0,06 %, (n=10). В раствор нанокластеров серебра был добавлен желатин до концентрации 0,9 % для достижения гелеобразной консистенции.
Модель гнойной раны создавали путем предварительного формирования абсцесса согласно методике [1], предусматривающей послойное рассечение кожи, подкожной клетчатки, пояснично-спинной и поверхностной фасции, собственной фасции мышцы выпрямителя спины с внесением в рану марлевого шарика, содержащего суточную культуру штамма St. aureus в концентрации 103/мл-108/мли последующим ушиванием раны кисетным швом. На 3 сутки с момента имплантации марлевого шарика снимали швы, удаляли инородное тело и санировали полость сформировавшегося абсцесса. Для обезболивания использовалась комбинация препаратов «Ксилазин» 2 % в дозировке 0,1 мл/кг и «Золетил 100» в дозировке 10 мг/кг.
Оценку цитологических показателей раневой поверхности проводили на основе метода поверхностной биопсии по М.Ф. Камаеву [7] на 1, 4, 8, 12, 14 сутки с момента вскрытия формируемого абсцесса. В дальнейшем производилась окраска цитограмм по Романовскому – Гимза. Клеточный состав выражался в процентах, для чего выполнялся подсчет от 100 до 200 клеток на различных участках цитограммы.
Лабораторные животные содержались в условиях вивария ФГБОУ ВО КубГМУ Минздрава России со свободным доступом к воде и получали стандартный рацион питания. Экспериментальную работу осуществляли в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приказ МЗ СССР № 755 от 12.08.1987 г.), Федеральным Законом РФ «О защите животных от жестокого обращения» от 01.01.1997 г.
Статистическая обработка результатов исследования производилась при помощи системы статистического анализа R (R Development Core Team, 2008), использовался метод сравнения гипотез по критерию Манна – Уитни, достоверными были приняты отличия при вероятности возможной ошибки менее 0,05. Результаты приведены в виде среднего арифметического (M) и ошибки среднего арифметического (m).
Результаты и обсуждения
Цитограммы, полученные на 1 сутки проведения эксперимента, характеризовались большим количеством клеточных элементов, представленных преимущественно нейтрофильными лейкоцитами (граф. 1), отмечались единичные фибробласты (граф. 2). Различий между группами в этот период отмечено не было.
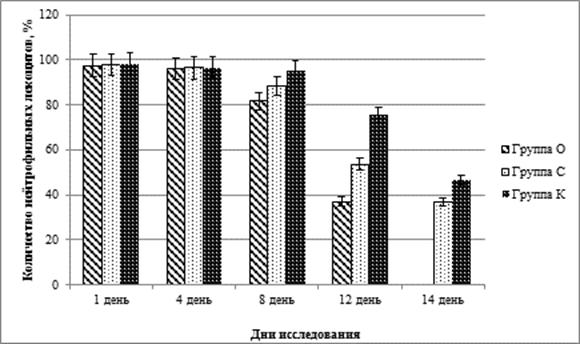
График 1. Динамика количества нейтрофильных лейкоцитов (M±m)
На 4 сутки клинически продолжалась гнойно-некротическая фаза раневого процесса, по сравнению с 1 сутками количество нейтрофильных лейкоцитов в цитограммах практически не изменилось. Количество фибробластов в этот период несколько возросло, но значительного увеличения числа этих клеток отмечено не было.
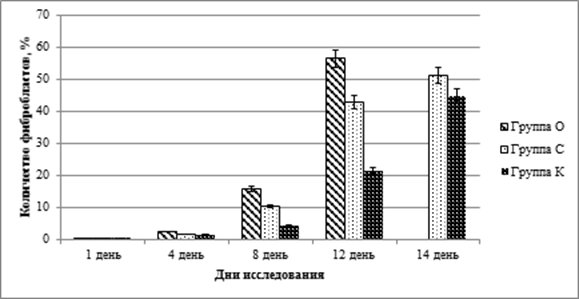
График 2. Динамика количества фибробластов (M±m)
На 8 день клинически наблюдалось очищение ран от некротических масс во всех исследуемых группах, отделяемое их ран оставалось преимущественно гнойным. В группах «С» и «О» отмечалось появление небольшого количества грануляций, в группе «К» подобные изменения наблюдались только в 1 случае из 10. В цитограммах, по сравнению с 4 сутками, было отмечено снижение количества нейтрофилов в группе «К» (на 1,5 %), в группе «О» (на 15 %), в группе «С» (на 8 %), достоверные отличия (p<0,01), по сравнению с результатами предыдущего измерения, были отмечены только в двух последних группах исследования.
Количество фибробластов с момента предыдущего измерения изменилось следующим образом: в группе «О» наблюдалось увеличение числа этих клеток в 6,8 раза, в группе «С» в 6,3 раза и в группе «К» в 3,2 раза. Наблюдаемые отличия обладали достоверностью (p<0,01) во всех 3 исследуемых группах.
При сравнении групп между собой количество нейтрофилов в группе «К» достоверно превышало показатели группы «С» на 7,4 % и группы «О» на 16,4 %. Количество фибробластов в группе «О» более чем в 1,5 раза превышало аналогичный показатель группы «С» и более чем в 3 раза результаты измерения в группе «К».
Таким образом, наблюдаемые на 4 сутки эксперимента отличия между группами не только сохранялись, но и возрастали, достигая уровня статистической достоверности. Число фибробластов при этом демонстрировало намного более выраженную динамику по сравнению с количеством нейтрофильных лейкоцитов. Это связано не только с воздействием на модель гнойной раны применяемых в исследовании антисептических средств, но и с малым количеством клеток, полученных во время предыдущего периода исследования. Сохраняющееся большое количество нейтрофилов не позволяет говорить о прекращении гнойно-воспалительного процесса, но наблюдаемое в то же время снижение числа этих клеток в группах «О» и «С», наряду с увеличением количества фибробластов и клиническими изменениями в этот период, свидетельствует о частичной смене фазы раневого процесса в этих группах. В группе «К» подобные изменения наблюдались только в 1 случае, количество нейтрофилов, в среднем, превышает 90 % от всего клеточного состава цитограммы, число фибробластов сравнительно невелико, что позволяет говорить о задержке ран в гнойно-некротической фазе раневого процесса.
На 11 сутки исследования в цитограммах в целом общее количество клеточных элементов заметно снизилось. В группе «К» наблюдался 1 случай заживления, сопровождающийся сменой характера экссудата на серозный с последующим формированием на поверхности раны плотного, не снимающегося во время выполнения перевязки струпа. На 12 сутки подобная картина была отмечена еще в 4 случаях. В группе «О» на 12 сутки заживление раны наблюдалось уже в 7 случаях из 10, в оставшихся ранах было отмечено большое количество грануляций и появление по краям раны легко снимающегося при перевязке струпа. В группе «С», несмотря на смену характера экссудата, образования струпа отмечено не было.
Определение клеточного состава раневой поверхности на 12 сутки выявило в группе «О» снижение количества нейтрофилов в 2,2 раза и повышение количества фибробластов в 3,5 раза. В группе «С» за тот же период число нейтрофильных лейкоцитов снизилось на 37,3 %, количество фибробластов возросло в 4,1 раза, в группе «К» число нейтрофилов снизилось на 20,6 %, количество фибробластов возросло практически в 5 раз.
Существенное увеличение числа фибробластов в цитограммах разных групп связано с естественными процессами заживления гнойной раны. Сохраняющееся большое количество нейтрофилов в группе «К» отражает продолжающийся процесс воспаления [12], но к 12 суткам в этой группе уже был отмечен 1 случай заживления раны. Наименьшим количеством нейтрофилов характеризовалась группа «О», что, в совокупности с заживлением большей части ран в этой группе, позволяет говорить об эффективности применяемых нанокластеров серебра. В группе «С», несмотря на наблюдавшееся значительное увеличение количества фибробластов и выраженное снижение количества нейтрофильных лейкоцитов, случаев заживления ран отмечено не было.
К 14 суткам эксперимента наблюдалось заживление всех ран в группе «О». У 5 из 7 животных этой группы в связи с полной эпителизацией раневой поверхности произошло отторжение сформированного ранее струпа.
В группе «К», при наличии серозно-гнойного экссудата, образование плотного струпа было отмечено у 7 животных из 10, на 14 суткам случаев отторжения струпа у животных этой группы не наблюдалось. В группе «С» к 14 суткам в ранах отмечалось большое количество сравнительно крупных грануляций, имело место формирование легко снимающегося тонкого струпа, легко удаляемого во время выполнения перевязок.
В цитограммах еще более снизилось количество клеточного компонента. По сравнению с предыдущим измерением количество нейтрофильных лейкоцитов в группе «К» снизилось на 32,2 % и в группе «С» на 24,2 %, количество фибробластов возросло в группе «К» в 2,1 раза, в группе «С» на 39,5 %.
При сравнении количества клеточных элементов цитограмм между группами на 14 исследования было выявлено, что в группе «К» незначительно преобладали нейтрофилы, превышая аналогичный показатель группы «С» на 26,7 %. В группе «С» наблюдалось преобладание фибробластов, где этот показатель превышал результаты измерения в группе «К» на 14,8 %. Несмотря на значительное количество фибробластов и небольшое, по сравнению с группой «К», количество нейтрофильных лейкоцитов, в цитограммах группы «С» мы наблюдали задержку перехода ран в фазу эпителизации. Это могло быть связано с нарушением процессов регенерации [10], в том числе за счет развития окислительного стресса на местном уровне [9, 11, 14, 15]. Также необходимо отметить возникновение в группе «С» осложнения – повторного нагноения раны с развитием обширной флегмоны, что привело к необходимости выполнения эвтаназии лабораторного животного.
Окончательное заживление оставшихся экспериментальных ран произошло на 16 сутки проведения исследования (таблица).
Течение раневого процесса при лечении экспериментальных гнойных ран раствором нанокластерных частиц серебра (M±m)
|
Группа |
Время заживления раны, сут. |
Повторное нагноение раны, n случаев |
|
Группа«К» |
12,9±1,3 |
0 |
|
Группа«С» |
15,4±0,5 |
1 |
|
Группа«О» |
11±1,6# ## |
0 |
Примечание: # – p<0,05 по сравнению с группой «К», ## – p<0,05 по сравнению с группой «С».
Выводы
Под действием разработанных наночастиц серебра отмечено благоприятное течение раневого процесса, что подтверждается достоверным (p<0,05) ускорением нарастания количества фибробластов и снижения количества нейтрофильных лейкоцитов по сравнению с применением мазевой повязки и коммерческого препарата наночастиц серебра.
Библиографическая ссылка
Малышко В.В., Федосов С.Р., Савченко Ю.П. ЦИТОЛОГИЧЕСКАЯ КАРТИНА РАНЕВОЙ ПОВЕРХНОСТИ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ЛЕЧЕНИИ ГНОЙНЫХ РАН КОЛЛОИДНЫМ АНТИСЕПТИЧЕСКИМ СРЕДСТВОМ // Современные проблемы науки и образования. 2017. № 1. ;URL: https://science-education.ru/ru/article/view?id=26095 (дата обращения: 12.02.2026).



