Проблема воспроизводимости результатов доклинических исследований и их эффективного транслирования в клинические является важной для теоретической медицины. Достаточно много работ посвящено раскрытию причин невозможности воспроизведения и/или не подтверждения результатов исследований одних лабораторий другими. Одной из причин возникновения таких ситуаций является недостаточное раскрытие в публикациях или отчетах условий проведения эксперимента. В настоящей работе мы хотели показать, что при проведении исследований, трактовке и публикации результатов исследователю необходимо уделять более пристальное внимание описанию важнейших физиологических параметров животного, таких как артериальное давление (АД), частота сердечных сокращений (ЧСС), температура тела и концентрация глюкозы в крови. При выполнении экспериментов с перевязкой общих сонных артерий (ОСА) (модель является широко распространённой, простой в исполнении и используется для скрининга церебропротективных средств [1-3]) мы столкнулись со значительным разбросом данных артериального давления после наркотизации. В качестве средства для наркотизации экспериментальных животных мы использовали внутрибрюшинные инъекции раствора хлоралгидрата 400 мг/кг, приготовленного ex tempore. Хлоралгидрат является средством, широко используемым для обезболивания и наркотизации лабораторных животных во всем мире [6; 8], в то же время на территории РФ он с этой целью применяется в подавляющем большинстве случаев. Хлоралгидрат был открыт более 150 лет назад, и его эффекты на организм достаточно подробно описаны во многих экспериментальных и клинических работах. В низких дозах (50-300 мг/кг внутрибрюшинно (в/б)) вызывает седацию, при повышении (300-500 мг/кг, в/б) – оказывает наркотизирующее действие [10]. При внутрибрюшинном введении животным хлоралгидрата в дозах, вызывающих наркоз, могут наблюдаться некоторые эффекты, которые существенно влияют на результат эксперимента, способны усугублять моделируемую патологию (перевязка общих сонных артерий при АД, приближающемся к 50 мм рт. ст., воспроизводит глобальную ишемию головного мозга) и/или изменять действие исследуемого фармакологического агента. Среди побочных эффектов хлоралгидрата следует выделить воспаление селезеночной капсулы, язвы желудка [9], тяжелую атоническую непроходимость кишечника [5; 7], перитонит. Риск развития нежелательных явлений увеличивается при повторении инъекций хлоралгидрата [6; 8].
В связи с вышеизложенным целью настоящей работы являлось обобщение данных, связанных с внутрибрюшинным введением хлоралгидрата, его влиянием на системные показатели лабораторных крыс, которые в свою очередь значимо влияют на моделируемую патологию и/или действие исследуемых веществ.
Материалы и методы
Обобщены данные экспериментов по изучению влияния наркотизации хлоралгидратом на АД, ЧСС, концентрацию глюкозы в крови, скорость ее утилизации и температуру тела, а также выживаемость животных после моделирования ишемии головного мозга (ГМ) посредством перевязки ОСА.
Эксперименты выполнены на 68 крысах-самцах линии Wistar (питомник лабораторных животных «Рапполово» Санкт-Петербург, РФ) (5-6 месяцев, 250±10 граммов), которые содержались в условиях стандартного вивария со свободным доступом к воде и пище (брикетированный корм ГОСТ Р 51849-2001 (ООО «Лабораторкорм», Москва, РФ)).
Введение хлоралгидрата (400 мг/кг, в/б) с последующим измерением АД и ЧСС проводили два раза: первый за 24 часа, второй за 30 минут до перевязки общих сонных артерий. АД и ЧСС измеряли с использованием прибора CODA-6 (Kent Scientific, Torrington, США). Предварительно крыс в течение 5 дней приучали к пеналам установки, сажая животных в них 1 раз в день на 5 минут. В течение 3 дней после перевязки ОСА регистрировалось количество погибших животных.
Температуру тела регистрировали ректально до и после наркотизации животных. Температура окружающей среды поддерживалась в диапазоне 23-25 ºС, но для того чтобы также оценить ее влияние на выживаемость животных после перевязки общих сонных артерий, в одной из экспериментальных серий (15 животных) она повышалась до 33-35 ºС.
Влияние внутрибрюшинного введения хлоралгидрата на скорость утилизации глюкозы при проведении перорального теста на толерантность к глюкозе (ПТТГ) оценивалось в отдельной экспериментальной серии (10 животных) по изменению её концентрации в крови наркотизированных и бодрствующих крыс. Для этого 10 интактными крысам-самцам перорально вводили р-р глюкозы (40%, 3 г/кг), затем 5 из них наркотизировали, а 5 оставляли бодрствующими, концентрацию глюкозы в крови оценивали через 30, 60 и 120 минут после её введения [4]. Уровень гликемии определяли глюкометром Контур ТС (Bayer, Германия), кровь для анализа забирали путём пункции хвостовой вены.
Для выявления отдаленных последствий наркотизации хлоралгидратом, главным образом со стороны ЖКТ животного, мы посчитали целесообразным постараться проанализировать частоту их развития при 30-дневном наблюдении. В данной экспериментальной серии использовались животные после ПТТГ.
Статистическую обработку результатов исследования проводили с использованием программного обеспечения Prism 5 (GraphPad Software Inc., США). Для проверки распределения данных эксперимента на нормальность использовали критерий Шапиро-Уилка. В зависимости от характера данных использовали следующие методы статистического анализа: ранговый однофакторный дисперсионный анализ Краскела-Уоллиса, критерий Дана, t-критерий Стьюдента с поправкой Бонферрони. Статистически значимыми расценивались эффекты при p<0,05. Данные представлены на рисунках в виде медианы или значений (оцениваемого показателя) по каждому животному, а в тексте в виде среднего ± стандартное отклонение.
Результаты исследования
Артериальное давление (АД) животных до наркотизации хлоралгидратом составляло 121±10,1 мм рт. ст. (систолическое артериальное давление (САД)) и 92,9±10,3 мм рт. ст. (диастолическое артериальное давление (ДАД)). После инъекции хлоралгидрата АД экспериментальных животных снизилось до значений 89,7±15,3 мм рт. ст. (САД) и 66,2±12,7 мм рт. ст. (ДАД), т.е. на 25,9±10,3% и 28,5±12,1% соответственно.
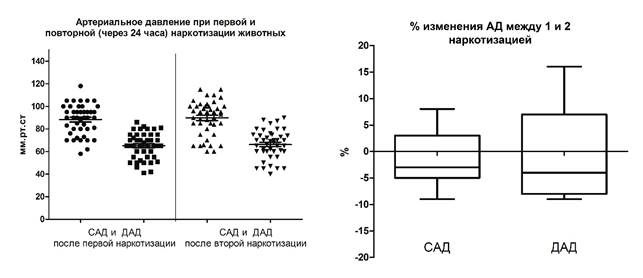
Рис. 1. Артериальное давление у животных после первой и второй наркотизации хлоралгидратом (400 мг/кг, в/б)
Примечание: САД – систолическое артериальное давление, ДАД – диастолическое артериальное давление.
Частота сердечных сокращений животных до наркотизации и после также отличалась и составила 306,7±70,8 и 247,6±55,3 уд/мин (снижение на 17±20,4%).
Температура тела животных (измеренная в конце операции) после наркотизации снижалась в среднем на 3±1,2 ºС.
При измерении уровня глюкозы в крови до и после наркотизации было обнаружено, что у всех экспериментальных животных изначальная концентрация глюкозы была сопоставима и не превышала физиологической нормы (4,5±0,8 ммоль/л), а введение хлоралгидрата его повышало до (6,4±0,5 ммоль/л). Проведение ПТТГ показало, что скорость её утилизации снижается у наркотизированных хлоралгидратом животных по сравнению с бодрствующими животными, т.к. площадь под кривой «концентрация глюкозы-время» (AUC0-120) при проведении ПТТГ составила соответственно 640±70 и 510±40 ммоль/л*мин. Снижение температуры тела и изменение в углеводном обмене очевидно можно объяснить снижением метаболизма наркотизированного животного.
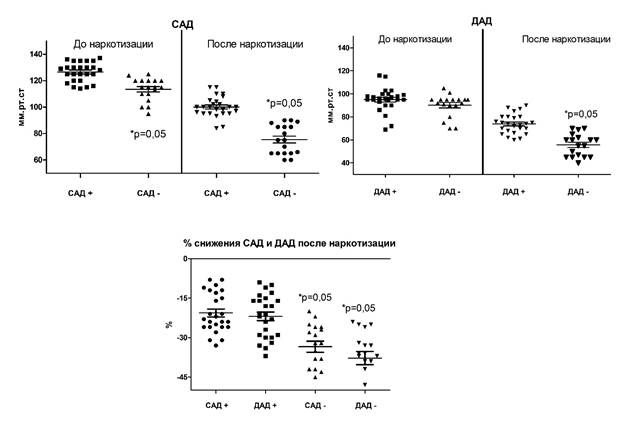
Рис. 2. Артериальное давление у погибших и выживших после перевязки ОСА животных до и после наркотизации хлоралгидратом (400 мг/кг, в/б) в день операции
Примечание: «+» – выжившие, «-» – погибшие животные после перевязки общих сонных артерий (ОСА); САД – систолическое артериальное давление; ДАД – диастолическое артериальное давление.
Перевязка общих сонных артерий привела к гибели 41% (18 из 43 животных, общая летальность через 72 часа наблюдений) животных. При этом было обнаружено, что у погибших животных артериальное давление (как САД, так и ДАД), измеренное до перевязки, было ниже, чем у выживших (113,4±8,6/90,1±9,9 и 126,5±7,3/95±10,3 мм рт. ст. соотв., т.е. на 11,5/5,4%) (рис. 1). Помимо меньшего начального давления, было обнаружено, что у погибших животных хлоралгидрат вызывал более выраженное его снижение (до 75,4±11,1/55,7±9,7 мм рт. ст. против 100,1 ±7,7/73,8 ±8,4 мм рт. ст. (т.е. на 32,7/32,5% соотв.)).
Частота сердечных сокращений (измеренная до перевязки ОСА) погибших (285,9±73,1 уд/мин) и выживших животных (321,8±66,5 уд/мин) также не была одинаковой (отличалась на 12,5%).
Необходимо отметить, что изменения в параметрах АД и ЧСС при первой и последующей за ней через 24 часа наркотизацией тех же животных носили однонаправленный и сопоставимый характер. Эти данные можно использовать для предварительного типирования экспериментальных животных по уровню влияния хлоралгидрата на параметры их АД и ЧСС.
Неодинаковое воздействие наркотизации хлоралгидратом на параметры АД и ЧСС у разных животных в условиях проведения экспериментальных исследований может существенно влиять на результаты и их трактовку. Несмотря на то что изначально, до первой наркотизации, животные были сопоставимы между собой по уровню АД, ЧСС, весу, полу, возрасту, уровню глюкозы в крови, после перевязки ОСА отличия в уровне их АД стали более значимыми. Так, животные с повышенным АД в большей степени выживали после перевязки ОСА, что может быть обусловлено более высоким перфузионным давлением, а у животных с низким АД перевязка ОСА вызывала более глубокую ишемию, приближающуюся к глобальной. Эти данные указывают на необходимость мониторинга АД в момент создания острой ишемии или при предварительной наркотизации животных (животные с САД <75 мм рт. ст. должны исключаться из эксперимента).
Очевидно необходим осознанный выбор средств для наркоза, не вызывающих нарушений гомеостатических механизмов регуляции жизненно важных функций: САД, ЧСС, дыхание, утилизацию глюкозы и др. Данное обстоятельство может не только привести к получению неверных данных, но и являться одной из причин невысокой воспроизводимости результатов экспериментальных исследований в разных лабораториях. В частности, упоминание об уровне АД, на фоне которого моделируется нарушение мозгового кровообращения, встречается только в единичных статьях.
Температура окружающей среды является также важным параметром, который необходимо учитывать при моделировании ишемии головного мозга или при описании условий, в которых проводился эксперимент и осуществлялся послеоперационный уход за животными. В нашем исследовании перенесение прооперированных (перевязка ОСА) животных на подогревающий столик с температурой 33-35 ºС привело к гибели 100% (10 из 15 животных погибло в первые сутки, остальные 5 погибли к 72 часам наблюдения, уровень АД в момент операции у них был 95±10,2/71,6±3,1 мм рт. ст. (животные с аналогичным уровнем АД, у которых операция проводилась без изменения температуры, выживали). Таким образом, уровень температуры во внешней среде может оказать значительное влияние на тяжесть течения ишемии ГМ и должен фиксироваться и упоминаться при публикациях результатов исследования.
Увеличение уровня глюкозы и снижение скорости её утилизации на фоне введения хлоралгидрата было сопоставимо у выживших и погибших животных, что говорит о незначительном влиянии данного показателя на течение и исход ишемии головного мозга. Несмотря на это, мы считаем, что воздействие хлоралгидрата на этот параметр может влиять на фармакологическое действие исследуемых веществ (при тестировании соединений с гипогликемической или церебропротекторной активностью при моделировании ишемии головного мозга на фоне экспериментального сахарного диабета).
При проведении экспериментальных исследований, требующих наркотизации и в последующем длительного наблюдения за животными, мы обнаружили, что у некоторых животных в отдалённый период (2-3 недели) после наркотизации хлоралгидратом развивалась кишечная непроходимость, проявлениями которой являлись: нитевидный стул, вздутие живота, истощение животного. При вскрытии у животных обнаруживался обширный спаечный процесс в брюшной полости, петли кишечника были оплетены спайками и не расправлялись.
При исследовании отдаленных последствий наркотизации хлоралгидратом через 4 недели после инъекции мы обнаружили, что у 3 из 10 животных развивалась кишечная непроходимость. Отмеченные последствия подтверждаются данными литературы о негативном влиянии хлоралгидрата на перистальтику кишечника и нежелательности его использования в экспериментах с длительным послеоперационным наблюдением [7].
В настоящее время в силу определенных причин (материальные, правовые) хлоралгидрат является одним из самых распространённых веществ для обезболивания и наркотизации лабораторных животных. Как и любому средству для системной анестезии и наркотизации, ему свойственны понижающее действие на АД и ЧСС. Проведенное исследование показало, что хлоралгидрат вызывает значительные изменения системных параметров животного, которые могут критическим образом изменить условия моделируемой патологии (усугубить создаваемую патологию) и исказить/нивелировать фармакологическое действие изучаемых лекарственных средств. Проблема применения средств для наркоза кроется не в том, что они изменяют некоторые системные параметры экспериментальных животных, а в неравномерности этого влияния у отдельных животных. Следовательно, моделируемая патология (и действие фармакологически активных веществ) будет неодинакова и не может быть корректно сопоставлена между собой без учета ряда системных параметров, в частности уровня АД у экспериментальных животных.
Вывод
Детальное описание условий проведения эксперимента и ряда физиологических параметров животных (АД и ЧСС) и условий эксперимента (температура окружающей среды) при моделировании экспериментальной ишемии головного мозга позволит значительно повысить качество и воспроизводимость экспериментальных исследований.
Библиографическая ссылка
Куркин Д.В., Волотова Е.В., Бакулин Д.А., Ханина Ю.А., Верхоляк Д.В., Тюренков И.Н. ВЛИЯНИЕ НАРКОТИЗАЦИИ ХЛОРАЛГИДРАТОМ НА ВЫЖИВАЕМОСТЬ ЖИВОТНЫХ ПРИ ПЕРЕВЯЗКЕ ОБЩИХ СОННЫХ АРТЕРИЙ // Современные проблемы науки и образования. 2017. № 1. ;URL: https://science-education.ru/ru/article/view?id=26056 (дата обращения: 06.02.2026).



