Проблема профилактики осложнений со стороны послеоперационной раны, особенно гнойной природы, является одним из приоритетных направлений в современной хирургии [3, 13]. Острота вопроса определяется высокой частотой инфекционных осложнений в области оперативных вмешательств как в экстренной, так и в плановой хирургии, продолжительностью временной нетрудоспособности, а также большими экономическими потерями [1, 4, 10]. В целом частота гнойных осложнений со стороны операционной раны достаточно высокая, в частности у больных острым аппендицитом она достигает десятка процентов [6, 9]. Поэтому профилактике такого рода осложнений в наши дни придают особенно важное значение [5, 11, 12]. Остается нерешенной и проблема гнойных внутрибрюшных осложнений, в частности при несостоятельности швов кишечного анастомоза. В последние десятилетия благодаря новым лечебным схемам получены существенные успехи в решении этого сложного аспекта [7, 14]. Безусловно, решение вопроса улучшения качества репарации тканей возможно при полноценных знаниях о патогенетических механизмах срыва процесса их заживления [2, 8, 15].
Цель работы – установление сопряженности репаративного процесса и трофики тканей регенерирующих структур.
Материалы и методы исследования. В основу работы положены эксперименты на 19 взрослых беспородных половозрелых собаках обоего пола массой от 7,3 до 14,2 кг. Изучали заживление и морфофункциональное состояние тканей брюшной стенки и двухрядного инвертированного тонкокишечного анастомоза в неосложненных условиях.
Контрольные сроки наблюдения – 1, 3, 5 и 7-е сутки.
Под тиопентал-натриевым наркозом (0,04 г/кг массы) животным выполняли срединный разрез вентральной стенки брюшной полости, резекцию тонкой кишки, наложение анастомоза по типу «конец в конец» по Ламберу-Альберту. Брюшная стенка ушивалась наглухо. В контрольные сроки собакам проводили релапаротомию, биопсию тканей области лапаротомной раны и зоны анастомоза. Проводили инфузионную терапию (внутривенные введения 5 % раствора глюкозы и 0,89 % раствора хлорида натрия из расчета 50 мл/кг массы).
В процессе работы нами применялись следующие методы: экстракция липидов из тканей брюшной стенки и зоны анастомоза, изучение активности фосфолипазы А2 потенциометрическим методом, содержание малонового диальдегида (МДА) оценивали в реакции с 2-тиобарбитуровой кислотой, активность каталазы исследовали спектрофотометрическим методом. Микроскопические исследования проводили при окраске препаратов гематоксилин-эозином. Определяли кровенаполнение тканей шовного валика кишечного соустья. Физическую герметичность швов соустья определяли пневмопрессией. Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия t Стьюдента.
Результаты исследования и их обсуждение
Интраоперационно после формирования межкишечного анастомоза в тканях, захваченных шовным материалом, производили редокс-метрию. Платиновый электрод помещали в ткани области соустья в пяти точках. Таким образом, регистрировали окислительно-восстановительный потенциал тканей соустья тотчас после его формирования (рис. 1).
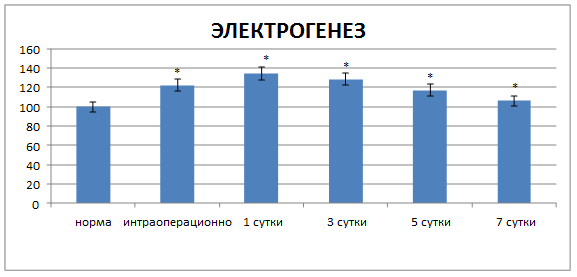
Рис. 1. Динамика редокс-потенциала в области соустья. * – достоверность изменений относительно нормы при р<0,05
Нами установлено, что редокс-потенциал в области соустья был ниже нормы на 22,2 %. Объем крови в области соустья составил 462,87![]() 14,65 мкл/г (р<0,001), а на основании – 699,99
14,65 мкл/г (р<0,001), а на основании – 699,99![]() 8,1 мкл/г (р<0,001). Содержание ТБК-реагирующего продукта в тканях по линии анастомоза – 3,39
8,1 мкл/г (р<0,001). Содержание ТБК-реагирующего продукта в тканях по линии анастомоза – 3,39![]() 0,11 мкмоль/г (р<0,001). Активность фосфолипазы А2 – 1,20
0,11 мкмоль/г (р<0,001). Активность фосфолипазы А2 – 1,20![]() 0,06 мкмоль/c/г белка (р<0,01). Активность каталазы составила 0,036
0,06 мкмоль/c/г белка (р<0,01). Активность каталазы составила 0,036![]() 0,001 мкмоль/г (р<0,01). При пневмопрессии область анастомоза выдерживала давление 10,56
0,001 мкмоль/г (р<0,01). При пневмопрессии область анастомоза выдерживала давление 10,56![]() 0,42 кПа (р<0,001), до наложения кишечных швов стенка кишки выдерживала давление 30,25
0,42 кПа (р<0,001), до наложения кишечных швов стенка кишки выдерживала давление 30,25![]() 0,56 кПа (р<0,001) (табл.).
0,56 кПа (р<0,001) (табл.).
Через сутки после операции при релапаротомии редокс-потенциал соустья составил – 48,26![]() 1,06 мВ (р<0,01), что свидетельствовало о прогрессировании нарушений обменных процессов, связанных с энергообеспечением. Объем крови в тканях соустья составил 652,34
1,06 мВ (р<0,01), что свидетельствовало о прогрессировании нарушений обменных процессов, связанных с энергообеспечением. Объем крови в тканях соустья составил 652,34![]() 4,79 мкл/г (р<0,01), что свидетельствовало о возрастании воспалительного процесса. Содержание МДА в тканях по линии анастомоза возрастало до 6,30
4,79 мкл/г (р<0,01), что свидетельствовало о возрастании воспалительного процесса. Содержание МДА в тканях по линии анастомоза возрастало до 6,30![]() 0,16 мкмоль/г (р<0,01). Активность фосфолипазы А2 была на цифрах 1,74
0,16 мкмоль/г (р<0,01). Активность фосфолипазы А2 была на цифрах 1,74![]() 0,07 мкмоль/г (р<0,01) и 1,59
0,07 мкмоль/г (р<0,01) и 1,59![]() 0,05 мкмоль/г (р<0,01). Активность каталазы составила 0,0578
0,05 мкмоль/г (р<0,01). Активность каталазы составила 0,0578![]() 0,0012 мкмоль/г (р<0,001) в области соустья, и 0,0518
0,0012 мкмоль/г (р<0,001) в области соустья, и 0,0518![]() 0,0013 мкмоль/г (р<0,001) на кишке. При пневмопрессии область анастомоза выдерживала давление 12,56
0,0013 мкмоль/г (р<0,001) на кишке. При пневмопрессии область анастомоза выдерживала давление 12,56![]() 0,42 кПа (р<0,001).
0,42 кПа (р<0,001).
Динамика некоторых биохимических и биофизических показателей состояния регенерирующих тканевых структур кишечного анастомоза
|
После формирования (интраопера-ционно) |
Ранний послеоперационный период (сутки) |
||||
|
1 |
3 |
5 |
7 |
||
|
ЭЛЕКТРО-ГЕНЕЗ ТКАНЕЙ, мВ (норма -35,98 |
-43,98 |
-48,26 |
-46,28 |
-42,22
|
-38,26
|
|
КРОВЕНА-ПОЛНЕНИЕ ТКАНЕЙ, мкл/г (норма 448,1 |
462,87 |
652,34 |
541,21 |
501,23
|
468,19
|
|
МДА, мкмоль/г (норма 3,35 |
3,39 |
6,30
|
5,15
|
4,6
|
3,71
|
|
ФОСФОЛИ-ПАЗА А2, мкмоль/c/г белка (норма 0,91 |
1,20 |
1,74 |
1,70 |
1,58
|
1,23
|
|
КАТАЛАЗА, мгН2О2/мин/г белка (норма 0,032 |
0,036 |
0,0578 |
0,0465
|
0,0398
|
0,0331
|
|
ПНЕВМО-ПРЕССИЯ, кПа |
12,56 |
16,74
|
21,05
|
28,82
|
|
Примечание: * – достоверность отличия по отношению к норме при p<0,05.
Через 3 суток после оперативного вмешательства явления воспаления в области анастомоза сохранялись (рис. 2).
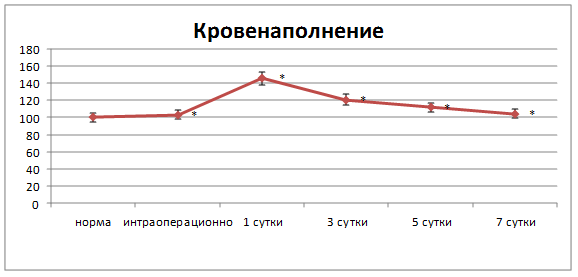
Рис. 2. Динамика кровенаполнения в области соустья. * – достоверность изменений относительно нормы при р<0,05
Окислительно-восстановительный потенциал тканей соустья был ниже нормы на 28,6 % (р<0,01), что свидетельствовало о продолжающихся нарушениях метаболических процессов, связанных с энергообеспечением. Кровенаполнение в области соустья было выше нормы только на 20,7 % (р<0,01), что могло свидетельствовать о начинающемся регрессе воспаления. Содержание МДА по линии анастомоза сохранялось повышенным и было выше нормы на 53,7 % (р<0,01). Активность фосфолипазы А2 составила 1,70![]() 0,12 мкмоль/г (р<0,01) и 1,50
0,12 мкмоль/г (р<0,01) и 1,50![]() 0,09 мкмоль/г (р<0,01). Активность каталазы была на цифрах 0,0578
0,09 мкмоль/г (р<0,01). Активность каталазы была на цифрах 0,0578![]() 0,0012 мкмоль/г (р<0,01) в области соустья, и 0,0470
0,0012 мкмоль/г (р<0,01) в области соустья, и 0,0470![]() 0,0019 мкмоль/г (р<0,001) на кишке. При пневмопрессии область анастомоза выдерживала давление 16,74
0,0019 мкмоль/г (р<0,001) на кишке. При пневмопрессии область анастомоза выдерживала давление 16,74![]() 0,46 кПа (р<0,001).
0,46 кПа (р<0,001).
В этот срок при морфологической оценке тканей области соустья явления воспаления сохранялись. На вершине шовного валика в большинстве наблюдений по линии анастомоза определялись участки язвенного дефекта с фибринозно-гнойными наложениями. Имелись дисциркуляторные явления в виде отека, венозного полнокровия, кровоизлияний, инфильтрации полиморфно-ядерными лейкоцитами. Определялись участки с формированными тканями грануляций с молодыми новообразованными капиллярами и макрофагами.
Через 5 суток после операции редокс-потенциал в области соустья приближался к норме и составил –42,22![]() 1,63 мВ (р<0,05). Объем крови в области соустья был выше нормы только на 28,6 % (р<0,01), что подтверждало тенденцию к уменьшению воспалительного процесса. Содержание МДА в тканях по линии анастомоза составило 4,60
1,63 мВ (р<0,05). Объем крови в области соустья был выше нормы только на 28,6 % (р<0,01), что подтверждало тенденцию к уменьшению воспалительного процесса. Содержание МДА в тканях по линии анастомоза составило 4,60![]() 0,15 мкмоль/г (р<0,01), что было выше нормы на 11,9 % (p<0,01). Активность фосфолипазы А2 сохранялась повышенной по отношению к норме на 73,6 % (р<0,01). Активность каталазы приближалась к норме. При пневмопрессии нарушение герметичности анастомоза происходило при давлении 21,05
0,15 мкмоль/г (р<0,01), что было выше нормы на 11,9 % (p<0,01). Активность фосфолипазы А2 сохранялась повышенной по отношению к норме на 73,6 % (р<0,01). Активность каталазы приближалась к норме. При пневмопрессии нарушение герметичности анастомоза происходило при давлении 21,05![]() 0,56 кПа (р<0,01) (рис. 3).
0,56 кПа (р<0,01) (рис. 3).
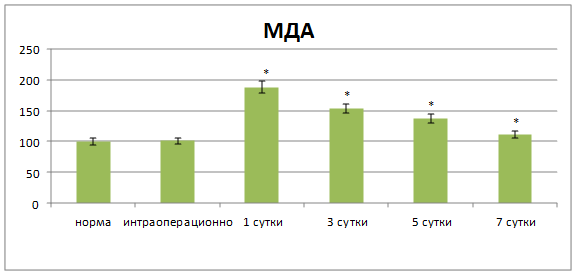
Рис. 3. Динамика содержания малонового диальдегида в области соустья.
* – достоверность изменений относительно нормы при р<0,05
В этот контрольный этап периода наблюдения явления воспаления в тканях анастомоза уменьшались, а репаративные процессы активизировались. В области соустья регистрировалось уменьшение язвенных дефектов по линии внутреннего ряда швов, очищение их от фибрина. В регенерирующих структурах увеличивалось количество фибробластов, фиброцитов, волокон коллагеновых структур. В области язвенных дефектов еще определялись очаги лейкоцитарной инфильтрации, грануляционная ткань была с пролиферацией клеточных элементов макрофагального и фибропластического ряда.
К концу периода наблюдения (7 суток) кровенаполнение тканей кишечного анастомоза приближалось к исходному состоянию (норме). Окислительно-восстановительный потенциал тканей соустья составил – 38,26 ![]() 1,16 мВ (р>0,05), что свидетельствовало о нормализации биоэнергетических процессов. Содержание МДА в тканях по линии анастомоза было выше нормы только на 10,9 % (р<0,05), а активность фосфолипазы А2 – на 35,1 % (р<0,01). Швы анастомоза выдерживали давление 28,82
1,16 мВ (р>0,05), что свидетельствовало о нормализации биоэнергетических процессов. Содержание МДА в тканях по линии анастомоза было выше нормы только на 10,9 % (р<0,05), а активность фосфолипазы А2 – на 35,1 % (р<0,01). Швы анастомоза выдерживали давление 28,82 ![]() 0,75 кПа (р<0,05) (рис. 4).
0,75 кПа (р<0,05) (рис. 4).
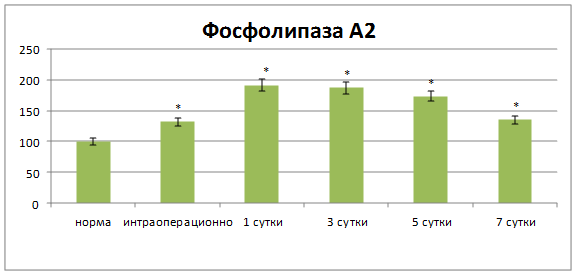
Рис. 4. Динамика активности фосфолипазы А2 в области соустья. * – достоверность изменений относительно нормы при р<0,05
Морфологически по линии швов наблюдались единичные участки дефекта слизистой оболочки, заполненные зрелой грануляционной тканью. При микроскопии имелись участки с неполной эпителизацией в области соустья, хотя процессы пролиферации клеток были достаточно активными.
Заключение. Анализируя полученные данные, приходим к выводу, что в основе длительного заживления двухрядного инвертированного анастомоза лежат: обширная операционная травма, сдавление тканей двухрядным швом, нарушающим трофику тканей и вызывающим состояние ишемии. В результате возникает некроз тканей по линии внутреннего ряда швов, переходящий во флегмонозно-язвенную форму воспаления. Это обусловливает позднее созревание грануляционной ткани, без которой не может завершиться эпителизация. В целом заживление протекало по типу вторичного натяжения, хотя было зарегистрировано 5 случаев с заживлением по типу первичного.
В основе патогенеза такого рода заживления, как было указано выше, лежат расстройства трофики тканей. Обширная травма и ишемия тканей создает идеальные условия для запуска механизма свободнорадикального перекисного окисления липидов, повышения уровня активности фосфолипазы А2, конечные продукты которых, в первую очередь – малоновый диальдегид, обладают мембранодеструктивным действием.
Биохимическая и биофизическая оценка регенерирующих структур лапаротомной раны показала во многом аналогичные результаты. Многочисленными исследованиями доказано, что течение неполной репаративной регенерации тканей брюшной стенки сопряжено с их функционально-метаболическим состоянием. В наблюдениях, в которых отмечен срыв процесса заживления с нагноением раны, регистрировались существенно большие нарушения трофики тканей.
Таким образом, экспериментальные лабораторно-инструментальные исследования показали, что медленное течение репаративного процесса тканей по линии швов двухрядного инвертированного анастомоза во многом обусловлено нарушением трофики тканей, о чем свидетельствовало существенное уменьшение их биоэнергетики. Указанные патологические явления и лежали в основе активизации процессов перекисного окисления липидов и фосфолипазных систем – основных мембранодестабилизирующих факторов, из-за чего процесс репаративной регенерации замедлялся. Отметим и тот факт, что в результате указанных патологических явлений зачастую возникает некроз тканей по линии швов, переходящий во флегмонозно-язвенную форму воспаления. Местная реакция на воспалительный очаг сопровождается высокой инфильтрацией тканей лейкоцитами (основной источник переноса активных форм кислорода – индуктора липопероксидации), что поддерживает высокий уровень интенсивности перекисного окисления липидов. Во многом аналогичные процессы происходили и в тканях лапаротомной раны. В наблюдениях с гнойными раневыми осложнениями активность перекисного окисления липидов в тканях раны была выше, что, безусловно, влияло не течение репаративного процесса.
Библиографическая ссылка
Власов А.П., Зайцев П.П., Власов П.А., Болотских В.А., Кононенко С.В., Кренделев И.А., Аль-Совайди А.М. СОПРЯЖЕННОСТЬ РЕПАРАТИВНОГО ПРОЦЕССА И ТРОФИКИ ТКАНЕЙ РЕГЕНЕРИРУЮЩИХ СТРУКТУР // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=26035 (дата обращения: 24.12.2025).



