Актуальность. Концепции на основе правильных представлений об источниках и механизмах развития глаза являются главной теоретической базой для получения из плюрипотентных стволовых индуцированных клеток с заданной программой развития для создания и обеспечения неограниченного источника в клеточной заместительной терапии в офтальмологии [20]. Отсутствие четкого понимания механизмов морфогенеза структур глаза человека, дискуссии по поводу источников развития и окончательной структуры прозрачных сред, патогенетически необоснованное лечение при снижении прозрачности сред глаза и, как следствие, утрата зрительных функций являются ярким отражением актуальности исследований в этом направлении. На современном этапе предметом острых дискуссий остаются вопросы, как различные типы клеток, формирующие структуры глаза, отличаются от их предшественников и какие факторы координируют комплексное развитие глаз человека [5, 13]. Правильная дифференциация фоторецепторов представляет особый интерес из-за их участия в возникновении дегенеративных заболеваний сетчатки глаза [1]. Портером с соавторами (Porter L.F. et al., 2015) установлено сочетанное повреждение мембраны Бруха, имеющее генерализованный характер, с нарушениями в строме и эпителии роговицы [14]. Установлены гены, ответственные за эту патологию. Но остались неизвестными факторы, влияющие на экспрессию генов, что свидетельствует о недостаточности молекулярно-генетических данных, полученных в экспериментах на насекомых и низших позвоночных [8]. Отсутствие полных представлений по морфогенезу глаза человека на фоне многочисленных молекулярно-генетических исследований на моделях беспозвоночных и низших позвоночных диктует получение более глубоких представлений о физиологической регенерации структур глаза человека для правильной интерпретации и индукции репаративных регенераторных процессов с помощью лечебных мероприятий. М.В. Тихонович и др. (Tikhonovich M.V. et al., 2015) считают фактором риска в развитии патологии глаза вовлечение пигментных эпителиальных клеток, макрофагов, гиалоцитов, глиоцитов, клеток Мюллера, медиаторов воспаления, таких как цитокины, хемокины и факторы роста, учитывая их взаимодействие в процессах пролиферации и развитии мембран сетчатки глаза [19]. Современные методы лечения катаракты, неоваскуляризации прозрачных сред глаза, возрастной макулодистрофии и глаукомы получат фундаментальную платформу на основе новых данных по развитию глаза человека. По данным А. Маттеуци c cоавторами (Matteucci A. et al., 2013), обнаружившими в клетках Мюллера дисбиндин, продукт гена DTNBP1, подтверждается возможное функциональное участие этого белка в визуальных изменениях, связанных с нервно-психическими расстройствами [12]. Известно, что в сетчатке нейроны и глия генерируются в консервативном порядке из пула мультипотентных клеток-предшественников. По мнению Х. Йип (Yip H.K., 2014), в ходе развития стволовые прогениторные ретинальные клетки (RPC) меняют экспрессию генома с течением времени под воздействием внутренних транскрипционных и внешних факторов, таких как факторы роста, тем не менее сохраняя потенции стволовых в Мюллеровых клетках [22]. Несмотря на подтвержденные факты значимой роли β-катенинзависимого сигнального пути Wnt, контролирующего программы генной экспрессии и связанного с направлением морфогенеза, Т. Ямагами и др. (Yamagami T. et al., 2014) показано, что, хотя сигнализация ß-катенин/Pax6 играет решающую роль в самообновлении и нейрогенезе радиальных глиальных клеток, индукция Wnt сигнализации в радиальной глии, обеспечивающаяся межклеточными взаимодействиями, остается тем не менее практически не изученной [21]. По мнению Х. Джером с соавторами (Jayaram H. et al., 2014), Мюллерова глия с характеристиками стволовых клеток (hMSCs) может приобрести фенотипические и генотипические признаки стержневых фоторецепторов пока только в пробирке [9], а для того, чтобы эти данные интерпретировать на организм человека, необходимо иметь очень четкое представление о развитии глаза человека, дифференцированно используя молекулярно-генетические данные, полученные на мушке-дрозофиле.
Догма о единственном источнике развития хрусталика должна быть опровергнута для правильного применения новых данных в клеточных технологиях. Новая эра лечения глазной патологии связана с выходом из тупиковых представлений об источниках развития глаза, установлением природы клеток, формирующих прозрачные среды глаза, а также выявлением их в структуре органа зрения с созданием новых патогенетически обоснованных методов лечения, что и определило направление наших исследований.
Целью нашего исследования является изучение общих закономерностей развития глаза человека.
Задачи исследования
1. Установить особенности развития глаза человека в раннем эмбриональном периоде.
2. Изучить локализацию и время идентификации клеток, несущих рецепторы на маркеры S100В в прозрачных средах глаза человека.
3. Дать характеристику особенностей активности гена белка S100В в ткани формирующихся прозрачных сред глаза человека.
Материал и методы. С разрешения Этического комитета ДВФУ, в соответствии с Хельсинской декларацией, по клиническим показаниям и с информированного согласия пациентов произведен забор материала при искусственных прерываниях беременности по социальным показаниям (табл. 1).
Таблица 1
Распределение материала глаза эмбрионов и плодов человека
|
Периоды развития |
Эмбрионы |
Плоды |
||
|
Срок развития |
до 6 недель |
до 12 недель |
до 30 недель |
до 40 недель |
|
количество |
16 |
7 |
8 |
12 |
Иммуногистохимическими методами для унификации оценки процессов морфогенеза выявляли S100В-позитивные клетки, проанализировали их количественные соотношения, а также выявили особенности их распределения в структурах развивающегося глаза человека. Анализ результатов проведен с помощью микроскопа Olympus BX51, иллюстрации получены с помощью цифровой камеры DP 25, статистическая обработка исследуемого материала произведена с помощью фирменных компьютерных программ фирмы Olympus.
Результаты. Установлено, что в раннем эмбриогенезе человека до 6 недель формируется глазная чаша, первичный глазной пузырек уменьшается, задняя стенка чаши представлена пигментным эпителием, в котором идентифицируются ярко-базофильные ядра, расположенные в базальной части клеток. Гранулы пигмента сосредоточены в апикальной части цитоплазмы. Внутренняя стенка глазной чаши (или бокала) представлена формирующейся сетчаткой, имеющей неодинаковое строение на задней поверхности глазного бокала и в месте перехода в пигментный эпителий (рис. 1). Наименьшая толщина формирующейся сетчатки соответствует краям глазного бокала, месту перехода сетчатки в пигментный эпителий. Внутренняя задняя стенка глазной чаши имеет латеральные сужения, при этом в месте перехода в боковые стенки вновь расширяется, образуя густую массу ядер. Сетчатка в месте перехода в пигментный листок представлена 2–3 слоями клеток, образуя утолщение в области многочисленных выпячиваний пигментного листка, соответствующего месту формирования отростков цилиарного тела. Задняя нейральная стенка глазного бокала имеет сложное строение и представлена многочисленными густыми слоями клеток с ярко-базофильными ядрами, располагающимися дистально, а проксимально располагается слой с редко расположенными клетками с хромофобной цитоплазмой, что свидетельствует об их прогениторной функции и принадлежности к спонгиобластам. Сетчатка с двух сторон окружена гомогенными мембранами, образованными астроглией, которая, как и весь внутренний слой, характеризуется слабой экспрессией на белок S100. В этот период, на этапе формирования хрусталиковой плакоды, в ней не идентифицируются клетки, содержащие в цитоплазме белок S100. Фиброзная оболочка имеет неоднородное строение в области перехода зачатка роговицы в склеру, которая, хотя и представляет общий зачаток с сосудистой оболочкой, но имеет менее плотную структуру.
К концу 6-й недели наблюдается полное закрытие первичной глазной щели, исключая пространство вокруг зрительного нерва. Хрусталик приобретает сложное строение, хрусталиковый пузырек инвагинирует на задней поверхности, постепенно формируя хрусталиковый серп.
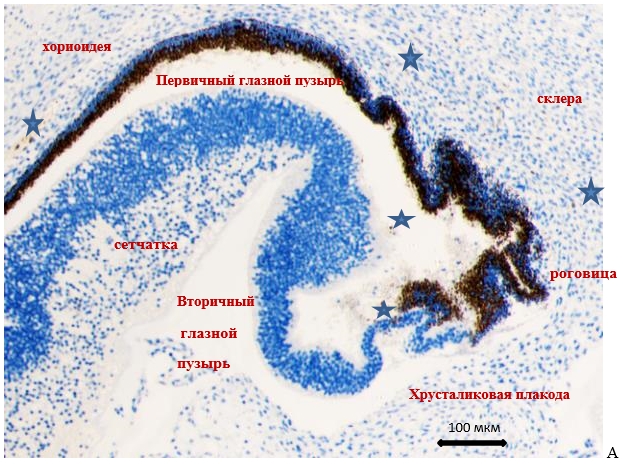
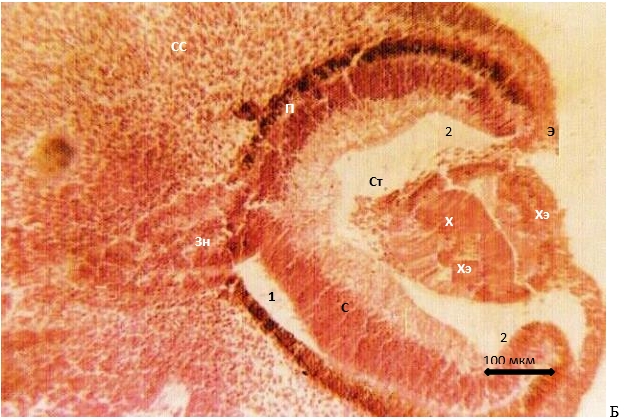
Рис. 1. Глаз эмбриона человека 6 недель (вес 25 г)
Идентифицируются глазной бокал с остатками первичной глазной щели, хрусталиковая плакода, соединенная с эктомезенхимой зачатка наружной оболочки. Фиброзная оболочка имеет одинаковое строение в области зачатка роговицы без перехода в склеру, которая представляет общий зачаток с сосудистой оболочкой. Внутри остатков первичного глазного пузыря, в зоне формирующейся роговицы и мембраны Бруха идентифицируются нейроглиальные клетки S100 (указаны звездочками). Иммунная гистохимия. Локализация S100. Ув.х100. 1) остатки первичного глазного пузырька; 2) вторичный глазной пузырь; х — хрусталик; Ст) стекловидное тело; СС) общий зачаток фиброзной и сосудистой оболочки; С) нейральная сетчатка; П) пигментный эпителий; Э) эктодерма; Зн) зрительный стебелек.
Внутрь вторичного глазного пузыря врастает эктодермальная плакода, окруженная слоем плоских клеток на периферии. Сосудистая и фиброзная оболочка на этом этапе представляет собой общий зачаток, без идентификации места перехода склеры в роговицу.
Наибольшие скопления нейроглии, содержащей S100, наблюдаются внутри остатков первичного глазного пузыря, а также в зоне перехода сетчатки в пигментный листок (рис. 2).
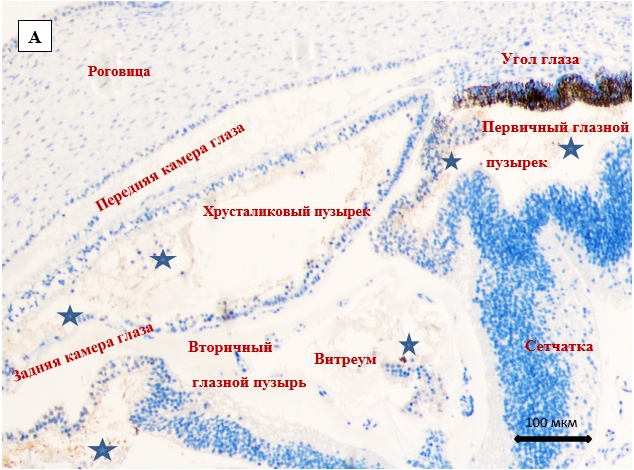
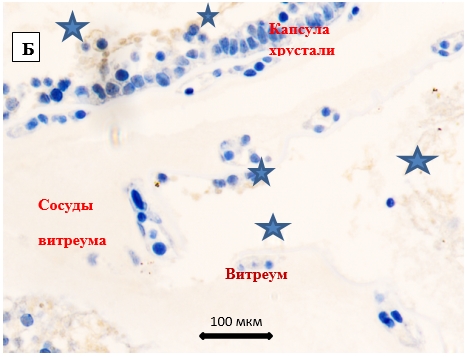
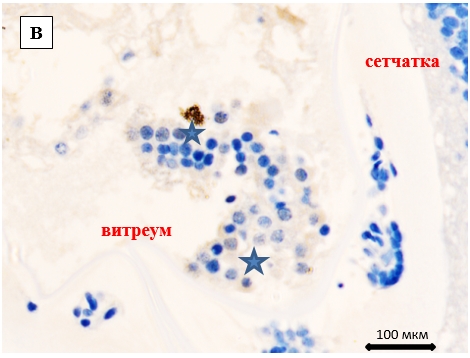
Рис. 2. Глаз эмбриона человека 12 недель (вес 75 г)
А) общий план строения глаза; б, в) увеличенные фрагменты капсулы хрусталика и стекловидного тела. Идентифицируются хрусталиковый пузырек, остатки первичного глазного пузыря, расположенные латерально, стекловидное тело, заполненные астроглией со слабой экспрессией на белок S100 (указаны звездочками). Иммунная гистохимия. Локализация S100. А)Ув.Х100; Б, В) ув. Х400.
На поверхности хрусталикового эпителия идентифицируется слой клеток, который, как мы предполагаем, имеет нейроглиальную природу и который сохраняется в последующий период развития, связанный с волокнообразованием в хрусталике (рис. 3).
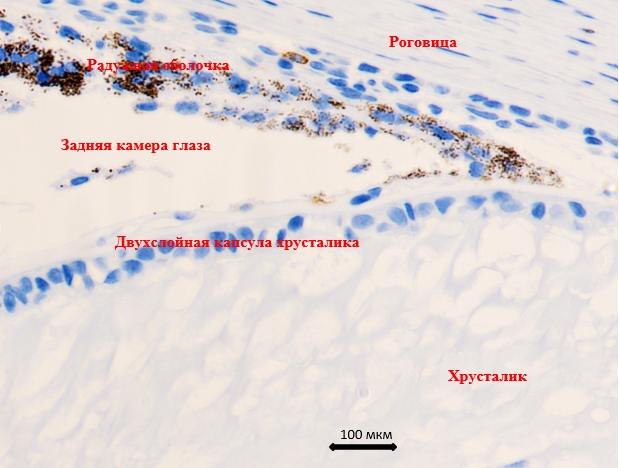
Рис. 3. Глаз плода человека 14 недель. Формирование передней камеры глаза. Иммунная гистохимия с докраской гематоксилином. Увеличение Х400
На передней поверхности капсулы хрусталика идентифицируется астроглиальная мембрана, которая сохраняется на задней поверхности хрусталика до конца плодного периода онтогенеза.
В этот период роговица состоит из наружного переднего 2-слойного эпителия, а также однослойного заднего эндотелия, которые проявляют слабую экспрессию на белок S100, что находится в соответствии с литературными данными о его значении в трофическом обеспечении развивающихся и пролиферирующих клеток [3]. В строме роговицы количество клеток, реагирующих на маркеры S100, уменьшается, как мы предполагаем, в связи с дифференцировкой и новой репрессией генов. Внутри хрусталикового пузырька выявляются клетки, имеющие веретеновидную форму и цитоплазматические рецепторы на белок S100.
В наших исследованиях выявление белка S100 в сетчатке обнаружено с 14-й недели эмбриогенеза, раньше, чем в работах других авторов, идентифицировавших ретинальную нейроглию S100 только с 30-й недели пренатального онтогенеза (рис. 4).
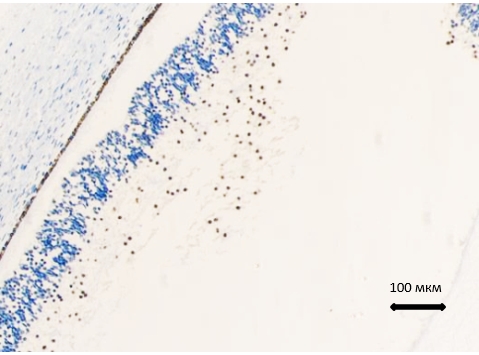
Рис. 4. Глаз человека 14 недель (вес 125 г). Локализация S100 в структурах глаза. Иммунная гистохимия. Ув. Х 100
Это может быть связано с тем, что функциональный запрос в прозрачных средах глаза наступает раньше в связи с их ролью в трофическом обеспечении сетчатки в условиях физиологической регенерации, а также сигнальных взаимодействий клеток в условиях формирования векторов направления роста кровеносных сосудов и их ингибирования в направлении прозрачных сред глаза.
Также это объясняет общую для нейроглии сетчатки и мозга, гиалоцитов стекловидного тела и клеток хрусталика способность секретировать кристаллины.
В последующий, более поздний период развития глаза, хрусталиковый пузырек заполняется волокнами, которые имеют происхождение нейроглиальное, а не эпителиальное, как предполагалось ранее.
Таким образом, выявленные нами в структурах развивающегося глаза нейроглиальные клетки, экспрессированные маркерами на белок S100, свидетельствуют об участии нейроглии в формировании прозрачных сред глаза человека.
Обсуждение. S100 белки составляют самую большую подгруппу так называемых EF-hand-кальцийсвязывающих белков (по структуре кальцийсвязывающего участка: спираль E – петля – спираль F), к которым, для примера, относятся также кальмодулин и тропонин С. S100 белки могут формировать как гомо-, так и гетеродимеры, помимо Ca2+, связывать также Zn2+ и Сu2+. Захват ионов меняет пространственную организацию S100 белка и обеспечивает возможность связи с различными белками-мишенями их биологического действия, при этом документировано более 90 потенциальных белков-мишеней).
Представители S100 белков демонстрируют выраженную тканевую и клеточную специфичную экспрессию. Они вовлечены в различные процессы – сокращение, подвижность, клеточный рост и дифференциацию, прогрессию клеточного цикла, транскрипцию, клеточную организацию мембран и динамику цитоскелета, защиту от оксидативного повреждения клетки, фосфорилирование, секрецию. Учитывая факт того, что S100 белки выполняют как внутриклеточные, так и внеклеточные функции, в случае секреции они действуют аналогично цитокинам. Изученный нами нейроглиальный S100В, который продуцируется преимущественно астроцитами нервной ткани, является маркером активации астроглии, опосредующим свои эффекты через взаимодействие с RAGE (receptor for advanced glycation end products — рецепторы конечных продуктов гликозилирования). На основе литературных данных можно считать, что S100 не только проявляет нейротрофическую активность, но и способствует миграции и специализации эффекторных клеточных дифферонов в прозрачных структурах глаза человека. S100-RAGE взаимодействие играет важную роль в морфогенезе прозрачных сред глаза человека.
По мнению С. Cакимото с соавторами (Sakimoto S. Et al., 2012), взаимодействие между астроцитами и эндотелиальными клетками (ЭКС) имеет решающее значение для формирования сосудов сетчатки [17]. Астроциты индуцируют миграцию и пролиферацию ЭКС с помощью секреции фактора роста эндотелия сосудов (VEGF), и наоборот, ЭКС индуцируют созревание астроцитов, которое индуцирует ангиогенез. Именно поэтому в сетчатке, в которой ангиогенез начинается с 14-й недели пренатального онтогенеза, не выявляются эффекторные нейроглиоциты S100. Наши оригинальные данные о новых функциях астроглиальных клеток Мюллера как оптических волокнах, которые регулируют и направляют световые импульсы через внутреннюю ткань сетчатки, увеличивая сигнал за счет минимизации внутриретинального рассеяния света, сохраняя пространственное распределение импульсов [16], нашли подтверждение в исследованиях А. Рейхенбаха с соавторами (Reichenbach A. et al., 2013) [15]. По нашим данным, Мюллеровская астроглия (Мк) в пренатальном онтогенезе служит не только в качестве мягкого субстрата, что необходимо для роста аксонов и нейрональной пластичности, но и выселяется в структуры прозрачных сред глаза для обеспечения в постнатальном онтогенезе зрительных функций, а также контроля и ограничения прорастания сосудов в рамках строгих векторов. Именно в связи с полифункциональностью нейроглии, по нашим данным и мнению Р.С. Чонг и К.Р. Мартина (Chong R.S., Martin K.R., 2015) [4], она играет важную роль в патогенезе глаукомы, проявляясь в генерализованном поражении сетчатки и прозрачных структур глаза.
Д. Голдман (Goldman D., 2014) показано, что у костистых рыб (данио (лат. Danio)) реакция астроглии на повреждение сетчатки сопровождается перепрограммированием в стволовые клетки и позволяет им производить пролиферирующую популяцию клеток-предшественников, которые могут регенерировать все основные типы клеток сетчатки глаза с восстановлением зрительной функции [7]. С. Ким с соавторами (Kim S.N. et al., 2014) отмечают, что мигрирующие глиальные клетки сохраняют митогенные и подвижные свойства при интенсивном взаимодействии с внеклеточной средой, миграция сопровождается экспрессией генов, отвечающих за специализацию клеток, но при этом дифференциация контролируется последовательной активацией рецептора фактора роста фибробластов (FGF) [11]. М. Кавалларо с соавторами (Cavallaro M., et al., 2009) установлено, что в сетчатке избыточная экспрессия Sox2 до стадии дифференцировки не только предотвращает дефект нейронного созревания, но и подавляет экспрессию генов дифференцировки в глиальных клетках [2].
Таким образом, развитие глаз представляет собой cложно регулируемый процесс, который состоит из нескольких перекрывающихся этапов: (I) закладка, затем обособление глаза от развивающегося переднего мозга; (II) дифференцировка и структурирование глазного пузырька с обособлением оболочек; (III) специализация структур глазного бокала в нейрональную сетчатку и пигментный эпителий, формирование прозрачных сред глаза; и (IV) специализация и васкуляризация всех структур глаза, которые развиваются из пула клеток-предшественников, производных эктодермы, экто- и нейромезенхимы. При этом приоритет в развитии структур глаза получают именно прозрачные среды глаза, в которых идут инволюция сосудов, ограничение роговицы и склеры, формирование мембраны Бруха для создания векторного роста сосудов. Генетическая регуляция этапов развития глаз включает в себя воздействия извне с помощью морфогенов, факторов роста, а также внутренних факторов, в первую очередь транскрипционных факторов, которые взаимодействуют с характерными участками ДНК, расположенными в регуляторных областях генов. Действуя в соответствии с генетической программой и/или в ответ на внешние воздействия, они инициируют или подавляют транскрипцию определенных генов, что влечет за собой изменения в клеточной морфологии, клеточную дифференциацию, реализуя морфо- и органогенез.
Исследования важных механизмов, лежащих в основе миграции и перепрограммирования Мюллеровской глии в физиологической регенерации структур глаза человека, могут привести к новым стратегиям для стимуляции регенерации сетчатки и других структур глаз при офтальмопатологии. C. Tao и Х. Занг (Tao C, Zhang X., 2014) отмечают, что наиболее фундаментальные вопросы уникальных типов глиальных клеток, астроцитов, остаются слабо изученными, хотя они представляют самую раннюю глиальную популяцию в эмбриогенезе зрительного нерва, способствуют ангиогенезу в нейральной сетчатке и формированию гематоофтальмического барьера [18]. По данным А. Хендриксона с соавторами (Hendrickson A. et al., 2007), весьма вероятно, что каждый белок играет определенную роль в каждом зрительном центре и что его экспрессия контролируется на данном этапе развития сетчатки несколькими внутренними и внешними факторами [6].
Обзор современных данных об источниках развития, пролиферации и дифференцировки астроцитов, их миграции и роли в физиологической и репаративной регенерации зрительной системы, экспрессии генов при перепрограммировании показал, что полностью отсутствуют сведения об их участии в развитии прозрачных сред глаза человека. Наши результаты дают возможность рассмотреть проблему катаракты и диабетической ретинопатии с новых позиций и с учетом других механизмов. Участие двух источников развития хрусталика объясняют невозможность получения линзы с помощью клеточных технологий, используя только эктодермальную хрусталиковую плакоду, которая без индукторных влияний астроглии сопровождается развитием катаракты. Данные Р. Джозефа с соавторами (Joseph R. et al., 2011) не противоречат нашим результатам, так как идентифицированные ими эпителиальные и стромальные белки роговицы имеют отношение к секреции специализированными клетками, а не относятся к белкам, секретируемым за счет временной экспрессии генов [10]. И. Чен с соавторами (Chen Y. еt al., 2012) обнаружили, что S100A (S100A4, S100A5 и S100A6) имеют высокую концентрацию в эндотелии роговицы у взрослых, но отсутствуют в эмбриональных роговицах [3]. А. Матас и соавторы (Matas A. et al., 2015) отмечают важность участия кальцийсвязывающего белка (S100), маркера пролиферации (Ki-67), маркера для ресничек (альфа-тубулина) и маркера клеток стволовых клеток октамер-связывающего фактора транскрипции 4 (Oct-4) в гистологических срезах 5–12-недельных человеческих глаз, в то время как у нас маркеры нейроглии впервые в эмбриональный период идентифицируются в прозрачных средах глаза. В сетчатке активность S100 отсутствует, так как в это время они находятся в репрессивном состоянии и не проявляют активности. А. Матас и соавторами (Matas A. et al., 2015) показана экспрессия S100 только в нейральных производных, зрительном нерве и внутреннем слое нейрональной сетчатки мышей и свиней, при этом при совместной локализации с нестином они идентифицируются в наиболее интенсивный период морфогенеза глаза и дифференциации его структур [13]. Первоначально высокая экспрессия S100 во всех частях развивающегося глаза постепенно прекращается, особенно в наружном нейральном слое. Пролиферирующие Ki-67 позитивные клетки совместно локализуются с нестином в сетчатке, хрусталике и хориоидее, при этом возможная ингибирующая экспрессию индуцибельных генов роль Oct-4 заключается в предотвращении преждевременной дифференцировки клеток. Совместная локализация Oct-4 и Ki-67 в нейробластах сетчатки глаза, вероятно, представлена в пуле нейрональных стволовых клеток, которые в связи с пролиферацией еще не готовы к терминальной дифференцировке.
И. Чен и соавторы (Chen Y. Et al., 2012) считают ответственным за прозрачность роговицы монослой эндотелиальных клеток (CECs), для которых Wnt и TGF-бета сигнальные пути являются важными в процессах дифференцировки и созревания. При отсутствии TGF-& beta у мышей наблюдается отсутствие эндотелия и слияние линзы с роговицей. Мы считаем, поскольку TGF-beta выделяют многие типы клеток, включая макрофаги, первичным является отсутствие иммуноцитов, а нарушение структуры вторично.
Выводы
1. Особенности развития глаза человека в раннем эмбриональном периоде заключаются в участии нейроглии в формировании структур прозрачных сред глаза. Выселение из нейральной сетчатки с образованием прозрачных сред глаза сопровождается дифференцировкой нейроглиоцитов раньше, чем в сетчатке.
2. Изучение локализации и времени идентификации клеток, несущих рецепторы на маркеры S100В в прозрачных средах глаза человека, показало, что дольше сохраняются свойства стволовых клеток у спонгиобластов сетчатки.
3. Особенности активности гена белка S100В в клетках тканей формирующихся прозрачных сред глаза человека связаны с дифференцировкой и перепрограммированием нейроглиоцитов через экспрессию генома в направлении секретирующих кристаллины клеток. Ранняя дифференцировка в прозрачных структурах глаза связана с их регулирующей и ингибирующей ролью в процессах ангиогенеза.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г. и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.).
Библиографическая ссылка
Рева И.В., Ямамото Т.Т., Лемешко Т.Н., Олексенко О.М., Гульков А.Н., Альбрандт К.Ф., Можилевская Е.С., Балдаев С.Н., Индык М.В., Николаенко Г.А., Рева Г.В. РОЛЬ НЕЙРОГЛИИ В МОРФОГЕНЕЗЕ ПРОЗРАЧНЫХ СТРУКТУР ГЛАЗА ЧЕЛОВЕКА // Современные проблемы науки и образования. 2017. № 1. ;URL: https://science-education.ru/ru/article/view?id=26003 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.26003



