По данным ВОЗ, в мире ежегодно регистрируется более 1,8 млн новых случаев заболевания раком легкого и более 1,5 млн смертей от данной патологии, что делает её наиболее распространенной причиной смерти от рака [13]. В настоящее время проблема ранней диагностики рака легкого остается не решенной, а изученные на текущий момент молекулярные маркёры не показывают достоверной специфичности. Прогностическое значение многих из них спорно и, главным образом, отражает различия в методологии исследований, группах пациентов и интерпретациях. Прогностической ценностью обладают сигнатуры экспрессии определённых генов (например, DUSP6, MMD, STAT1, ERBB3 и LCK) хотя сообщенные данные чрезвычайно гетерогенны. Трансформация клеток в раковые и опухолевая прогрессия связаны с накоплением изменений в геноме, что обеспечивает приобретение трансформированными клетками: неограниченного потенциала к пролиферации; резистентности к сигналам апоптоза; способности поддерживать ангиогенез; способности к инвазии и метастазированию. Молекулярные изменения, ответственные за приобретение вышеуказанных свойств, могут использоваться в качестве онкомаркеров [15]. К подобным молекулярным онкомаркерам можно отнести специфические изменения числа копий генов [3].
Изменение числа копий гена (сopy number variation, CNV) является одним из основных механизмов изменения степени экспрессии потенциальных онкогенов и генов-супрессоров опухолей раковыми клетками. CNV – вид генетического полиморфизма, возникающий в результате несбалансированных хромосомных перестроек, таких как делеции и дупликации. Результатом вариации может явиться снижение или повышение числа копий определенного гена и, следовательно, пониженная или повышенная экспрессия продукта гена – белка или некодирующей РНК [5].
Начиная с 2004 года в многочисленных исследованиях были представлены данные о наличии множества субмикроскопических вариаций числа копий сегментов ДНК – класс, известный как структурные вариации. Внутри этого класса наибольшей компонентой являются вариации числа копий генов (CNV), которые включают в себя несбалансированные перестройки, увеличивающие или уменьшающие содержание ДНК. На сегодняшний день термином CNV обозначают фрагменты размером больше, чем 50 б.п.о., тогда как более мелкие элементы относят к вставкам или делециям [14]. Минимум 12% человеческого генома подвергается вариациям числа копий. Вклад CNV в вариативность генома сопоставим с вкладом однонуклеотидных полиморфизмов или даже превышает его [12]. Публикации последних лет показывают, что CNV являются следующим уровнем в полном понимании молекулярного контекста развития опухолевого процесса. Так, изучена роль CNV в качестве фактора малигнизации тканей желудка: в работе Günther T. и соавт. [9] показано, что увеличение копийности гена MDM2 коррелирует с увеличенной экспрессией белка MDM2 и понижением экспрессии белка p53.
Исследование копийности генов может расширить представление о молекулярных механизмах, лежащих в основе малигнизации тканей легкого, и обеспечить данными, необходимыми для формирования панели новых высокоспецифичных онкомаркеров, которые можно будет использовать для предиктивной диагностики, планирования стратегии лечения и прогнозирования развития заболевания. Поэтому целью нашего исследования стало изучение механизмов малигнизации тканей легкого на примере изменения относительной копийности генетических локусов, ответственных за регуляцию апоптоза (BAX, BCL2, C-FLAR, P53, MDM2), пролиферацию (SOX2, OCT4, NANOG, PIK3 и MKI67), окислительное фосфорилирование (HV2) и ответ на гипоксию (HIF1A1) для выявления высокоспецифичных онкомаркеров.
Материалы и методы
Клиническим материалом для исследования послужили срезы тканей из FFPE-блоков 30 пациентов Юга России с гистологически подтвержденным диагнозом «рак легкого» (аденокарцинома, степень дифференцировки G3, без мутаций в гене EGFR). Срезы толщиной 3 мкм фиксировались на предметных стеклах, покрытых полиэтиленом (Polyethylene Naphthalate (PEN)-membrane), подвергались депарафинизации (о-ксилолом) и окрашивались гематоксилином-эозином. Из окрашенных препаратов с помощью лазерной микродиссекции (Palm MicroBeam, Carl Zeiss, Германия) выделялись опухолевые и нормальные клетки, из которых фенол-хлороформным методом проводилась экстракция ДНК.
Определение относительной копийности 12 генетических локусов (BAX, HIF1A, OCT4, SOX2, BCL2, CFLAR, NANOG, P53, MDM2, HV2, PIK3 и MKI67) проводили методом Real-Time qPCR (RT-qPCR). Принцип метода заключается в одновременной амплификации гена-мишени и референсного гена в опытной и контрольной пробах. Вывод об изменении дозы гена делается на основании анализа соотношения сигналов, продуцируемых ампликонами изучаемой и референсной последовательностей [3].
Количественная RT-PCR амплификация проводилась с использованием термоциклера Bio-Rad CFX96 (Bio-Rad, USA) в соответствии с инструкциями производителя по следующей программе: 95 °C 5 мин., и 40 циклов при 95 °C 10 сек, 58 °C 30 сек (чтение оптического сигнала FAM) и 72 °C 30 сек. Каждые 20 мкл ПЦР-смеси для анализа содержали 2,4 нг геномной ДНК, 0.2 mM dNTP’s, по 600 нМ прямого и обратного праймеров для референсного гена (GAPDH) или гена-мишени, 2.5 mM MgCl2, 1X ПЦР-буфер, 0.1 u/µl SynTaq ДНК-полимеразы с ингибирующими активность фермента антителами («Синтол», Россия). В качестве красителя использовали EvaGreen®Dye (Biotium, США). Амплификация каждой из проб осуществлялась в трех повторностях. Первичные данные RT-qPCR получали с использованием программного обеспечения Bio-Rad CFX Manager ver 3.1.
Прямые и обратные праймеры были разработаны нами с использованием базы данных NCBI GenBank (табл. 1). Генетический локус GAPDH использовали в качестве референсного для нормализации полученных показателей количественной RT-qPCR.
Таблица 1
Панель праймеров для определения относительной копийности генов
|
№ |
Наименование гена |
Последовательность прямого праймера |
Последовательность обратного праймера |
|
1. |
HV2 |
GGG AGC TCT CCA TGC ATT TGG TA |
AAA TAA TAG GAT GAG GCA GGAATC |
|
2. |
GAPDH |
GCT GAA CGG GAA GCT CAC T |
GCA GGT TTT TCT AGA CGG CAG |
|
3. |
BAX |
GCC TCC TCT CCT ACT TTG GG |
AAA CAC AGT CCA AGG CAG C |
|
4. |
BCL2 |
GAG TGG GAT GCG GGA GAT G |
GGT GAA GGG CGT CAG GTG |
|
5. |
HIF1α |
ACT GCA CAG GCC ACA TTC A |
TGG GTG AGG AAT GGG TTC AC |
|
6. |
OCT4 |
TTT GTG CCA GGG TTT TTG GG |
CTT CAC CTT CCC TCC AAC CA |
|
7. |
SOX2 |
TTT GTC GGA GAC GGA GAA GC |
CCG GGC AGC GTG TAC TTA T |
|
8. |
CFLAR |
GGC TCC CAG AGT GTG TAT GG |
GGC CCT CTG ACA CCA CAT AG |
|
9. |
NANOG |
TGC AAC CTG AAG ACG TGT GA |
ACC AGA ACA CGT GGT TTC CA |
|
10. |
P53 |
GGT CGG TGG GTT GGT AGT TT |
GTG TGG GAT GGG GTG AGA TT |
|
11. |
MKI67 |
TGA GTC AGT GAA GAA AGA GTT GGA T |
CCC CCT GTA AAC CAT CAG CA |
|
12. |
MDM2 |
TCT TTG GGA CCC ATC TAC CCT |
AGA ATG CTT TAG TCC ACC TAA CCT T |
|
13. |
PIK3 |
GCT TGG GAG GAT GCC CAA T |
GCT GTG GAA ATG CGT CTG GA |
Усредненные данные по каждому генетическому локусу нормировались по усредненному показателю референсного гена для получения величины ΔCt (ΔCt=Ct(исследуемого гена) – Ct(GAPDH)). Относительную копийность генетического локуса (RQ) рассчитывали по формуле 2-ΔCt. Далее вычисляли медиану [2] RQоп опухолевых образцов и медиану RQк контрольных (нормальных) образцов для каждого генетического локуса и рассчитывали соотношение относительной копийности генов в опухолевых клетках по отношению к нормальных клеткам ткани легкого: RQоп/RQк [3].
Статистический анализ выполняли с использованием прикладных пакетов программ Microsoft Excel 2013 и STATISTICA 8.0. Оценку различий проводили с использованием критерия Манна-Уитни [2] для порогового уровня статистической значимости р<0.05, корреляционный анализ проводили с использованием коэффициента ранговой корреляции Спирмена (r).
Результаты и обсуждение
Сравнение относительной копийности генетических локусов в опухолевых и нормальных клетках легкого показало статистически достоверное (p<0.05) снижение копийности гена BAX на 20% и гена р53 на 60%, а также статистически достоверное (p<0.05) увеличение копийности генов HIF1A1 и MDM2 на 30% и 90% соответственно в опухолевых клетках относительно нормальных. Достоверного изменения копийности других генетических локусов не обнаружено (рисунок).
Нарушение нормального функционирования MDM2/P53 пути является неотъемлемой частью канцерогенеза. Известна важная роль изменения копийности генов р53 и MDM2 в опухолевой трансформации тканей других органов, например желудка [9]. р53 активируется при накоплении повреждений ДНК и запускает транскрипцию одной группы генов и репрессию другой, результатом которой является остановка клеточного цикла; при сильном стрессовом сигнале принимает участие в запуске апоптоза путём стимуляции рецепторов смерти, путём взаимодействия с Bax, путём активации p53-зависимого модулятора апоптоза PUMA [1]. Ген MDM2 локализован на хромосоме 12 и считается негативным регулятором функции белка р53. MDM2 подавляет его активность, катализируя перенос активированного убиквитина с фермента группы Е2 на белок р53, маркированный убиквитином белок р53 является субстратом для 26S протеасомы, которая осуществляет протеолиз молекул белка р53 [4].
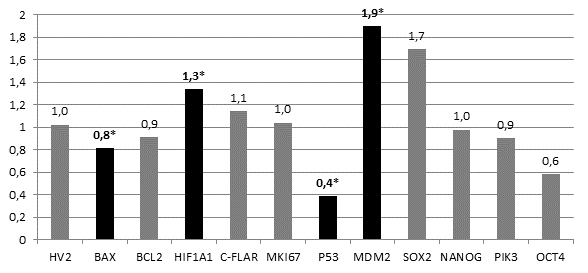
Соотношение копийности генов в опухолевых клетках относительно нормальных клеток легкого. *- статистически достоверные отличия (р<0.05)
В нашем исследовании было оценено изменение соотношения копийности пар про- и антиапоптозных генов - р53/MDM2 и BAX/BCL2 (табл. 2). В опухолевых клетках легкого обнаружено снижение соотношения копийности генов р53/MDM2 в 3,6 раза по сравнению с нормальными клетками. Это может стать причиной изменения экспрессии данных генов в опухолевых клетках легочной ткани и нарушения р53-зависимой регуляции апоптоза.
Несмотря на описанное выше снижение копийности гена BAX в опухолевых клетках, соотношение копийности генов BAX/BCL2 в опухолевых и нормальных клетках легкого практически не отличалось. Белок BAX взаимодействует с митохондриальной мембраной и индуцирует открытие митохондриальных потенциалзависимых анионных каналов, образует олигомерные поры в митохондриальной мембране, что приводит к высвобождению цитохрома с и других проапоптотических факторов из митохондрий [8]. BCL2 регулирует апоптоз, контролируя проницаемость митохондриальной мембраны путем ингибирования проапоптозных белков Bax и Bak [11]. В ходе исследования обнаружено снижение силы корреляционных связей генов BAX и BCL2 в клетках аденокарциномы легкого по сравнению с нормальными клетками легкого (табл. 2), что может явиться причиной нарушения функционирования системы генов BAX/BCL2 на транскриптомном уровне.
Таблица 2
Соотношения копийности пар про- и антиапоптозных генов и их корреляционные взаимосвязи в опухолевых и нормальных клетках легкого
|
Название пар генов |
Соотношение копийности генов |
Коэффициент корреляции, r |
||
|
нормальные клетки |
опухолевые клетки |
нормальные клетки |
опухолевые клетки |
|
|
BAX/BCL2 |
1,800 |
1,610 |
0,798 |
0,185 |
|
р53/MDM2 |
0,160 |
0,045 |
0,847 |
0,784 |
В большинстве солидных опухолей развиваются регионы гипоксии, так как рост этих опухолей опережает развитие их кровоснабжения. Для того чтобы выжить, опухолевые клетки выработали скоординированный набор ответов для адаптации к гипоксии [10]. Ген HIF1A играет существенную роль в этом процессе, он кодирует альфа-субъединицу индуцированного гипоксией фактора транскрипции-1 (HIF-1). HIF-1 является главным регулятором клеточного и системного гомеостатического ответа на гипоксию путем активации транскрипции генов, участвующих в энергетическом обмене, ангиогенезе, апоптозе. Повышение его транскриптомных и протеомных уровней наблюдается при многих онкологических заболеваниях, например при гепатоцеллюлярной карциноме и раке легких [6]. В солидных опухолях HIF-1 способствует выживанию и миграцию клеток, стимулирует ангиогенез и вызывает резистентность к лучевой и химиотерапии [7]. Обнаруженное в нашем исследовании увеличение копийности гена HIF1A в клетках аденокарциномы легкого может отражать повышение потенциала опухолевой ткани к метаболической адаптации к гипоксии и к распространению опухолевых клеток из первичного очага. Полученные данные способствуют лучшему пониманию механизмов активации HIF-1 в клетках и могут быть полезны при разработке новых терапевтических подходов для лечения онкопатологии.
Заключение
Обнаруженное в исследовании снижение копийности проапоптозных генов BAX и р53 и увеличение копийности антиапоптозного гена MDM2, снижение соотношения р53/MDM2 и корреляции BAX/BCL2 может лежать в основе нарушения регуляции апоптоза, приводящего к его ингибированию в опухолевой ткани легкого. А повышение копийности гена HIF1A1 в клетках опухоли может стимулировать ангиогенез и улучшать её метаболическую адаптацию к гипоксии. Таким образом, изменение копийности генов BAX, р53, MDM2 и HIF1A1, соотношения копийности р53/MDM2 и корреляции BAX/BCL2 имеют высокий потенциал в качестве молекулярных маркеров для прогнозирования течения и развития рака легкого.
Работа выполнена при поддержке гранта РФФИ № 16-34-00267 мол_а.
Библиографическая ссылка
Кутилин Д.С., Енин Я.С., Петрусенко Н.А., Водолажский Д.И. ИЗМЕНЕНИЕ КОПИЙНОСТИ ГЕНЕТИЧЕСКИХ ЛОКУСОВ ПРИ МАЛИГНИЗАЦИИ ТКАНЕЙ ЛЕГКОГО // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25994 (дата обращения: 06.02.2026).



