В наши дни дентальные имплантаты представляют собой надежный вариант лечения в успешной реабилитации пациентов с использованием различных видов ортопедических конструкций. Применение дентальных имплантатов стало стандартной процедурой для замещения одиночно отсутствующего зуба в эстетически значимой зоне, тем самым обеспечивая множество преимуществ. Бранемарк и иные впервые описали процесс остеоинтеграции более 45 лет назад [7, 8]. Его работы запустили новую эру исследований по изучению форм и материалов для изготовления зубных имплантатов. Устойчивый рост к таким исследованиям продолжался и в последнем десятилетии, когда центр медико-биологических исследований сместился от геометрии имплантата к остеоиндуктивному потенциалу поверхности материала. На сегодняшний день у приблизительно 1300 различных систем имплантатов существуют свои формы, размеры, материалы, конструкции резьбы и абатмента, химический состав, смачиваемость [9]. Обычные имплантаты имеют цилиндрическую или коническую форму [10]. Поверхностные характеристики, такие как рельеф, смачиваемость покрытий, способствуют оптимизации биологических процессов во время остеоинтеграции путем опосредования прямого взаимодействия с остеобластами для формирования костной ткани [7]. Тем не менее неудачи все еще имеют место у небольшого количества пациентов с дентальными имплантатами. Потеря первичной стабильности имплантата из-за недостаточной остеоинтеграции встречается у 1–2% пациентов в течение первых нескольких месяцев [8]. Отдаленные осложнения при дентальной имплантации развиваются через несколько лет после успешной остеоинтеграции у 5% пациентов [10]. Демографическая тенденция в промышленно развитых странах последовательно приводит к увеличению количества пожилых пациентов со сложными клиническими условиями, такими как нарушение качества костной ткани и ее объема, или сложными сопутствующими заболеваниями. Остеоинтеграция может быть нарушена у пациентов с сахарным диабетом, остеопорозом, при применении бисфосфонатов или после лучевой терапии. Эти пациенты остаются большой проблемой в дентальной имплантологии и способствуют созданию предпосылок для модификации поверхности дентальных имплантатов. Одним из перспективных материалов для изготовления дентальных имплантатов технологией холодного прессования является нетканый титановый материал со сквозной пористостью (металлорезина – МР, НТМСП), представляющий собой упруго-демпферную пористую систему [1, 2, 3, 4, 5, 6]. Однако процессы деформации данного материала с учетом анализа рентгенологической картины в системе «кость – дентальный имплантат» до сих пор не были изучены.
Цель исследования – проведение анализа влияния аутологичного модифицирования дентальных имплантатов на основе нетканого титанового материала со сквозной пористостью на внутрикостную деформацию.
Материалы и методы. С целью оптимизации процессов остеоинтеграции, обеспечения первичной стабильности дентальных имплантатов на основе нетканого титанового материала, расширения показаний к дентальной имплантации, повышения остеоиндуктивного и остеокондуктивного потенциалов нами разработан новый метод дентальной имплантации (Патент РФ на изобретение «Способ дентальной имплантации (варианты)» № 2544804) и внутрикостный имплантат (Патент РФ на полезную модель «Дентальный имплантат (варианты)» № 143685). Разработанный нами дентальный имплантат состоит из винта-распорки, который по принципу «дюбеля» распирает втулку на основе НТМСП в костном ложе, при этом достигается первичная стабильность данной конструкции.
В основную группу исследования вошли 39 пациентов, которым была произведена операция дентальной имплантации с аутологичным модифицированием нетканого титанового материала и было уставлено 115 внутрикостных дентальных имплантатов. В контрольную группу были включены 35 пациентов, которым была произведена операция дентальной имплантации 118 внутрикостных имплантатов на основе нетканого титанового материала со сквозной пористостью стандартной конструкции без аутологичного модифицирования материала.
Под местной анестезией производили выкраивание слизисто-надкостничного лоскута в проекции места инсталляции дентального имплантата. Скелетировали альвеолярную часть нижней челюсти и формировали костное ложе. Полученную в ходе препарирования аутологичную костную стружку собирали в дозатор и ресуспендировали ее в физиологическом растворе, после чего аутологичный материал помещали в пресс-форму для холодного прессования.
В ходе технологии холодного прессования была получена внутрикостная втулка на основе нетканого титанового материала со сквозной пористостью, модифицированная аутологичной костной тканью (рис. 1).

Рис. 1. Аутологично-модифицированная внутрикостная часть дентального имплантата
При помощи динамометрического ключа производили инсталляцию внутрикостного винта во втулку и костное ложе, устанавливали формирователи десны.
Внутриротовая рентгенография была проведена за счет нового способа (Патент РФ на изобретение «Способ внутриротовой рентгенографии» № 2576873), который позволяет:
- обеспечивать точное позиционирование сенсора при повторных рентгенологических исследованиях;
- обеспечивать возможность проведения сравнительного текстурального анализа костной ткани челюстей в исследуемой области;
- обеспечивать возможность стандартизации изображений одной области в разные сроки исследования.
Для проведения внутриротовой рентгенографии челюстей сенсор с держателем вносили в полость рта в проекции исследуемой области. Далее изготавливали шаблон сенсора из силиконового оттискного материала путем замешивания массы типа А или С. Силиконовую оттискную массу вносили в область расположения сенсора в полости рта в проекции исследуемого сегмента челюсти, адаптируя к окружающим тканям под контролем прикуса до полимеризации силикона, с образованием паза шаблона сенсора. Производили рентгенографию исследуемой области челюсти. По завершении рентгенографии исследуемой области производили извлечение шаблона сенсора из полости рта (рис. 2).

Рис 2. Шаблон сенсора с держателем
Из паза шаблона сенсора извлекали сенсор. Производили антисептическую обработку шаблона сенсора с держателем. Шаблон сенсора с держателем упаковывали в полимерный пакет для хранения.
На этапах лечения с целью возможности проведения сравнительного текстурального анализа костной ткани челюстей в исследуемой области и обеспечения возможности стандартизации изображений производили повторную рентгенографию в различные временные промежутки путем внесения сенсора в паз шаблона сенсора с держателем в полоти рта. В рамках нашего исследования рентгенографию проводили на 14-е сутки, так как при повторных снимках изменений со стороны деформации внутрикостного элемента не наблюдалось.
При оценке деформации внутрикостного пористого элемента дентального имплантата на основе НТМСП в качестве калибровочных исходных данных использовали межвитковое расстояние профиля метрической резьбы, в вертикальной плоскости которое составляло 0,72 мм. В горизонтальной плоскости использовали исходный диаметр имплантата, проходящий между выемками профиля резьбы, который равнялся 2,06 мм. Для статистической обработки исследования был использован t-критерий Стьюдента. Внутрикостную деформацию оценивали путем измерения расстояния между плоскостью, проходящей через вершины зубцов метрической резьбы, и плоскостью наружного края внутрикостной втулки на основе НТМСП в соответствии с рисунком 3, где d (M) — деформация.
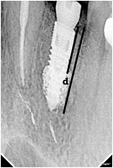
Рис. 3. Оценка внутрикостной деформации дентального имплантата
Результаты и обсуждение. Распределение показателей деформации, полученных для различных имплантатов рабочей группы, показано на рисунке 4.
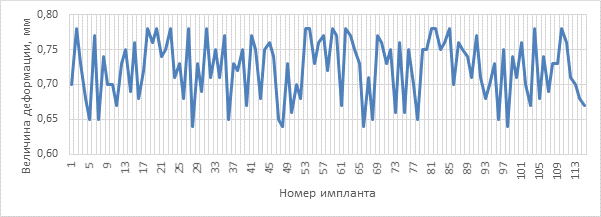
Рис. 4. Распределение показателей деформации в рабочей группе исследования
Распределение показателей деформации имплантатов контрольной группы исследования показано на рисунке 5.
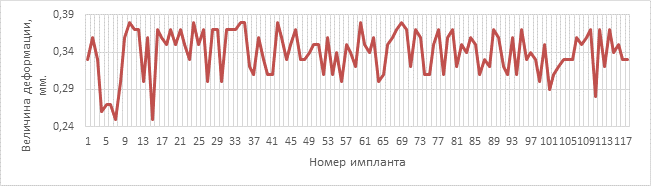
Рис. 5. Распределение показателей деформации в контрольной группе исследования
Параметры деформации в рабочей и контрольной группах приведены в таблице 1.
Таблица 1
Параметры деформации внутрикостной части дентальных имплантатов в исследуемых группах
|
Параметры |
Рабочая группа |
Контрольная группа |
|
Минимальное значение |
0,64 |
0,25 |
|
Максимальное значение |
0,78 |
0,38 |
|
Среднее значение |
0,72 |
0,34 |
|
Среднее линейной отклонение |
0,036304 |
0,024544 |
|
Дисперсия |
0,001789 |
0,000883 |
|
Среднеквадратичное отклонение |
0,042298 |
0,029713 |
|
Коэффициент вариации |
6% |
9% |
Графическое изображение разницы показателей деформаций в контрольной и рабочей группах показано на рисунке 6.
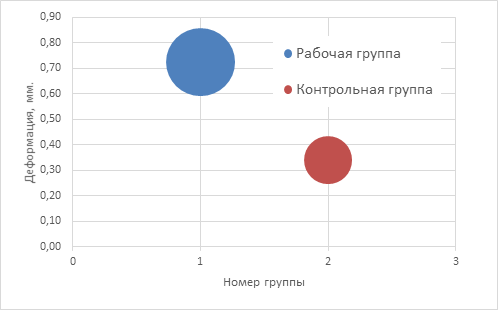
Рис. 6. Анализ показателей деформаций для рабочей и контрольной групп имплантатов (n=233), где Mean – среднее значение в группе, SD – среднее квадратичное отклонение
Среднее значение в группе (Mean) составило в рабочей группе (М1) 0,72 мм, в контрольной группе (М2) 0,34 мм. Среднее квадратичное отклонение (SD) составило в рабочей группе (SD1) 0,042 мм, в контрольной группе (SD2) 0,03 мм. При этом значение критерия t составило 80,1065, число степеней свободы – 231, критический t-критерий равен 1,96. Так как рассчитанное значение критерия больше критического, делаем вывод о том, что наблюдаемые различия статистически значимы (уровень значимости р<0,05).
Заключение. Аутологичное модифицирование нетканого титанового материала со сквозной пористостью способствует деформации внутрикостного элемента дентального имплантата, среднеарифметическое (M) составило 0,72 мм. Отсутствие костной ткани во внутрипоровом пространстве нетканого титанового материала со сквозной пористостью уменьшает параметры внутрикостной деформации, среднеарифметическое (M) – 0,34 мм, что может способствовать смещению внутрикостной пористой втулки, негативно сказываясь на стабильности дентального имплантата.
Библиографическая ссылка
Щербовских А.Е., Гафуров С.А., Кузнецов М.В., Тугушев В.В., Байриков И.М. АНАЛИЗ ВЛИЯНИЯ АУТОЛОГИЧНОГО МОДИФИЦИРОВАНИЯ ДЕНТАЛЬНЫХ ИМПЛАНТАТОВ НА ОСНОВЕ НЕТКАНОГО ТИТАНОВОГО МАТЕРИАЛА СО СКВОЗНОЙ ПОРИСТОСТЬЮ НА ВНУТРИКОСТНУЮ ДЕФОРМАЦИЮ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25972 (дата обращения: 03.02.2026).



