Актуальность. Обеспечение необходимых условий для остеоинтеграции дентальных имплантатов во многом предопределяет их стабильность и успешность лечения пациентов. Факторы, от которых зависит будущий характер остеоинтеграции, весьма разнообразны. Это анатомическое место и вид костной ткани, в которую имплантируется материал, возраст пациента, площадь контакта имплантата с прилежащей костью, состояние костного мозга, выраженность клеточных реакций организма на чужеродный имплантат, хирургическая техника его установки и многое другое. Важнейшее значение для успеха остеоинтеграции имеет выбор оптимального дентального имплантата. Его размер, форма, материал, особенности конструктивного решения во многом предопределяют характер остеоинтегративных процессов в зоне имплантации [5, 6]. Поиск новых материалов для изготовления дентальных имплантатов, обеспечивающих их остеоинтеграцию и стабильность в костном ложе, является актуальной проблемой современной стоматологии. Одним из перспективных материалов для этого является нетканый титановый материал со сквозной пористостью (металлорезина – МР, НТМСП), представляющий собой упруго-демпферный пористый материал [1-4].
Цель исследования – сравнительная оценка особенностей остеоинтеграции нетканого титанового материала со сквозной пористостью и титана марки ВТ1-00 в условиях эксперимента на животных.
Материалы и методы. Работу выполняли на базе Института экспериментальной медицины и биотехнологий СамГМУ (директор – профессор Л.Т. Волова) с соблюдением международных требований к выполнению доклинических исследований на животных.
Объектами экспериментальной работы стали 96 крыс линии Wistar. В опытную группу вошли 48 животных, которым имплантировали материал НТМСП (нетканый титановый материал со сквозной пористостью), изготовленный методом холодного прессования. В контрольную группу включили 48 животных, которым имплантировали материал титан марки ВТ1-00, изготовленный методом фрезерования. Все имплантаты имели цилиндрическую форму, диаметр 2 мм и высоту 6 мм. Геометрия имплантатов была обоснована методом морфометрических исследований как наиболее оптимальная для их инсталляции в условиях минимального объема костной ткани у животных. Крыс седатировали препаратом «Рометар», а через 20 мин внутримышечно вводили препарат «Золетил».
Для унификации операций внутрикостной имплантации материалов нами был разработан способ оперативного доступа к лопатке крысы (Патент РФ на изобретение № 2550938). Оперативные доступы каждому животному осуществляли в области двух лопаточных костей с установкой одного типа материала. Выполняли разрезы кожи длиной 2 см в проекции нижнего края подостной ямки лопаточной кости, повторяя его контуры. Тупо проходили в область нижнего края подостной ямки. Скелетировали мышцы, прикрепляющиеся к подостной ямке лопаточной кости в направлении ости. Формировали слепое костное ложе в области ости под углом 450 к поверхности подостной ямки. В костное ложе имплантировали материал и послойно ушивали послеоперационную рану (рис. 1 А, Б).
Предложенный нами способ не нарушал целостности мышц, прикрепляющихся к лопатке на протяжении. При скелетировании мышц, прикрепляющихся к подостной ямке лопаточной кости в направлении ости, происходила потеря не более одной точки прикрепления мышц. При этом фиксация мышц к ости лопатки и другим костям конечности крысы сохранялась. Это обеспечивало анатомичность и малотравматичность оперативного вмешательства, создавая оптимальные условия для последующей оценки остеоинтеграции имплантируемых материалов.
А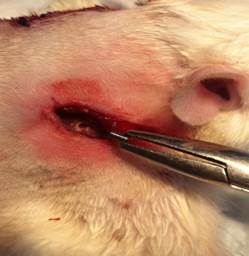 Б
Б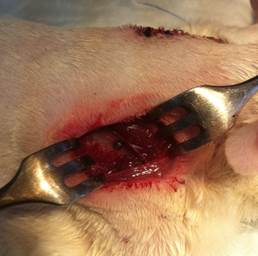
Рис. 1. Оперативный доступ к лопатке крысы: А – Сформированное костное ложе в области ости лопатки; Б – Имплантация материала в костное ложе
Животных выводили из эксперимента на 7-е, 21-е, 90-е сутки путем передозировки препарата «Золетил» при его внутримышечном введении, предварительно выполняя рентгенологическое исследование лопаток.
Проводили балльную оценку рентгенологической картины границы кость – имплантат. При этом на 4 балла оценивали отсутствие разобщения и разряжения костной ткани между имплантатом и костью; на 3 балла — разобщение между имплантатом и костью линейного характера, без признаков резорбции и разряжения костной ткани; на 2 балла — разобщение между имплантатом и костью с признаками резорбции и разряжения костной ткани; на 1 балл оценивали миграцию имплантата и его нахождение вне костного ложа.
При оценке макроскопической картины в области имплантации отмечали наличие или отсутствие местной воспалительной реакции, далее выполняли балльную оценку стабильности имплантата и характера его контакта с костью.
При этом на 4 балла оценивали отсутствие видимой подвижности имплантата в костном ложе; на 3 балла — подвижность имплантата в одной горизонтальной плоскости; на 2 балла — подвижность имплантата в двух горизонтальных плоскостях; на 1 балл — подвижность имплантата в вертикальной плоскости.
Контакт имплантатов с костной тканью и макроскопический характер регенерата оценивали на 4 балла в случае полного покрытия имплантата новообразованной костной тканью на уровне поверхности материнской кости; на 3 балла — в случаях, когда костный регенерат частично покрывал имплантат с образованием костного козырька; на 2 балла – при покрытии имплантата фиброзной тканью; на 1 балл — при резорбции костной ткани в пришеечной части имплантата.
После осторожного извлечения имплантатов из костного ложа выполняли забор материала для микроскопического исследования. Препараты декальцинировали по стандартным методикам, фиксировали в 10%-ном растворе нейтрального формалина, проводили в спиртах восходящей крепости и заливали в парафин. Изготавливали серийные срезы толщиной 5–6 мкм на всю глубину блока на роторном микротоме Sakura Accu-Cut SRM200 (Sakura Finetek, Япония). Гистологические препараты окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизон, крезиловым фиолетовым. Препараты изучали светооптически при помощи биологического микроскопа Nikon Alphaphot-2 YS2-H (Nikon, Япония), телеметрически при помощи видеокамеры KCC-31OPD. Анализ и фотосъемку полученных препаратов производили с помощью аппаратурного комплекса «Видеотест» с программным обеспечением «Морфология 5.2». (ООО «Видеотест», Санкт-Петербург, Россия).
Результаты исследования. В обеих группах животных на протяжении всего периода наблюдения при оценке макроскопической картины области послеоперационной раны мы не наблюдали явлений хронического воспаления и других местных осложнений. Купирование послеоперационной воспалительной реакции тканей в области вмешательства отмечали в среднем к 7-м суткам.
Результаты балльной оценки рентгенограмм лопаток и макроскопической картины области имплантации отображены в таблице 1, где представлены среднеарифметические данные анализа.
Таблица 1
Оценка рентгенологической и макроскопической картины зоны имплантации в опытной и контрольной группах животных
|
Группа животных |
Стабильность имплантатов, баллы |
Контакт имплантатов с костной тканью и макроскопический характер регенерата, баллы |
Рентгенологическая картина состояния границы кость — имплантат, баллы |
||||||
|
7-е сутки |
21-е сутки |
90-е сутки |
7-е сутки |
21-е сутки |
90-е сутки |
7-е сутки |
21-е сутки |
90-е сутки |
|
|
Опытная |
3,333 |
3,5333 |
3,6333 |
1,966 |
2,0666 |
2,566 |
3,5333 |
3,6 |
3,733 |
|
Контрольная |
3,066 |
2,966 |
2,866 |
1,862 |
1,933 |
2,0666 |
3,266 |
2,966 |
2,933 |
Рентгенологическая картина контакта имплантатов и костной ткани лопаток в контрольной группе животных, которым имплантировали титан марки ВТ1-00, была разнородной. Так, на 7-е стуки исследования у 5 животных наблюдали миграцию имплантата из костного ложа, связанную с его первичной нестабильностью (рис. 2 А). На поздних сроках наблюдения нередко отмечали резорбцию костной ткани около имплантата.
При оценке макроскопической картины зоны имплантации в контрольной группе на ранних сроках нередко отмечали нестабильность имплантата, который был подвижен в горизонтальных плоскостях и легко извлекался из костного ложа (рис. 2 Б). В динамике у животных этой группы имплантат покрывался плотной фиброзной тканью; у некоторых крыс к завершению эксперимента отмечали образование костных козырьков над поверхностью имплантата.
А 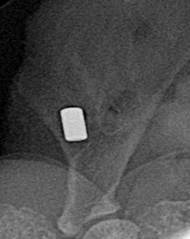 Б
Б 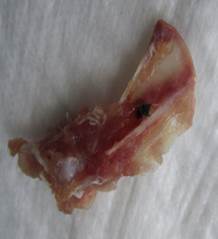
Рис. 2. Зона имплантации титана марки ВТ1-00, 7-е сутки: А – рентгенограмма лопатки (имплантат вне костного ложа); Б — макроскопическая картина (имплантат мигрировал из костного ложа)
А 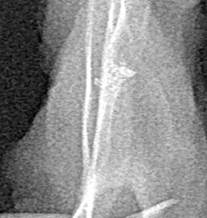 Б
Б 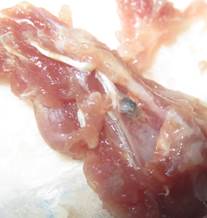
Рис. 3. Зона имплантации материала МР, 21-е сутки: А – рентгенограмма лопатки (имплантат тесно контактирует с костным ложем); Б — макроскопическая картина (имплантат покрыт фиброзной тканью)
В опытной группе животных рентгенологически на ранних сроках наблюдения миграции имплантатов не отмечали. Однако редко имели место разобщения между имплантатами и костью линейного характера, без признаков резорбции костной ткани (рис. 3 А). На поздних сроках наблюдения разобщения между имплантатами и костью не было. Макроскопически подвижность имплантатов не выявляли. Уже на ранних сроках их с трудом извлекали из костного ложа. Поверхность имплантата в динамике покрывалась фиброзной тканью, которая постепенно замещалась костной тканью (рис. 3 Б). У ряда животных опытной группы к завершению эксперимента поверхность имплантата была полностью скрыта новообразованной костной тканью. Удалить имплантат на этих сроках из костного ложа было технически трудно.
Микроскопические результаты исследования показали, что при размещении в костном ложе лопатки имплантатов как из титана марки ВТ1-00, так и из НТМСП в динамике в периимплантарной зоне происходило активное ремоделирование костной ткани. При этом при использовании НТМСП процессы ремоделирования происходили более интенсивно, чем в контрольной группе животных. Уже на ранних сроках наблюдения в опытной группе отмечали активную остеобластическую реакцию вблизи зоны дефекта. Соединительнотканная прослойка между имплантатом и костью в этой группе была обычно тонкой и встречалась вдоль края дефекта не на всем его протяжении. Напротив, в группе животных, которым имплантировали титан марки ВТ1-00, на всех сроках наблюдения импланты были отделены от подлежащей кости толстой соединительнотканной прослойкой, особенно выраженной на ранних сроках наблюдения (рис. 4 А, Б).
А 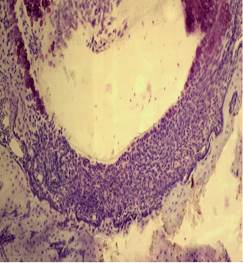 Б
Б 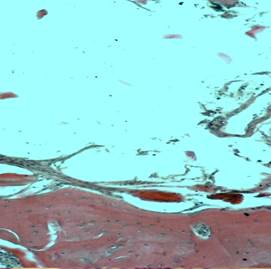
Рис. 4. Зона имплантации: А – Контрольная группа, 21-е сутки (толстая соединительнотканная капсула по краю костного ложа), окраска – крезиловый фиолетовый. Ув. 100; Б – Опытная группа, 90-е сутки (сформированная костная ткань ложа с тонкой прерывистой соединительнотканной капсулой и мелкими фрагментами кости), окраска – гематоксилин и эозин. Ув. 100
Заключение. Сравнительная оценка процессов остеоинтеграции нетканого титанового материала со сквозной пористостью и титана марки ВТ1-00 при их имплантации в костную ткань лопатки животных в эксперименте, как на макроскопическом, так и на микроскопическом уровне показала преимущество нового материала. При использовании нетканого титанового материала со сквозной пористостью мы не наблюдали нестабильности и миграции материала. Костная ткань ложа, где были установлены имплантаты из нетканого титанового материала со сквозной пористостью, подвергалась ремоделированию. На поздних сроках отмечалась выраженная интеграция костной ткани с материалом, удаление которого вызывало технические затруднения. Таким образом, новый нетканый титановый материал со сквозной пористостью доказал свою способность к остеоинтеграции и может быть использован как перспективная разработка в области дентальной имплантологии.
Библиографическая ссылка
Байриков И.М., Волова Л.Т., Щербовских А.Е., Долгушкин Д.А. ОСОБЕННОСТИ ОСТЕОИНТЕГРАЦИИ НЕТКАНОГО ТИТАНОВОГО МАТЕРИАЛА СО СКВОЗНОЙ ПОРИСТОСТЬЮ (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ) // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25971 (дата обращения: 06.02.2026).



