Нарушения мозгового кровообращения различной этиологии являются одной из наиболее значимых нозологий и занимают второе место в структуре общей смертности. Разработка способов профилактики и лечения до настоящего времени является одной из актуальных проблем как клинической фармакологии, так и неврологии. Поиск и использование большого количества экспериментальных моделей ишемии головного мозга обусловлено различными вариантами нарушения мозгового кровообращения. Чтобы смоделировать в эксперименте тотальную ишемию головного мозга, используют четырёхсосудистую модель ишемии головного мозга. В этой модели создается окклюзия двух позвоночных и двух общих сонных артерий. Данный вариант патологии является одним из наиболее сложно выполнимых в техническом плане и позволяет получить тотальную ишемию мозга более чем у 90% животных [1; 10]. Оценку последствий ишемии головного мозга можно провести с помощью морфометрического изучения его срезов. Нейроны лобной доли, мозжечка и гиппокампа являются наиболее чувствительными к гипоксии и ишемии. Гиппокамп обеспечивает реализацию механизмов памяти, поведенческих реакций, выполняет функцию фиксации эмоционально значимых событий [2; 3; 5]. Функциональные, биохимические и морфологические признаки ишемии и повреждения нейронов фиксируются уже после 2-минутной ишемии [7; 9].
Цель исследования: провести морфометрическое исследование нейронов коры лобной доли головного мозга и СА1 области гиппокампа крыс при моделировании тотальной ишемии ГМ (головного мозга) и при коррекции тадалафилом.
Материал и методы исследования. Исследование выполнено на 40 половозрелых крысах-самцах линии Wistar массой 230-260 г. Экспериментальные животные были разделены на 4 группы: 1) контрольную (n=10), 2) группу с двухсосудистой патологией (n=10), 3) группу с четырехсосудистой патологией (n=10), 4) группу с патологией и коррекцией тадалафилом (1 мг/кг, в/б), (n=10). Животные содержались в стандартных условиях вивария НИУ «БелГУ» со свободным доступом к еде и воде. Содержание животных и постановка эксперимента проводилась в соответствии с требованием приказов № 1179 МЗ СССР от 11.10.1983 г. и № 267 РФ от 19.06.2003 г., а также по международным правилам Guide for the Care and of Laboratory Animals.
Животным 2-й группы моделировали двухсосудистую локальную ишемию: на 4 минуты перекрывали кровоток в общих сонных артериях. Крысам 3-й группы была смоделирована тотальная четырехсосудистая ишемия головного мозга с ишемическим периодом 4 минуты [8]. Животным 4-й группы за 60 минут до моделирования тотальной ишемии внутрижелудочно вводили ингибитор фосфодиэстеразы-5, тадалафил, в дозе 1 мг/кг.
Наркотизацию животных проводили препаратом «Золетил 100», 60 мг/мл, и хлоралгидратом, 150 мг/мл. Животных выводили из эксперимента через 72 часа с момента его начала путем передозировки наркозных препаратов.
Головной мозг извлекали из полости черепа, разрезали на 3 фрагмента и фиксировали в 10%-ном растворе нейтрального формалина в течение 2-3 суток. Для получения гистологических препаратов кусочки мозга заливали в парафин по стандартной методике, после чего изготавливали серийные срезы толщиной 4 мкм на сертифицированном ротационном микротоме Leica (Германия). Для гистологического и морфометрического исследования срезы окрашивали гематоксилином и эозином в автомате для окраски гистологических срезов и мазков (Autostaininer XL ST5010; Leica, Германия), а также тионином по методике Ниссля. Морфометрию выполняли после микроскопического исследования с помощью микроскопа «Leica DM 4000 B» и создания цифрового изображения на полуавтоматическом сканере Mirax Desk (Carl Zeiss Micrimaging GMbH, Германия). Для этого использовали программу «Pannoramic Viewer 1.15». Производили подсчёт неизмененных и гиперхромных нейронов пирамидного и полиморфного слоев СА1 области гиппокампа и нейронов лобной доли, измеряли больший и меньший диаметры перикарионов, их периметр и площадь, диаметр ядер и ядрышек, определяли относительное количество нейронов в нескольких полях зрения с последующим пересчетом на 0,01 мм². У каждого животного производили 30 измерений каждого планиметрического и количественного показателя с занесением данных в таблицу MS Excel и Statistica 10.0. Для всех данных была применена описательная статистика: данные проверены на нормальность распределения. Тип распределения определялся критерием Шапиро-Уилка. В случае нормального распределения были подсчитаны среднее значение (M) и стандартная ошибка среднего (m). В случаях ненормального распределения были рассчитаны медиана (Me) и квартильный размах (QR). Межгрупповые различия анализировались параметрическими (t-критерий Стьюдента) или непараметрическими (критерий Манна-Уитни) методами в зависимости от типа распределения. Различия были определены при 0,05 уровня значимости. Статистический анализ выполнен с помощью программного обеспечения Statistica 10.0.
Результаты исследования
При обзорной микроскопии у интактных животных полученные нами результаты соответствовали описаниям цитоархитектонических особенностей лобной доли и гиппокампа [4; 6]. Нейроны были преимущественно пирамидной, округлой или многоугольной формы, с крупными округлыми ядрами и мелкозернистой цитоплазмой. У многих нейронов базофильная субстанция цитоплазмы имела вид крупных глыбок, расположенных периферически. В некоторых нейронах чётко определялись одно или два центрально расположенных ядрышка (рис. 1).
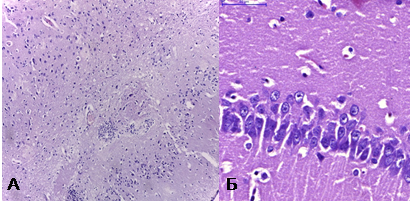
Рис. 1. А - лобная доля интактной крысы, X 100, окр. гематоксилин+эозин; Б – гиппокамп интактной крысы, X 400, окр. гематоксилин+эозин
Область лобной доли характеризовалась низкой плотностью расположения, а область СА1 гиппокампа высокой плотностью средних по размеру нейронов. Морфометрические изменения нейронов при двухсосудистой модели ишемии имели общую тенденцию к увеличению и характеризовались увеличением максимального и минимального диаметров перикарионов, их периметра и площади. Диаметр, площадь и периметр ядер нейронов также увеличивались. Общее количество гиперхромных нейронов составило 36,7%, а двуядрышковых - 16,7% (табл. 1). Изменения аналогичных показателей в области СА1 гиппокампа были менее значительны, однако общая тенденция к их увеличению прослеживалась (табл. 2).
Таблица 1
Морфометрическая характеристика нейронов лобных долей головного мозга крыс (М±m; n=30)
|
Параметры |
Интактные |
2-сосудистая ИГМ |
4-сосудистая ИГМ |
иФДЭ-5+ИГМ |
|
Маx D |
12,51±0,29 |
13,23±0,42# |
13,54±0,63# |
8,57±0,35# |
|
Min D |
8,46±0,28 |
10,41±0,40* |
6,58±0,21* |
5,62±1,51* |
|
Периметр клетки |
35,87±0,90 |
41,58±1,27* |
38,60±1,38* |
23,83±4,46* |
|
S клетки |
83,33±3,25 |
120,48±5,81* |
75,45±3,62* |
40,67±1,28* |
|
Периметр ядра |
21,98±0,89 |
29,68±1,01* |
23,58±0,65* |
16,38±1,89* |
|
S ядра |
35,08±2,21 |
58,61±4,21* |
38,90±2,02* |
20,56±0,39* |
|
D ядра |
6,28±0,24 |
9,15±0,42* |
7,37±0,24* |
5,64±0,11* |
|
D ядрышка |
1,88±0,07 |
Гипохромные нейроны - (46,7%) -2,65±0,50 Гиперхромные - (36,7%) Двуядрышковые - (16,7%) -2,40±0,24 |
Гипохромные нейроны - (10%) - 1,67±0,18 Гиперхромные - (90%) Двуядрышковые - |
Гипохромные нейроны - (43,4%) - 1,63±0,16 Гиперхромные - (43,4%) Двуядрышковые - (13,2%) - 1,26±0,10 |
Примечание: *- при (p<0.05), # - при (p>0.05). За контроль принимали гр. интактных животных. В группе «иФДЭ-5+ИГМ» - гр. крыс с четырехсосудистой ИГМ.
Таблица 2
Морфометрическая характеристика нейронов гиппокампа крыс (М±m; n=30)
|
Параметры |
Интактные |
2-сосудистая ИГМ |
4-сосудистая ИГМ |
иФДЭ-5+ИГМ |
|
Маx D |
11,85±0,29 |
13,64±0,16* |
11,38±0,16# |
8,49±0,21* |
|
Min D |
8,03±0,28 |
6,90±0,20* |
6,34±0,20* |
5,70±0,78* |
|
Периметр клетки |
33,01±0,80 |
37,22±0,34* |
30,40±0,34* |
24,30±2,30* |
|
S клетки |
68,90±2,63 |
77,14±2,63* |
57,71±1,76* |
38,94±0,81* |
|
Периметр ядра |
22,66±0,72 |
27,11±0,47* |
20,86±0,47* |
17,31±1,28* |
|
S ядра |
38,06±2,50 |
50,41±1,25* |
29,96±1,25* |
20,98±0,26* |
|
D ядра |
6,23±0,26 |
6,47±0,25# |
7,09±0,25* |
5,56±0,07* |
|
D ядрышка |
2,38±0,07 |
Гипохромные нейроны - Гиперхромные - (86,7%) Двуядрышковые- (13,3%) -2,03±0,11 |
Гипохромные нейроны - Гиперхромные - (90%) Двуядрышковые - (10%) - 1,83±0,23 |
Гипохромные нейроны - Гиперхромные - (90%) Двуядрышковые- (10%) - 1,83±0,23 |
Примечание: * - при (p<0.05), # - при (p>0.05). За контроль принимали гр. интактных животных. В группе «иФДЭ-5+ИГМ» - гр. крыс с четырехсосудистой ИГМ.
Качественные изменения характеризовались увеличением количества гиперхромных нейронов, хроматолизом, умеренной дезорганизацией слоев в области СА1. Тела клеток теряли чёткость контуров, деформировались. Ядерные изменения были полиморфными и проявлялись как набуханием, так и пикнозом отдельных ядер. В некоторых нейронах наблюдалось смещение ядра на периферию перикариона. Увеличение количества двуядрышковых нейронов в сочетании с общим увеличением площади ядра и перикариона является морфологическим проявлением регенераторных процессов и повышением их функциональной активности, возникающих в ответ на локальную ишемию головного мозга (рис. 2).
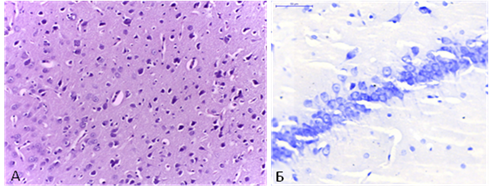
Рис. 2. Двухсосудистая модель ишемии головного мозга: А - лобная доля, окр. гематоксилин+эозин; Б – СА1 область гиппокампа, окр. тионином по Нисслю, X 400
При четырёхсосудистой модели ишемии отмечалась выраженная гиперхромия нейронов лобной доли с периваскулярным и перицеллюлярным отёком. Форма клеток была, преимущественно, многоугольной, вытянутой, ядра во многих из них не определялись. Капилляры паретически расширены, полнокровны. В области СА1 гиппокампа наблюдалась дезорганизация нейрональных слоев, хроматолиз, набухание и пикнотические изменения ядер, двуядрышковые нейроны практически не определялись (рис. 3).
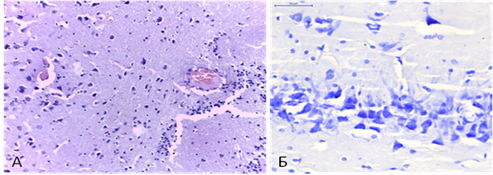
Рис. 3. Четырёхсосудистая модель ишемии головного мозга: А - лобная доля, X 400, окр. гематоксилин+эозин; Б – СА1 область гиппокампа, X 400, окр. тионином по Нисслю
При введении тадалафила в дозе 1 мг/кг за час до моделирования четырехсосудистой патологии морфологические изменения нейронов носили преимущественно некробиотический характер. Количество погибших нейронов было значительно ниже, чем без коррекции тадалафилом. В гиппокампе нарушение стратификации слоев носило умеренный характер (рис. 4).
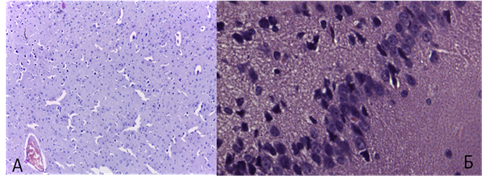
Рис. 4. Четырёхсосудистая модель ишемии головного мозга при коррекции тадалафилом:
А - лобная доля, X 100, окр. гематоксилин+эозин;
Б – гиппокамп, X 400, окр. гематоксилин+эозин
Выводы. При статистическом исследовании установлено, что ишемическое повреждение нейронов и лобной доли, и гиппокампа достоверно более выражено в группе с четырёхсосудистой моделью ишемии мозга без коррекции тадалафилом. Достоверно отличались минимальный диаметр, периметр и площадь нейронов, диаметр, периметр и площадь ядер (p<0.05). Количество двуядрышковых нейронов достоверно больше при коррекции тадалафилом (p<0.05), что отражает функциональное состояние нейронов, их большую активность и способность к регенеративным и репаративным процессам. Достоверных отличий не обнаружено при измерении максимального диаметра ядер нейронов (p>0.05).
В настоящее время выполнен ряд научных исследований, где показывается эффективность использования ингибиторов ФДЭ-5 для профилактики, а также сокращения объема повреждений при ишемических повреждениях органов. Гипотетический механизм церебропротективного действия тадалафила, как иФДЭ-5, заключается в воздействии на путь NO- цГМФ- протеинкиназы G. При активизации ПК-G происходит фосфорилирование К+ каналов, снижение чувствительности мембраны по отношению к нервным импульсам и её гиперполяризация. Далее происходит снижение концентрации свободного Ca+2 цитоплазмы. Эти механизмы являются основой вазодилатирующих эффектов оксида азота. Главную роль в этом механизме играет фосфодиэстераза-5. Именно она уменьшает накопление цГМФ.
Таким образом, при двухсосудистой модели ишемии головного мозга крыс отмечались умеренные некробиотические изменения с признаками активации регенераторных процессов как в нейронах лобной доли, так и гиппокампа. При четырехсосудистой модели ишемии повреждения большинства нейронов были необратимы, без признаков активации репаративных процессов. Коррекция ишемического повреждения тадалафилом показала статистически достоверное повышение устойчивости нейронов лобной доли и СА1 области гиппокампа к гипоксии и ишемии, достоверное снижение количества погибших нейронов и большую активность репаративных процессов.
Библиографическая ссылка
Мартынова О.В., Тверской А.В., Покровский М.В., Мартынов М.А., Шкилева И.Ю., Шелякина Е.В., Анциферов О.В., Мухина Т.С. МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ НЕЙРОНОВ ГОЛОВНОГО МОЗГА КРЫС ПРИ ДВУХ-, ЧЕТЫРЁХСОСУДИСТОЙ МОДЕЛЯХ ИШЕМИЧЕСКОГО ПОВРЕЖДЕНИЯ ГОЛОВНОГО МОЗГА КРЫС И ИХ КОРРЕКЦИЯ ТАДАЛАФИЛОМ В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25953 (дата обращения: 18.11.2025).



