Лечение термических поражений до настоящего времени остается одной из наиболее сложных проблем, имеющих не только медицинскую, но и социально-экономическую значимость. Это связано с существенным удельным весом такого рода травм среди всех остальных видов повреждений (4.1-4.5%), высокими показателями летальности и инвалидизации, а также со значительными финансовыми затратами здравоохранения на проведение лечения и реабилитации пострадавших. Разнообразие медицинских препаратов на фармацевтическом рынке ставит врача-комбустиолога перед необходимостью подбора наиболее эффективных лекарственных средств в каждом конкретном случае, и этот выбор должен основываться как на знании свойств препаратов, так и на оценке особенностей течения раневого процесса.
В настоящее время арсенал ранозаживляющих препаратов и перевязочных средств заметно расширился за счет фармацевтической продукции, имеющей в своем составе аминополисахарид хитозан (ХТЗ, 2-амино-2-дезокси-β-D-глюкан) [1; 8]. Этот уникальный полимер и его производные обладают не только ранозаживляющей, противовоспалительной и иммунотропной активностями, но и сильным биоцидным действием, что является крайне важным, поскольку раневая поверхность нуждается в антимикробной терапии с момента возникновения раны и до полного ее закрытия [9].
Показано, что более высокую биологическую активность проявляют водорастворимые соли ХТЗ, которые нередко используются в медицинских целях в виде гидрогелей, стабилизированных сеткой ковалентных и физико-химических связей (ионных, водородных) и гидрофобных взаимодействий [7; 10]. В ряде отечественных и зарубежных публикаций сообщается о хороших ранозаживляющих и противовоспалительных свойствах гидрогелей на основе аскорбата ХТЗ - соли ХТЗ и аскорбиновой кислоты (АК) [2]. В данном случае выбор АК в качестве органического лиганда в составе данной соли обусловлен, прежде всего, ее важностью для нормального развития репаративных процессов за счет стимуляции синтеза коллагена и пролиферации фибробластов.
Тем не менее хотелось бы отметить, что при конструировании новых препаратов, в том числе ранозаживляющих, следует учитывать существование тесной взаимосвязи между пространственной структурой веществ и их фармакологической активностью [6]. Известны случаи, когда только один из стереоизомеров лекарственного средства оказывает требуемое терапевтическое действие, а его хиральный антипод проявляет более слабую биологическую активность или вызывает нежелательные побочные эффекты. Бывает также, что каждый из стереоизомеров обладает своим специфическим действием. Так, например, у антигельминтного препарата левамизола активен исключительно S-стереоизомер, тогда как R-стереоизомер вызывает тошноту.
Соль аскорбата ХТЗ образована двумя оптически активными химическими соединениями: ХТЗ проявляет оптическую активность вследствие наличия асимметрично замещенных атомов углерода в глюкопиранозных циклах макромолекул, а асимметрический атом углерода в фурановом кольце молекулы АК обусловливает существование двух оптических диастереомеров, называемых L- и D-изоформами. И если L-АК (витамин С) отличается высокой биологической активностью, то в отношении D-изоформы имеется ряд сообщений о ее слабых коллагенстимулирующих свойствах. При промышленном синтезе АК получается, как правило, смесь ее L- и D-стереоизоформ в разных соотношениях, поэтому препараты, содержащие искусственно полученную АК, могут существенно различаться своими фармакокинетическими и фармакодинамическими свойствами, что не может не отразиться на эффективности проводимого лечения. В литературе отсутствуют какие-либо сведения о влиянии знака вращения хирального органического лиганда на биологические свойства его соли с ХТЗ. В связи с этим целью данного исследования явилась сравнительная оценка ранозаживляющей активности препаратов на основе L- и D-аскорбатов ХТЗ.
Материалы и методы исследования
Объектами исследования служили гидрогели на основе L- и D-аскорбатов АК, предоставленные специалистами отдела ВМС ОНИ НС и БС при ФГБОУ ВО «Саратовский национальный исследовательский государственный университет имени Н.Г. Чернышевского», г. Саратов. В качестве исходных субстанций были использованы L- и D-стереоизоформы аскорбиновой кислоты (C6H8O6) производства ООО «Люми» (г. Санкт-Петербург) и ЗАО «Вектон» (г. Санкт-Петербург), соответственно, аналитической степени чистоты, а также порошок водорастворимого ХТЗ со средневязкостной молекулярной массой 32 кДа и степенью деацетилирования 70 мольн.% (ЗАО «Биопрогресс», г. Щелково). Навески ХТЗ предварительно стерилизовали в ламинарном боксе NUAIRE Biological Safeti Cabinets (Франция) в течение 15 мин. Гидрогели аскорбатов ХТЗ (ХТЗ·L-АК и ХТЗ·D-АК) готовили порционным смешиванием твердой навески ХТЗ с 9%-ными водными растворами L- или D-АК в количестве, обеспечивающем мольное соотношение ХТЗ : АК = 1 : 0.6. Для приготовления растворов использовали дистиллированную воду, дегазированную от CO2 и О2 кипячением при 100 °С в течение 1 ч.
В качестве животной модели использовали половозрелых беспородных крыс-самок с массой тела 220-250 г. Животных содержали по одной особи в клетке в стандартных условиях вивария с контролируемым режимом температуры (+24 °С) и освещения (в течение 12 ч) и свободным доступом к воде и пище. При работе с экспериментальными животными руководствовались приказом Минздрава СССР № 755 от 12.08.1977 г. и требованиями Европейской конвенции по защите лабораторных животных. Все болезненные для крыс манипуляции выполняли под эфирным наркозом в условиях асептики.
Термические ожоги IIIБ степени воспроизводили контактным высокотемпературным способом в межлопаточной области крыс в проекции шейно-грудного отдела [3]. С этой целью участок кожи животных депилировали и наносили термическую травму путем прикладывания на 14 сек разогретой до +240 °С медной пластины (площадь поверхности – 225 мм2) с силой 1.6 н. На 3-и сутки сформировавшийся струп и патологически измененные ткани удаляли методом острой некрэктомии, при этом средняя площадь поверхности сочетанной раны составляла 304.2 ± 4.7 мм2.
Далее крыс делили на три группы: контрольную (5 крыс) и две опытные (по 6 крыс). В контрольной группе животных лечили препаратом «Левомеколь-вет» (ООО НПП «Агрофарм», РФ) в соответствии с инструкцией по применению, нанося мазь тонким слоем на пораженную поверхность 1 раз в сутки ежедневно до выздоровления. Животным из экспериментальных групп на обнаженную раневую поверхность однократно наносили гидрогель ХТЗ·L-АК (группа № 1) или ХТЗ·D-АК (группа № 2) (рис. 1). Раневая поверхность не изолировалась от внешней среды, и заживление проходило под струпом.
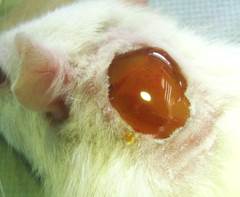
Рис. 1. Нанесение гидрогеля ХТЗ·D-АК на поверхность ожоговой раны после острой некрэктомии
Оценку динамики заживления осуществляли планиметрическими методами. Сразу после некрэктомии и потом через каждые 3 суток на рану накладывали пластинку стерилизованного в автоклаве плотного целлофана с разметкой в виде квадратов (длина стороны ячейки - 2.5 мм), фломастером обводили контур раны или фотографировали.
Абсолютную площадь (S, мм2) поверхностного дефекта кожи рассчитывали по формуле (1), предложенной Ф.Я. Божиновой [5]:
![]() (1)
(1)
где n - количество квадратов размером 2.5 × 2.5 мм², полностью находящихся в пределах контура раны; k - количество квадратов размером 2.5 × 2.5 мм², частично находящихся в пределах контура раны; С - площадь одного квадрата размером 2.5 × 2.5 мм².
Относительную убыль площади поверхности раны (ΔS, %) вычисляли по формуле (2):
![]() (2)
(2)
где Sо - площадь раневой поверхности при предшествующем измерении; St - площадь раневой поверхности через промежуток времени t.
Величину периметра раны (Р, мм) определяли с помощью курвиметра по обведенному контуру на целлофановой пластине. Среднюю линейную скорость заживления ожоговой раны (v, мм2/сут) вычисляли по формуле (3) [4]:
![]() (3)
(3)
где Pо и Sо - периметр и площадь раневой поверхности при предшествующем измерении; Pt и St - периметр и площадь раневой поверхности через промежуток времени t.
Статистическую обработку полученных данных осуществляли с помощью методов непараметрического анализа с использованием пакетов прикладных программ Statistica 8.0 for Windows (StatSoft-Russia) и Microsoft Office Excel 2007. Количественные показатели представлены в виде M ± m, где M – среднеарифметическое значение, а m – стандартная ошибка среднеарифметического значения. Критический уровень значимости - p < 0.05.
Результаты исследования и их обсуждение
Общий срок заживления открытой раны определяется скоростью течения репаративно-регенеративного процесса, направленного на постепенное уменьшение раневой поверхности вплоть до ее полного закрытия. В связи с этим об эффективности ранозаживляющего действия того или иного препарата можно судить по темпам убыли площади поверхности раны [3-5]. В клинической практике для объективизации оценки темпов заживления поверхностных дефектов используют планиметрические методы, которые, как правило, включают замер контура раны через определенные промежутки времени и вычисление на основе полученных данных процента сокращения площади раневой поверхности за единицу времени.
На рисунке 2 представлены графики, отражающие результаты планиметрии ожоговых ран у крыс в динамике лечения с помощью гидрогелей ХТЗ·L-АК и ХТЗ·D-АК и препарата «Левомеколь-вет».
Как видно из рисунка 2, на двух участках графиков - с 1-х по 3-и сутки и с 3-х по 21-е сутки - зависимость средних величин площади поверхности ран S от времени t близка к линейной; а на третьем участке – с 21-х по 39-е сутки - кривая S(t) сильно выполаживается. Наиболее высокими темпами уменьшение абсолютных значений площади раневой поверхности шло в ранний период (с 1-х по 3-и сутки) у крыс из экспериментальных групп № 1 и № 2. Динамика сокращения площади ран под гидрогелем ХТЗ·D-АК была выше во все сроки наблюдения.
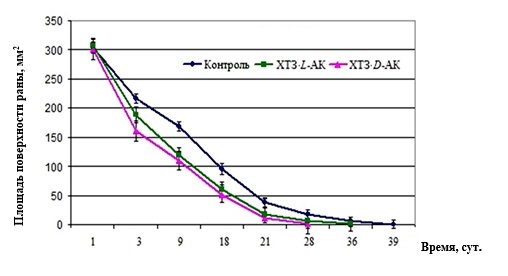
Рис. 2. Динамика изменения средних величин площади поверхности ожоговой раны (S, мм2) у крыс на фоне применения гидрогелей ХТЗ·L-АК и ХТЗ·D-АК и препарата «Левомеколь-вет» (контроль)
Однако данный планиметрический метод не принимает во внимание тот факт, что заживление плоскостных ран происходит по периметру, а, как известно, раны с равной площадью поверхности могут иметь разные периметры, и при одинаковой скорости регенераторных процессов темпы убыли площади раневой поверхности будут выше у ран с бóльшим периметром. Более того, при условии равенства скоростей регенераторных процессов отношение величины периметра раны к ее площади будет разным у ран с различными размерами, так как при уменьшении размеров раны ее периметр уменьшается линейно, а площадь квадратично [4].
Учитывая вышеизложенное, у подопытных крыс в динамике лечения были определены периметры ран и рассчитаны средние линейные скорости заживления (v, мм2/сут) методом, предложенным Е.Ю. Осинцевым и А.Б. Слободским (1998) [4]. По данным, приведенным в таблице, в период с 1-х по 3-и сутки после некрэктомии убыль площади раневой поверхности и скорость заживления ран у крыс из экспериментальных групп № 1 и № 2 была статистически значимо выше по сравнению с аналогичными показателями в контроле. В группе № 2 (ХТЗ·D-АК) убыль величины S была максимальной (15.5% в сутки) и статистически значимо превышала аналогичные показатели в контроле (9.7%) и в группе № 1 (12.9%).
К концу 2-х суток у крыс из контрольной группы на поверхности раны образовалась плотная корочка из форменных элементов свернувшейся крови, высохшего экссудата, лимфы, фибрина и др. (рис. 3). У крыс из опытных групп в формировании раневой корочки принимали участие также затвердевшие хитозановые гели. В связи с этим начиная с 3-х суток во всех группах животных ожоговые раны заживали под струпом, и об изменении площади раневой поверхности можно было судить только по сокращению размеров раневой корочки в результате ее подсыхания и частичной резорбции. Это объясняет, почему убыль площади поверхности ран у всех крыс в данный период времени шла близкими темпами – со средней линейной скоростью 0.3 мм2/сут (таблица). Скорость эпителизации раны можно было установить лишь при условии иссечения струпа, однако это не предполагалось условиями данного эксперимента.
Убыль площади раневой поверхности (ΔS, %) и средняя линейная скорость заживления
(v, мм2/сут) ожоговой раны у крыс после некрэктомии в различные сроки наблюдения
|
Группы |
Период наблюдения |
|||||
|
с 1-х по 3-и сут |
с 3-х по 21-е сут |
с 21-х по 28-е сут |
||||
|
ΔS, % |
v, мм2/сут |
ΔS, % |
v, мм2/сут |
ΔS, % |
v, мм2/сут |
|
|
Контроль |
9.7 |
0.5 |
4.7 |
0.3 |
8.7 |
0.1 |
|
Группа № 1 (ХТЗ·L-АК) |
12.9* |
0.7* |
5.0 |
0.3 |
8.3 |
0.1 |
|
Группа № 2 (ХТЗ·D-АК) |
15.5*,# |
0.8*,# |
5.2 |
0.3 |
14.3*,# |
0.2*,# |
|
Примечание: (*) – статистически значимое различие с аналогичным показателем в контрольной группе (U-критерий Манна-Уитни, р ≤ 0.05); (#) - статистически значимое различие с аналогичным показателем в группе № 1 (U-критерий Манна-Уитни, р ≤ 0.05). |
||||||
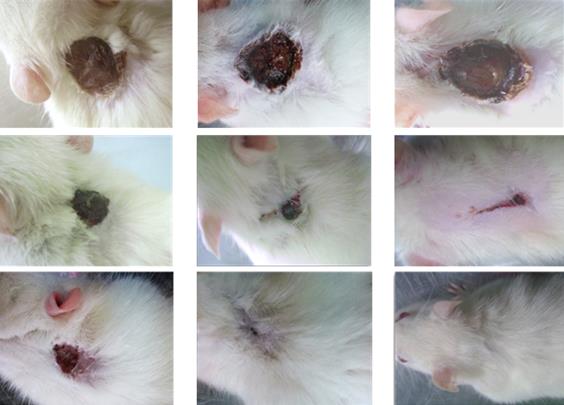
Во всех группах крыс отторжение раневой корочки и полное очищение поверхности ран завершалось к 21-м суткам. Это позволило установить, что средняя линейная скорость заживления в результате эпителизации и рубцевания ран в период с 21-х по 28-е сутки была в 2 раза выше в группе № 2 по сравнению с аналогичными показателями в двух других группах (таблица). Средний срок заживления раны в контрольной группе составил 39 ± 9.6 суток, в группе № 1 - 36 ± 10.4 суток, а в группе № 2 - 29 ± 8.5 суток.
Заключение
Проведенные исследования показали, что крысы хорошо переносят местное применение гидрогелей на основе L- и D-аскорбатов ХТЗ. Присутствие препаратов на ране не оказывает раздражающего и токсического действия, не вызывает аллергические или какие-либо иные отрицательные реакции у подопытных животных. За весь период наблюдения не было отмечено ни одного случая нагноения раны или осложненного течения раневого процесса. При выполнении планиметрии было установлено, что заживление ожога IIIБ степени у крыс протекает более высокими темпами на фоне применения аскорбатов ХТЗ по сравнению с группой контроля, в которой животных лечили препаратом «Левомеколь-вет». Причем наиболее высокие темпы репаративно-регенеративных процессов в группах крыс № 1 и № 2 отмечались в ранние сроки сразу после проведения острой некрэктомии. По всей видимости, это связано со способностью молекул ХТЗ вызывать быстрое купирование воспалительных процессов в поврежденных тканях за счет альтернативной активации тканевых макрофагов и подавления продукции медиаторов воспаления (ФНОα, ИЛ-8 и др.) [2; 11].
|
Контроль |
Группа №1 (ХТЗ·L-АК) |
Группа №2 (ХТЗ·D-АК) |
|
|
9-е сут |
|
||
|
18-е сут |
|||
|
28-е сут |
|||
Рис. 3. Динамика заживления ожоговых ран IIIБ степени у крыс на фоне лечения препаратом «Левомеколь-вет» (контроль) и гидрогелями
ХТЗ·L-АК (Группа № 1) и ХТЗ·D-АК (Группа № 2)
Кроме того, как недавно было показано, фибробласты при непосредственном контакте с ХТЗ начинают в высоких концентрациях синтезировать такие ангиогенные факторы, как VEGF и GM-CSF, что необходимо для инициации процессов неоваскуляризации и ангиогенеза [11]. Быстрый переход воспалительного процесса в пролиферативную фазу и восстановление микроциркуляторного русла являются определяющими для обеспечения скорейшего заживления раны и восстановления целостности кожного покрова.
По имеющимся в научной литературе немногочисленным данным, известно, что D-АК значительно уступает L-АК по способности стимулировать синтез коллагена и пролиферацию фибробластов [12]. Однако в наших экспериментах было установлено, что использование D-АК в качестве органического лиганда в составе соли с ХТЗ обеспечивало гидрогелю ХТЗ·D-АК более высокую ранозаживляющую активность. Так, сроки заживления ран под гидрогелем D-аскорбата ХТЗ были на 10 суток короче, чем в контроле, и на 7 суток короче, чем под гидрогелем L-аскорбата ХТЗ, а средняя линейная скорость заживления раны и темпы убыли площади раневой поверхности были статистически значимо выше, чем при использовании гидрогеля L-аскорбата ХТЗ. Молекулярные механизмы наблюдаемого явления еще предстоит установить. Тем не менее уже сейчас становится очевидным, что стереоизомеры АК, взаимодействуя с хиральными молекулами на поверхности клеток, могут оказывать разное по силе воздействие.
Выражаем глубокую благодарность Российскому фонду фундаментальных исследований и Министерству высшего образования и науки Ирака за оказанную материальную поддержку первому автору при выполнении данной работы.
Библиографическая ссылка
Аль Зубейди А.Ф., Малинкина О.Н., Зудина И.В., Ковалева Я.О., Ксенофонтова О.Ю., Островский Н.В. ОЦЕНКА РАНОЗАЖИВЛЯЮЩЕЙ АКТИВНОСТИ L- И D-ИЗОФОРМ АСКОРБИНОВОЙ КИСЛОТЫ И ИХ СОЛЕЙ С ХИТОЗАНОМ НА МОДЕЛИ ОЖОГОВОЙ РАНЫ У КРЫС // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25942 (дата обращения: 23.01.2026).