Проблеме ремоделирования миокарда уделяется большое внимание. Одним из вариантов ремоделирования миокарда считают гипертрофию желудочков, развивающуюся в ответ на повышение артериального давления [4]. Крысы являются наиболее предпочтительными моделями для изучения механизмов развития гипертензии. Крысы линии НИСАГ, выведенные путем селекции в Институте цитологии и генетики Сибирского отделения РАН, являются адекватной экспериментальной моделью наследственно обусловленной стресс чувствительной артериальной гипертензии [2]. У крыс линии НИСАГ гипертрофия левого желудочка выявляется на ранних стадиях постнатального онтогенеза [7, 9], у крыс линии Вистар она развивается после 18-ти месяцев постнатальной жизни [13]. В возрасте 12-ти месяцев крысы линии НИСАГ имеют физиологические признаки глубокой старости [1].
Показана низкая чувствительность стандартных электрокардиографических критериев при выявлении гипертрофии левого желудочка у пациентов с артериальной гипертензией [15]. Картирование кардиопотенциалов на поверхности тела является неинвазивным и более информативным методом выявления сердечно-сосудистых заболеваний, чем традиционная электрокардиография [6], позволяющим выявить изменения электрической активности сердца в динамике развития артериальной гипертензии [8, 10].
Цель исследования – анализ пространственно-временных параметров электрического поля сердца (ЭПС) на поверхности тела в период деполяризации желудочков у 12-ти месячных крыс нормотензивной линии Вистар и гипертензивнойлинии НИСАГ.
Материал и методы исследования
Методом синхронной многоканальной кардиоэлектротопографии исследованы пространственно-временные параметры ЭПС на поверхности тела 12-ти месячных нормотензивных самцов крыс линии Вистар (n=10) и гипертензивных линии НИСАГ (n=10) в период деполяризации желудочков. Крыс наркотизировали золетилом (3,5 мг/100 г веса в/м). Массу тела измеряли при помощи весов лабораторных (ACOMJW-1, точность 0,05 г, Южная Корея).
Систолическое артериальное давление измеряли непрямым методом в хвостовой артерии устройством для неинвазивной регистрации (СДК-1, Санкт-Петербург). Регистрацию кардиопотенциалов осуществляли от 64 подкожных игольчатых электродов, равномерно распределенных вокруг туловища животного от уровня основания ушей до последнего ребра. Синхронно с униполярными ЭКГ от поверхностных электродов регистрировали ЭКГ в отведениях от конечностей. Анализ пространственно-временных параметров ЭПС производили по эквипотенциальным моментным картам. Отсчет времени (в мс) осуществляли относительно RII-пика на ЭКГ во втором отведении от конечностей, до RII-пика время указывали со знаком минус.
Статистическую обработку вариационных рядов и проверку их на нормальность распределения проводили пакетом Statistica 10.0. Данные представлены в виде среднее арифметическое ± стандартное отклонение. Достоверность оценивали критерием Стьюдента для двух независимых выборок. Значения считали значимыми при р<0,05.
Результаты исследования и их обсуждение
Масса тела 12-месячных животных разных линий достоверно не отличалась: составляла 285,27±27,64 г у крыс линии Вистар и 310,21±15,95 г у крыс линии НИСАГ. Показано достоверно большеесистолическое давление у крыс линии НИСАГ - 189±19 мм рт. ст. по сравнению с крысами линии Вистар – 148±20 мм рт. ст.
ЭПС на поверхности тела 12-ти месячных крыс линии Вистар в период деполяризации желудочков формируется за 10–11 мс, у крыс линии НИСАГ достоверно раньше (за 13–14 мс) до пика зубца RII, при этом зона положительных кардиопотенциалов располагается краниально, отрицательных – каудально у всех обследованных животных. В период восходящей фазы зубца RII происходит смещение положительной и отрицательной зон кардиопотенциалов, что приводит к изменению их взаимного расположения – первой инверсии, в результате которой зона положительных кардиопотенциалов занимает каудальную часть вентральной поверхности грудной клетки, отрицательная – краниальную часть вентральной и всю дорсальную поверхности. У 12-ти месячных крыс линии НИСАГ по сравнению с крысами линии Вистар первая инверсия завершается за достоверно большее время (-6,2±0,6 мс и -4,9±0,7 мс соответственно). В период максимальной желудочковой активности, соответствующей RII пику, отрицательный экстремум расположен на ЭПС у нормотензивных животных каудально в области левого плеча, у гипертензивных – вентролатерально. Второе смещение зон кардиопотенциалов завершается на восходящей фазе зубца SII. В результате второй инверсии у всех обследованных животных зона положительных потенциалов располагается в краниальной, отрицательных – в каудальной части грудной клетки. Через 1 мс у 12-ти месячных крыс линии Вистар и достоверно позже – через 2–3 мс у крыс линии НИСАГ после окончания второй инверсии процесс деполяризации завершается, что отражается нестабильным расположением зон кардиопотенциалов на поверности тела (рис. 1).
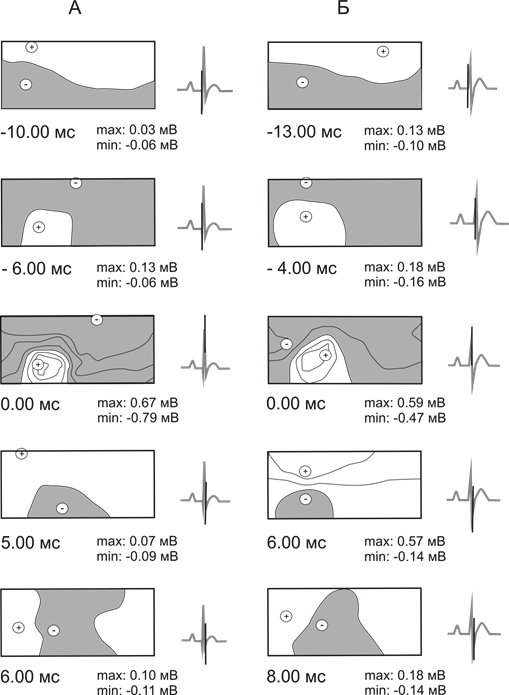
Рис. 1. Эквипотенциальные моментные карты на поверхности тела 12-ти месячных крыс линии Вистар (А) и НИСАГ (Б) в период деполяризации желудочков сердца
Примечание: Закрашена область отрицательных кардиоэлектрических потенциалов, не окрашена – положительных. Рядом с каждой картой приведена ЭКГII с отметкой времени и указаны амплитуды наибольших положительных (max) и отрицательных (min) кардиопотенциалов в соответствующий момент времени. Знаками “+” и “-” обозначено местоположение отрицательного и положительного экстремумов. Шаг изолиний составлял 0,2мВ. Левая половина каждой карты соответствует вентральной стороне тела, правая – дорсальной.
На основании пространственной динамики ЭПС на поверхности тела ранее было выделено три этапа деполяризации желудочков сердца: начальный – от момента формирования ЭПС до завершения первой инверсии взаимного расположения кардиоэлектрических потенциалов, средний – от завершения первой инверсии до окончания второй инверсиии конечный – от окончания второй инверсии до момента времени, когда на поверхности тела наблюдали нестабильное расположение зон положительного и отрицательного кардиоэлектрических потенциалов [5, 6]. Показана достоверно большая длительность начального, среднего и конечного этапа деполяризации желудочков у 12-ти месячных крыс линии НИСАГ, которая составляла 8,5±0,8 мс, 11,9±0,7 мс, 2,3±0,5 мс по сравнению с крысами линии Вистар той же возрастной группы (4,9±0,4 мс, 10,3±0,7 мс и 1,1±0,3 мс) соответственно. Общая длительность деполяризации желудочков достоверно больше у гипертензивных крыс (21±1 мс), чем у нормотензивных крыс - 16±1 мс (рис. 2).
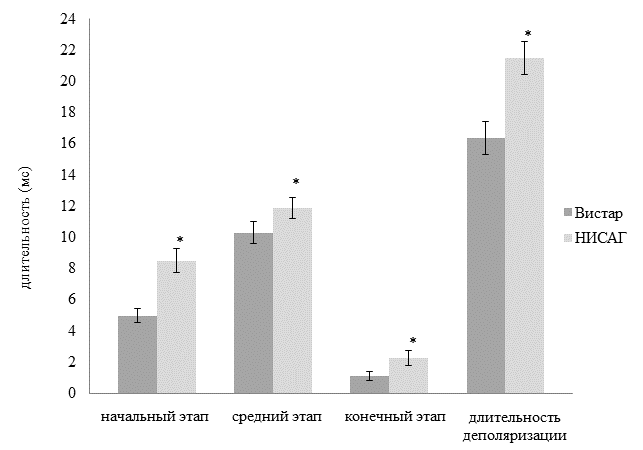
Рис. 2. Длительность начального, среднего и конечного этапов, общая длительность деполяризации желудочков сердца 12-ти месячных крыс линии Вистар и НИСАГ
Примечание: * – достоверно по сравнению с 12-ти месячными крысами линии Вистар (р?0,05).
Анализ пространственной динамики ЭПС на поверхности тела 12-ти месячных крыс линии НИСАГ показал, что траектории смещения зон положительных и отрицательных кардиопотенциалов сходны в период деполяризации желудочков, за исключением расположения отрицательного экстремума в период максимальной желудочковой активности. По-видимому, это связано со смещением сердца в грудной клетке и его электрической оси у крыс линии НИСАГ по сравнению с крысами линии Вистар [3].
Методом многоканальной синхронной кардиоэлектротопографии выявлено достоверно большая длительность деполяризации желудочков и составляющих ее этапов у гипертензивных крыс по сравнению с нормотензивными.
Начальный этап деполяризации соответствует прорыву волны возбуждения на субэпикард желудочков, в течение среднего этапа происходит возбуждение основной массы миокарда, конечный этап соответствует активации основания сердца [6]. На начальном этапе деполяризации желудочков сердца крыс волна возбуждения распространяется последовательно по проводящей системе Гис – Пуркинье до волокон рабочего миокарда. С возрастом происходит утончение волокон Пуркинье и уменьшение количества межклеточных контактов между проводящими и рабочими кардиомиоцитами, что приводит к снижению скорости проведения [12]. Увеличение длительности начального этапа деполяризации желудочков сердца у 12-ти месячных крыс линии НИСАГ может быть связано с морфологическими изменениями в системе волокон Пуркинье.
Увеличение длительности среднего и конечного этапов деполяризации желудочков у 12-ти месячных крыс линии НИСАГ, по-видимому, связано с гипертрофией миокардиальных волокон и фиброзом. Ранее показано, что у гипертензивных крыс линии SHR площадь поперечного сечения кардиомиоцитов увеличивается в период от 6 до 12 месяцев на 65 %, тогда как у нормотензивных крыс линии Вистар-Киото гипертрофия левого желудочка развивается только к 18 месяцам постнатального развития [13]. Гистологически выявлено увеличение интерстициальной соединительной ткани у 12-ти месячных крыс линии SHR по сравнению с крысами линии Вистар-Киото той же возрастной группы [11]. В гипертрофированном миокарде левого желудочка происходит задержка проведения возбуждения, связанная с изменениями электрического соединения между кардиомиоцитами и снижением анизотропии [14].
Заключение
Выявлено достоверно большее время деполяризации желудочков сердца у старых гипертензивных крыс линии НИСАГ по сравнению с крысами линии Вистар, связанное со структурным и электрическим ремоделированием миокарда, вызванным гипертензией и гипертрофией левого желудочка.
Работа выполнена при финансовой поддержке комплексной программы развития УрО РАН «Формирование электрической активности сердца при артериальной гипертензии в процессе старения» № 15-5-4-9.
Библиографическая ссылка
Суслонова О.В., Смирнова С.Л., Рощевская И.М. ПРОСТРАНСТВЕННО-ВРЕМЕННЫЕ ПАРАМЕТРЫ ЭЛЕКТРИЧЕСКОГО ПОЛЯ СЕРДЦА НА ПОВЕРХНОСТИ ТЕЛА 12-ТИ МЕСЯЧНЫХ КРЫС ЛИНИИ ВИСТАР И НИСАГ В ПЕРИОД ДЕПОЛЯРИЗАЦИИ ЖЕЛУДОЧКОВ // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25923 (дата обращения: 03.02.2026).



