Нарушения атриовентрикулярной и внутрижелудочковой проводимости представляют собой одну из важных проблем кардиологии. Прогрессирующее замедление атриовентрикулярной проводимости приводит к развитию полной блокады сердца, синкопальным состояниям и внезапной смерти. Замедление внутрижелудочковой проводимости способствует нарушению сокращения межжелудочковой перегородки, снижению глобальной сократимости миокарда, развитию систолической и диастолической дисфункции миокарда. Доказано, что наличие блокады правой или левой ножки пучка Гиса у пациентов с ишемической болезнью сердца является достоверным предиктором смертности [2, 8]. В большинстве случаев сердечно-сосудистые заболевания являются мультифакторными. Наиболее часто к замедлению сердечной проводимости приводят ишемическая болезнь сердца, артериальная гипертензия, ревматическая болезнь сердца, неревматический миокардит, кардиомиопатии, хроническая сердечная недостаточность, врожденные пороки сердца, системные заболевания [1, 10, 11]. Определенный вклад в развитие патологии проводящей системы сердца вносят аномалии белков, которые могут быть вызваны однонуклеотидными заменами в структуре кодирующих их генов [4]. В литературе последних лет имеется достаточно данных о влиянии полиморфизмов гена TBX5 на развитие и прогрессирование различных видов нарушений сердечной проводимости [7, 5], в том числе на продолжительность интервала PQ на ЭКГ, который отражает скорость АВ-проведения, а также на продолжительность интервала QRS (внутрижелудочковое проведение) у пациентов с синдромом Бругада [9]. Однако в доступной нам литературе отсутствуют данные о влиянии однонуклеотидных полиморфизмов гена TBX5 на развитие нарушений атриовентрикулярной и внутрижелудочковой проводимости у пациентов с ишемической болезнью сердца, проживающих в РФ.
Цель исследования: изучить роль однонуклеотидного полиморфизма rs3825214 гена TBX5 в развитии вторичных нарушений атриовентрикулярной и внутрижелудочковой проводимости у пациентов с ишемической болезнью сердца.
Материал и методы исследования
В исследовании приняли участие 157 пациентов с вторичными нарушениями сердечной проводимости (НСП), средний возраст 64,13±11,58 лет, из них 105 мужчин и 52 женщины. Все лица основной группы страдали ишемической болезнью сердца (ИБС), перенесли инфаркт миокарда с гемодинамически значимым атеросклеротическим поражением инфаркт-зависимой коронарной артерии, кровоснабжающей зону повреждения миокарда с соответствующими путями проведения импульса. Все обследованные пациенты по данным более ранних выписок из историй болезней и ЭКГ не имели патологии проводящей системы сердца, т.е. НСП имели ишемическую природу возникновения. Из 157 пациентов 40 имели атриовентрикулярную блокаду (АВБ) 1-й, 2-й или 3-й степени, 58 пациентов – нарушение проводимости по правой ножке пучка Гиса (ПБПНПГ (НБПНПГ)), 59 пациентов – нарушение проводимости по левой ножке пучка Гиса (ПБЛНПГ (БПВЛНПГ)). Всем пациентам основной группы в КГБУЗ КМКБ № 20 им. И.С. Берзона проведено клинико-инструментальное обследование, включающее объективный осмотр, лабораторные исследования (общий анализ крови, биохимический анализ крови, общий анализ мочи), электрокардиографию, эхокардиоскопию, коронароангиографию, холтеровское мониторирование ЭКГ – при наличии показаний.
Группа контроля представлена популяционной выборкой 159 жителей г. Новосибирска без каких-либо сердечно-сосудистых заболеваний, из них 105 мужчин и 54 женщины, обследованных в рамках исследования, проведенного на материале международного проекта HAPIEE. Средний возраст группы контроля 58,2±7,09 лет. Перечень обследований контрольной группы включал: регистрацию социально-демографических данных; клиническое обследование, стандартный опросник по курению; антропометрию; измерение артериального давления; исследование биохимических показателей сыворотки крови.
Генотипирование лиц основной и контрольной групп по полиморфизму rs3825214 гена TBX5 осуществлялось в ФГБУ «НИИ терапии и профилактической медицины СО РАМН» г. Новосибирска с помощью ПЦР в реальном времени в соответствии с протоколом фирмы-производителя (зонды TaqMan, Applied Biosystems, USA) на приборе StepOnePlus.
Статистическую обработку данных проводили с использованием пакета программ «Statistica 7.0». Качественные критерии представлены в виде процентных долей со стандартной ошибкой доли. Для определения статистической значимости отличий между качественными признаками применяли критерий хи-квадрат (χ2). Если ожидаемые частоты были менее 5, то использовался точный критерий Фишера. Наличие ассоциации аллелей и генотипов с риском возникновения заболевания определяли с помощью величины отношения шансов (ОШ). Для ОШ рассчитывали доверительный интервал при уровне значимости 95%.
Результаты исследования и их обсуждение
При анализе распределения частот генотипов и аллелей ОНП A>G (rs3825214) гена TBX5 среди больных с вторичными нарушениями сердечной проводимости и лиц контрольной группы статистически значимых различий выявлено не было. В то же время наблюдалось некоторое снижение числа носителей распространенного генотипа АА среди больных с вторичными НСП (57,7%±4,0) по сравнению с контрольной группой (64,2%±3,8). Гетерозиготный генотип AG преобладал в группе пациентов с вторичными НСП (34,0%±3,8) в сравнении с контролем (29,6%±3,6). Редкий гомозиготный генотип GG также чаще встречался среди больных с вторичными НСП (8,3%±2,2), чем среди здоровых лиц (6,3%±1,9).
Таким образом, в группе пациентов с вторичными нарушениями сердечной проводимости наблюдалась статистически незначимая тенденция к снижению числа носителей распространенного генотипа и увеличению числа носителей редкого генотипа гена TBX5 по сравнению с контролем.
В подгруппе женщин с вторичными НСП наблюдалась тенденция, характерная группе пациентов с вторичными НСП. Число носителей гомозиготного распространенного генотипа среди женщин с вторичными НСП было ниже (55,8%±6,9), чем среди женщин контрольной группы (70,4%±6,2). Носителей гетерозиготного генотипа среди женщин с вторичными НСП было больше (34,6%±6,6), чем в контрольной группе (27,8%±6,1). Редкий гомозиготный генотип чаще встречался у женщин с вторичными НСП (9,6%±4,1), чем в группе контроля (1,9%±1,8). Полученные различия в частотах генотипов не были статистически значимыми. Однако было установлено достоверное преобладание редкого аллеля G среди женщин с вторичными НСП (26,9%±4,3) по сравнению с группой контроля (15,7%±3,5, р=0,047). Распространенный аллель А реже встречался у женщин с НСП (73,1%± 4,3), чем у здоровых женщин (84,3%±3,5). Таким образом, аллель G гена TBX5 является генетическим предиктором развития вторичных нарушений сердечной проводимости у женщин.
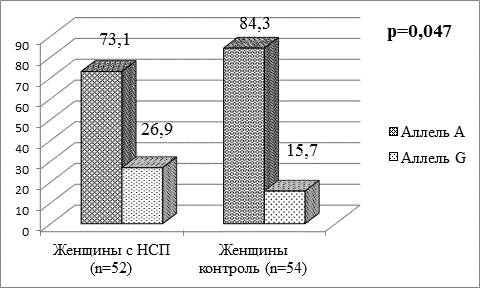
Рис. 1. Распределение частот аллелей ОНП A>G (rs3825214) гена TBX5 среди женщин с вторичными НСП и лиц контрольной группы
В подгруппе мужчин с вторичными НСП частота распространенного гомозиготного генотипа АА составила 58,7%±4,8, гетерозиготного генотипа AG – 33,7%±4,6, редкого гомозиготного генотипа GG – 7,7%±2,6. В группе контроля 55,2%±4,9 мужчин являлись носителями генотипа АА, 36,2%±4,7 – носителями генотипа AG, 8,6%±2,7 – носителями генотипа GG. Статистически значимых различий при сравнении частот генотипов и аллелей в данных подгруппах выявлено не было.
При анализе распределения частот генотипов и аллелей гена TBX5 у пациентов с вторичными нарушениями атриовентрикулярной проводимости и лиц контрольной группы были получены следующие результаты (табл. 1). Установлено статистически значимое снижение числа носителей гомозиготного генотипа AA по распространенному аллелю в группе больных с АВБ (40,0%±7,7) по сравнению с контрольной группой (64,2%±3,8, р=0,005). Гетерозиготный генотип AG достоверно чаще встречался в группе больных с вторичными АВБ (52,5%±7,9), чем среди здоровых лиц (29,6%±3,6, р=0,006). Носители гомозиготного генотипа GG по редкому аллелю преобладали среди пациентов с вторичными АВБ (7,5%±4,2) в сравнении с контролем (6,3%±1,9), но статистически значимо не различались (р>0,05). Распространенный аллель А также достоверно реже встречался среди больных с АВБ (66,3%± 5,3), чем у лиц контрольной группы (78,9%±2,3, р=0,017). Редкий аллель G, напротив, преобладал у пациентов с вторичными АВБ (33,8%±5,3) по сравнению с контролем (21,1%±2,3).
Таблица 1
Распределение частот генотипов и аллелей ОНП A>G (rs3825214) гена TBX5 среди больных с вторичными АВБ и лиц контрольной группы
|
Генотипы по ОНП гена TBX5 |
Вторичные АВБ (n=40) |
Контроль (n=159) |
р |
||||
|
абс |
% |
±m |
абс. |
% |
±m |
||
|
Генотипы |
|||||||
|
AA |
16 |
40,0 |
7,7 |
102 |
64,2 |
3,8 |
р=0,005 |
|
AG |
21 |
52,5 |
7,9 |
47 |
29,6 |
3,6 |
р=0,006 |
|
GG |
3 |
7,5 |
4,2 |
10 |
6,3 |
1,9 |
р=0,782* |
|
Аллели |
|||||||
|
Аллель A |
53 |
66,3 |
5,3 |
251 |
78,9 |
2,3 |
р=0,017 |
|
Аллель G |
27 |
33,8 |
5,3 |
67 |
21,1 |
2,3 |
р=0,017 |
|
ОШ A/G; 95%ДИ ОШ |
1,908; 1,117–3,262 |
||||||
|
Суммарные аллели |
|||||||
|
АА |
16 |
40,0 |
7,7 |
102 |
64,2 |
3,8 |
р=0,005 |
|
AG+GG |
24 |
60,0 |
7,7 |
57 |
35,8 |
3,8 |
р=0,005 |
|
ОШ; 95%ДИ ОШ |
2,702; 1,315-5,555 |
||||||
|
АА+AG |
37 |
92,5 |
4,2 |
149 |
93,7 |
1,9 |
р=0,782 |
|
GG |
3 |
7,5 |
4,2 |
10 |
6,3 |
1,9 |
р=0,782* |
|
ОШ; 95%ДИ ОШ |
0,826; 0,216–3,125 |
||||||
Примечание: р — уровень значимости при сравнении распределения генотипов с показателями группы контроля; р* — уровень значимости, достигнутый точным критерием Фишера.
На основании полученных результатов можно полагать, что генотип АА играет протективную роль в отношении развития нарушений атриовентрикулярной проводимости у пациентов с ишемической болезнью. Вероятность развития АВБ при наличии генотипа АА ОНП A>G (rs3825214) гена TBX5 снижается в 2,7 раз (рис. 2).
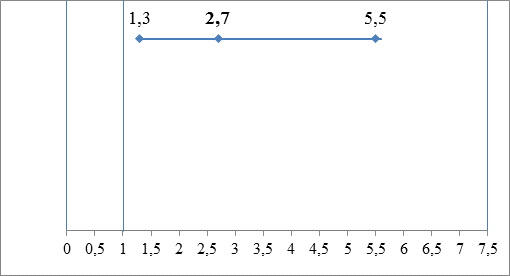
Рис. 2. Шанс отсутствия развития вторичных нарушений атриовентрикулярной проводимости (оцененный по отношению шансов) у носителей распространенного генотипа АА ОНП A>G (rs3825214) гена TBX5
В результате анализа распределения частот генотипов и аллелей ОНП A>G (rs3825214) гена TBX5 в группе пациентов с вторичным нарушением проводимости по правой ножке пучка Гиса и лиц контрольной группы не было выявлено статистически значимых различий. Число носителей распространенного генотипа AA в группе больных с вторичными ПБПНПГ (НБПНПГ) (65,5%±6,2) соответствовало числу носителей генотипа АА в контрольной группе (64,2%±3,8). Гетерозиготный генотип AG несколько реже встречался у пациентов с вторичными ПБПНПГ (НБПНПГ) (25,9%±5,7), чем в группе контроля (29,6%±3,6). Редкий гомозиготный генотип GG незначительно преобладал среди пациентов с вторичными ПБПНГПГ (НБПНПГ) (8,6%±3,7) в сравнении с контролем (6,3%±1,9).
Анализ распределения частот и аллелей ОНП A>G (rs3825214) гена TBX5 среди пациентов с вторичными нарушениями проводимости по левой ножке пучка Гиса также не выявил статистически значимых различий в сравниваемых группах. Однако отмечалось снижение числа носителей гомозиготного генотипа АА по распространенному аллелю среди пациентов с вторичными ПБЛНПГ (БПВЛНПГ) (62,1%±6,4) по сравнению с контрольной группой (64,2%±3,8). Частоты гетерозиготного генотипа были практически одинаковы в сравниваемых группах: 29,3%±6,0 в группе пациентов с вторичными ПБЛНПГ (БПВЛНПГ) и 29,6%±3,6 в группе контроля. Гомозиготный редкий генотип GG несколько чаще встречался у пациентов с вторичными ПБЛНПГ (БПВЛНПГ) (8,6%±3,7), чем среди здоровых лиц (6,3%±1,9).
Во всех подгруппах пациентов (с атриовентрикулярными блокадами, блокадами правой ножки пучка Гиса, блокадами левой ножки пучка Гиса) наблюдалась тенденция, характерная основной группе пациентов с вторичными нарушениями сердечной проводимости: увеличение числа носителей гомозиготного генотипа GG по редкому аллелю гена TBX 5 по сравнению с контрольной группой. Результаты не являются статистически значимыми, но соответствуют данным литературы по европейской, азиатской и афро-американской популяциям [6, 12], а также данным наших собственных исследований ОНП A>G (rs3825214) гена TBX5 у пациентов с идиопатическими нарушениями сердечной проводимости, опубликованным ранее [3].
Заключение
Нарушения сердечной проводимости являются мультифакторными заболеваниями, что подтверждают результаты представленного исследования. Несмотря на вторичную природу атриовентрикулярных и внутрижелудочковых блокад у пациентов с ишемической болезнью сердца, перенесших инфаркт миокарда, генотип пациента вносит определенный вклад в развитие указанных патологий. Наличие гомозиготного распространенного генотипа АА по ОНП A>G (rs3825214) гена TBX5 у пациентов с ИБС снижает вероятность развития нарушений атриовентрикулярной проводимости, а наличие аллеля G повышает риск развития вторичных нарушений сердечной проводимости у женщин. Кроме того, нельзя исключить, что редкий гомозиготный генотип GG по ОНП A>G (rs3825214) гена TBX5 повышает риск возникновения вторичных нарушений атриовентрикулярной и внутрижелудочковой проводимости. Отсутствие статистически значимых результатов в отношении редкого генотипа GG может быть обусловлено недостаточным количеством обследованных пациентов, в связи с этим необходимы дальнейшие исследования в данном направлении.
Библиографическая ссылка
Никулина С.Ю., Чернова А.А., Третьякова С.С., Максимов В.Н., Иванова А.А., Никулин Д.А. ГЕНЕТИЧЕСКАЯ ДЕТЕРМИНИРОВАННОСТЬ НАРУШЕНИЙ СЕРДЕЧНОЙ ПРОВОДИМОСТИ ПРИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25921 (дата обращения: 03.02.2026).



