Аллергические заболевания являются актуальной проблемой современной педиатрии и клинической медицины в целом, что связано со стремительным ростом частоты возникновения [13]. Так, согласно статистическим данным, их распространённость составляет 10-30% взрослого и 20-50% детского населения [10]. Это подтверждают многочисленные эпидемиологические исследования по бронхиальной астме, атопическому дерматиту, аллергическому риниту [7]. Острая аллергическая реакция по типу крапивницы и отека Квинке по частоте занимают 2 место после бронхиальной астмы [12]. Так, согласно статистическим данным, распространенность крапивницы составляет 1 - 5% в популяции, а в детском возрасте достигает 6% [4]. Наиболее частыми причинами ее возникновения являются инфекции, лекарственные средства, пищевые аллергены и укусы перепончатокрылых насекомых [2].
Неполное раскрытие механизмов развития крапивницы вызывает трудности в лечении больных с данным заболеванием. В настоящее время наиболее изучены механизмы иммунных реакций, лежащих в основе аллергического воспаления на фоне неблагополучия регуляторных процессов со стороны ЦНС и частых изменений со стороны ЖКТ [5].
В тоже время, другие факторы, участвующие в развитии крапивницы, изучены недостаточно.
Дисбаланс микро- и макроэлементов в организме детского населения Российской Федерации, причем как дефицитного, так и избыточного характера, в последние десятилетия является распространенным явлением и связан, в основном, с изменением рациона питания и экологической обстановки [3].
Отечественными учеными было доказано, что изменение баланса микроэлементов может влиять на развитие аллергических реакций вследствие нарушения окислительно-восстановительных процессов на клеточном уровне и изменения иммунного статуса [6]. Поэтому, в течение последних лет активно обсуждается влияние дисмикроэлементозов на здоровье детей [8, 14, 15]. Дефицит меди отрицательно сказывается на кроветворении, всасывании железа, состоянии соединительной ткани, предрасполагает к бронхиальной астме, аллергодерматозам, витилиго и другим заболеваниям. Повышенное содержание меди в организме отмечается при острых и хронических воспалительных заболеваниях, бронхиальной астме, заболеваниях почек, печени, в том числе у детей. Избыток меди приводит к дефициту цинка и молибдена [1]. Тяжесть течения атопического процесса и длительность заболевания сопровождались параллельным дефицитом селена и цинка в сыворотке крови и волосах [9]. В группе больных атопическим дерматитом наличие токсичных и избыток потенциально токсичных элементов выявлен в 62,5% случаев, в том числе Ni – 10%, а дефицит содержания эссенциальных элементов установлен у 92,5%, в том числе Zn – у 85%, S – у 72,5%, Ca и Fe у 70% [11] . Вместе с тем, данных о микроэлементом статусе детей и подростков с острой крапивницей крайне мало.
Целью данной работы являлось определение особенностей течения крапивницы у детей с нарушением микроэлементного состава организма.
Материалы и методы. Для достижения поставленной цели проведено обследование 40 детей с острой крапивницей на базе МБУЗ «Детская городская больница №2» г. Ростова-на-Дону и педиатрического отделения РостГМУ. Возраст обследуемых варьировал от 2 до 12 лет. Распределение по гендерному признаку было примерно одинаковым: мальчиков - 19, девочек - 21. Для контроля использовалась группа из 20 детей I и IIA групп здоровья.
Изучение микроэлементного статуса осуществлялось в пробах волос с затылочной части головы пациентов, методом рентгенофлуоресцентного анализа (РФА). Волосы были выбраны в качестве исследуемых биосубстратов вследствие способности к аккумулированию микроэлементов на протяжении времени их роста и, следовательно, отражению интегральной информации о содержании макро- и микроэлементов в организме за последние 2-3 месяца. Биосубстраты других видов (кровь, моча) активно участвуют в обмене веществ и зависят от питания, а следовательно подвержены колебаниям уровня минералов, отражая состояние организма в ограниченный промежуток времени. Кроме того, нами специально был выбран неинвазивный метод определения уровня микроэлементов в организме, в связи с его безболезненностью в применении к таким объектам исследования как дети.
Подготовку проб производили методом мокрого озоления. Навеску волос в 10 мг растворяли в азотистой кислоте в пропорции 1 мг на 10 мкл в течение 10 мин. Для ускорения процесса растворения пробирку с пробой выдерживали в муфельной печи при температуре 60 ºC в течение 15 мин. В 50 мкл раствора волос добавляли 10 мкл внутреннего стандарта ГСОРМ ионов ванадия с концентрацией 1 мг/см3, где ГСОРМ – государственный стандарт образцов растворимости материалов и 40 мкл бидистиллированной воды. Подготовленные пробы были нанесены на кварцевую подложку в виде 3 капель по 10 мг в поочередной последовательности. Для полного закрепления раствора на поверхности подложки подготовленные пробы помещали в печь до полного высыхания на 10 мин. Обзорные рентгенофлуоресцентные спектры для Kα- и Kβ-линий были зарегистрированы с помощью энергодисперсионного спектрометра AMPTEK (Германия) c молибденовым анодом. Спектры регистрировали в диапазоне энергий от 0 до 36,91 кэВ, что соответствует диапазону определяемых элементов от S до Zn. Экспозиция регистрации спектра в одной точке составляла 300 с [6].
Статистическая обработка данных проводилась с помощью набора прикладных программ STATISTICA 7.0.
Результаты и обсуждение. В ходе проведенного исследования, все пациенты были разделены на три группы на основании степени выраженности клинической симптоматики и распространенности кожных элементов. Для этой цели использовалась простая бальная система – UAS 7 (urticaria activity score 7), которая представляет собой суммарную бальную оценку основных симптомов заболевания самим пациентом каждые 24 часа за 7 последовательных днеи?: количество высыпании? (0 = отсутствие высыпаний, 1 = 1-19 волдырей, 2 = 20-50 волдыря, 3 = > 50 волдыреи?) и интенсивность зуда (0 = отсутствует, 1 = присутствует, но не причиняет беспокойство, 2 = беспокоит, но не влияет на дневную активность и сон, 3 = тяжёлый зуд, достаточно беспокоящий и нарушающий дневную активность и сон). Сумма баллов за сутки составляет 0 – 6 баллов. Степень тяжести определяется по индексу активности: 0 – 2 балла – легкая, 3 – 4 балла – среднетяжелая, 5 – 6 баллов – тяжелая.
Дети (8 человек), клинические проявления которых характеризовались локальным поражением кожи и отсутствием или слабовыраженным зудом (легкая форма крапивницы) составили I группу. Пациенты со среднетяжелой формой (II группа, 28 человек), отличались распространенным поражением кожи, более выраженным зудом (2 балла). В III группу вошли дети (4 человека) с тяжелым течением заболевания, у которых диагностировано генерализованное поражение кожи и выраженный зуд.
Анализируя триггерные факторы развития крапивницы, было отмечено, что у половины детей с легкой формой триггерным фактором явилась острая респираторная инфекция, в то время как у других – реакции на пищу (р < 0,05). У пациентов со среднетяжелой формой причинно-значимые факторы распределись следующим образом: 50% - пищевые продукты, 21,3% - лекарственные препараты, 28,7% - инфекции (р < 0,05). У всех больных с генерализованным поражением кожи тяжесть состояния была обусловлена воздействием пищевых аллергенов (р < 0,05).
Установлено, что наследственный аллергоанамнез был отягощен у 24 (60%) детей, при этом по материнской линии у 12, а по отцовский у 10 обследованных больных. Анализ анамнестических данных выявил, что 23 (57,5%) ребенка были рождены путем кесарева сечения. В ходе исследования, было определено, что лишь 12 (30%) пациентов на первом году жизни находились на естественном вскармливании, а 28 (70%) получали адаптированные молочные смеси с рождения или были переведены на искусственное вскармливание в возрасте до 3 месяцев. Хочется отметить, что несвоевременное введение прикорма отмечалось у всех обследованных детей.
Изучая данные анамнеза было выявлено, что у всех детей I группы ранее эпизодов крапивницы не наблюдалось, у 57,1% детей II группы также заболевание возникло впервые, в то время как пациенты III группы в 100% случаев отмечали развитие данной патологии в более раннем возрасте (p<0,001).
В ходе проведенного исследования было установлено (см. табл. 1), что у всех детей I группы уровень никеля (р=0,04) был ниже данных контрольной группы.
Таблица 1
Содержание микроэлементов в волосах детей с крапивницей (мкг/г)
|
|
S |
Ni |
Cu |
Cl |
|
I группа |
30712,08±17,66
|
57,02±2,98х
|
22,32±6,37
|
1207,1±5,43хх
|
|
II группа |
31953,9 ±13,29
|
45,23±6,47х, хх
|
34,39±3,88 |
1137,1±4,8 ххх
|
|
III группа |
32124,35± 20,51х
|
21,47±3,69ххх
|
24,63±3,64
|
681,31±3,72х
|
|
Контрольная группа |
24407,31±11,43 |
73,83±3,56
|
21,94±1,65 |
1316,67±9,75 |
р < 0,05, где х – от средних значений по региону; хх – между I и II группами; ххх – между II и III группами, хххх - между I и III группами.
У больных II группы дисмикроэлементоз так же, как и у детей с легкой формой крапивницы, характеризовался снижением никеля (р=0,03). Вместе с этим, отмечена разница между I и II группами в содержание таких микроэлементов, как никель (р=0,04) и хлор (р=0,02).
У всех пациентов с генерализованным поражением кожи и выраженным зудом зарегистрировано абсолютное снижение цинка (р=0,01) и хлора (р=0,03), а также повышение уровня серы (р=0,02) относительно контрольной группы. Необходимо отметить, что выявлены значимые различия между группой детей со средней степенью тяжести острой крапивницы и больных III группы по содержанию хлора (р=0,001) и никеля (р=0,02) .
В ходе проведенного исследования достоверного изменения уровня меди в волосах детей с острой крапивницей выявлено не было. Однако, согласно данным литературы, повышение содержания меди в организме предрасполагает к развитию аллергических болезней [1].
В ходе проведенного анализа, установлены однонаправленные тенденции снижения никеля и хлора в волосах пациентов в зависимости от тяжести процесса (см. рис.1 и 2).
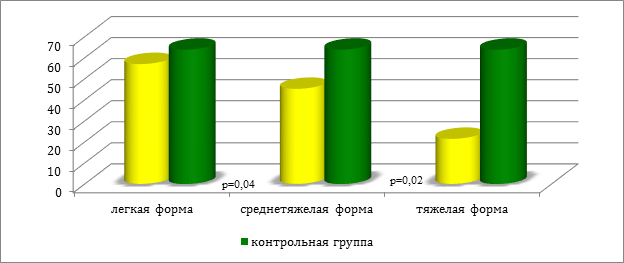
Рис. 1. Содержание никеля в волосах у пациентов в зависимости от степени тяжести крапивницы (мкг/г)
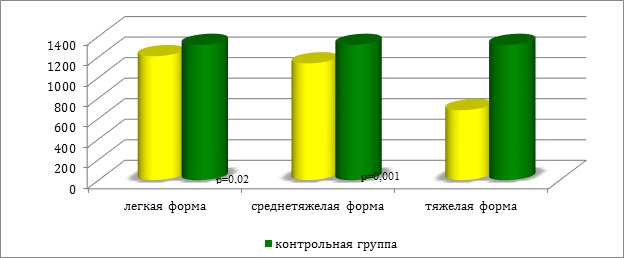
Рис. 2. Содержание хлора в волосах у пациентов в зависимости от степени тяжести крапивницы (мкг/г)
В результате исследования выявлено, что у всех детей с острой крапивницей в сочетании с отеком Квинке (30%) имеются сопутствующие аллергические заболевания, такие как бронхиальная астма (7,8%), атопический дерматит (17,3%), аллергический ринит (14%), пищевая (45,6%) и лекарственная аллергии (42,4%) [p<0,05].
Заключение. Таким образом, установлено, что у половины детей с легкой формой крапивницы триггерным фактором явилась острая респираторная инфекция, в то время как у других – реакции на пищу. У пациентов со среднетяжелой формой причинно-значимые факторы распределись следующим образом: 50% - пищевые продукты, 21,3% - лекарственные препараты, 28,7% - инфекции. У всех больных с генерализованным поражением кожи тяжесть состояния была обусловлена воздействием только пищевых аллергенов.
Было выявлено, что у всех детей с легкой и среднетяжелой формами крапивницы дисмикроэлементоз характеризуется абсолютным снижением содержания никеля. При генерализованном поражении кожи и выраженном зуде отмечается повышение уровня серы. Выявлено, что с увеличением степени тяжести крапивницы концентрация никеля и хлора снижается. В ходе проведенного исследования достоверного изменения уровня меди в волосах детей с острой крапивницей обнаружено не было. Выявленные особенности дисмикроэлементозов у детей с различной степенью тяжести крапивницы предопределяют их коррекцию в процессе терапии заболевания.
Библиографическая ссылка
Аверкина Л.А., Фуник А.О., Посевина А.Н., Мальцев С.В., Семерник О.Е., Яловега Г.Э., Лебеденко А.А. ОСОБЕННОСТИ ТЕЧЕНИЯ КРАПИВНИЦЫ У ДЕТЕЙ С НАРУШЕНИЕМ МИКРОЭЛЕМЕНТНОГО СОСТАВА ОРГАНИЗМА // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25893 (дата обращения: 05.01.2026).



