Повреждения хряща коленного сустава встречаются очень часто и не заживают самостоятельно. Считается, что у более половины пациентов, которым выполнялась артроскопия коленного сустава по поводу его повреждения, обнаруживается патология хряща разной степени выраженности, а повреждения 4 ст. по Оутербриджу встречаются у каждого 20 пациента младше 40 лет с травмой коленного сустава. Современные исследования позволяют констатировать факт увеличения площади хрящевых дефектов у пациентов с повреждением хряща и развития тяжелого артроза с течением времени. Конечно, эндопротезирование решает проблему полностью, но применимость метода у молодых пациентов вызывает споры в связи с недостаточно высокой выживаемостью современных конструкций. Так как сама возможность органотипичного восстановления суставного хряща на современном этапе развития медицины остается недоказанной, актуальность и значимость разработки и внедрения любых методов восполнения полнослойных дефектов хряща для возможности отсрочки эндопротезирования, не вызывают сомнений. Известно, что гиалиновый хрящ, локализуясь в хрящах носа, гортани, трахеи и бронхов, в реберных хрящах имеет схожее строение и отличается лишь соотношением хондроцитов и коллагеновых волокон [6,7,8].
Исходя из этого, мы предложили забирать хрящевой трансплантант из ребра в достаточном объёме с целью восполнения травматических дефектов хряща крупных суставов.
Цель исследования
Повышение эффективности лечения больных с посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствия дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, – к хрящевой части ребер.
Клинический материал и методы
В работе представлены результаты оперативного лечения 15 пациентов, в возрасте от 18 до 43 лет, мужчин 13, женщин 2, проходивших лечение в отделении травматологии и ортопедии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского в период с 2015 по 2016 год включительно. Основными жалобами были боль и нарушение функции коленного сустава.
Все пациенты имели травматический костно-хрящевой дефект III-IV степени по Оутербридж размерами от 2 до 3,5 см², локализовавшийся на одном из мыщелков бедра. Давность травмы составляла от 2 нед. до 6 мес. Диагноз устанавливался на основании МРТ и артроскопии.
В качестве оперативного лечения был применен разработанный нами новый способ замещения дефектов хрящевой ткани. На суставных поверхностях артроскопически визуализировали дефект, шейвером формировали границы дефекта, осуществляли дебриджмент. Следующим этапом выполняли забор реберного хряща. Для этого в реберной части на уровне 9 ребра продольным разрезом осуществляли доступ к перихондриуму, последний рассекался вдоль и распатором отводился в стороны. При помощи тонкого костного долота шириной 1 см производился забор хряща на всю толщину, размером 2 см. Перихондриум ушивали без установки дренажей. Далее выполняли миниартротомию, для открытого доступа к зоне дефекта хряща.
Полученный хрящ измельчали скальпелем в крошку до 0,1*0,1 мм. Заливали крошку фибриновым клеем Tissucol и погружали полученную смесь в зону дефекта, плотно прижимая импактором и удерживая до полного застывания. Для замещения дефекта необходима соответствующая консистенция клеево-хрящевой смеси, близкая по своим свойствам к пластилиновой массе. Для этого нами определены оптимально объёмные соотношения фибринового клея и хрящевой крошки. Она составляет 20-40% объёма клея и от 80-60% объёма хрящевой крошки соответственно. Смесь с соотношением меньшего, чем 20%, объёма клея является в конечном итоге непрочной структурой, так как частицы хрящевой крошки недостаточно связаны между собой, если объем клея составляет более 40%, смесь является слишком жидкой для замещения дефектов. Так как надежность фиксации аутотранспланта в ложе не вызывала сомнений, послеоперационную иммобилизацию конечности проводили не более 2 нед. Затем рекомендовали функциональное лечение, включающее пассивные и активные движения в суставе. Полную осевую нагрузку разрешали через 6 нед.
Результаты и обсуждение
Результаты оперативного лечения оценивались на основании данных МРТ и шкалы оценки KOOS в сроки от 3 до 11 мес. с момента операции. Всем пациенты проходили тест KOOS самостоятельно до и после проведенного лечения. Из исследования были исключены 3 пациента как недоступные для оценки результата в послеоперационном периоде. Таким образом были обработаны данные МРТ и шкалы оценки у 12 пациентов.
На контрольных МРТ у всех обследованных пациентов были признаки заполнения хрящевого дефекта и восстановления субхондральной кости.
До операции оценка по шкале KOOS составила по разделам: симптомы 42 %, боль 70.5 %, ограничение активности в повседневной жизни от 52 %, функционирование сустава при занятиях спортом и активном отдыхе от 5 %, общее качество жизни от 18.75 %, общий итог 40 %.
После оперативного лечения по предложенной методике: симптомы от 75% до 100%, боль от 58% до 97%, ограничение активности в повседневной жизни от 82% до 100%, функционирование сустава при занятиях спортом от 30 % до 90%, общее качество жизни от 43,75% до 87,5%, общий итог от 66% до 97%.
Клинические примеры.
Пациент Х. (31 год) поступил с жалобами на боль, ощущение нестабильности в левом коленном суставе, ограничивающее повседневную активность Со слов пациента производственная травма во время соревнований по пятиборью спасателей. Диагностирован разрыв передней крестообразной связки левого коленного сустава, повреждение хряща. Протокол МРТ: разрыв передней крестообразной связки левого коленного сустава. Травматическая отслойка хряща суставной поверхности медиального мыщелка бедра. Большое количество жидкости в полости сустава
Выполнена артроскопическая пластика передней крестообразной связки материалом из сухожилий изящной и полусухожильной мышц.
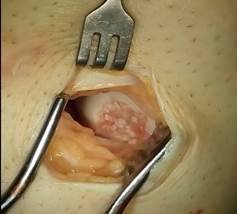
Осуществили с помощью предлагаемого способа замещение дефекта хряща медиального мыщелка бедренной кости (фиг. 1,3) измельченным аутохрящом ребра смешанным с фибриновым клеем (фиг. 2), пропорции смеси для замещения дефекта составили 35 % фибринового клея и 65% хрящевой крошки, объем смеси составил 3 см³.
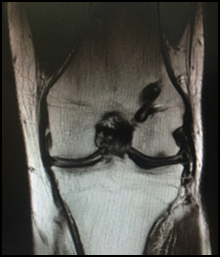
Через 4,5 месяца после операции – протокол МРТ: структура и интенсивность мр-сигнала от хрящевой поверхности, покрывающей суставную поверхность мыщелков, незначительно нарушена, равномерной толщины. Зона отслойки хряща полностью восстановлена (Фиг.4). Пациент передвигается с полной нагрузкой на оперированную конечность, объём движений в оперированном суставе полный, боли нет.
Таким образом, результаты наблюдений показали, что данный способ позволяет успешно и малотравматично восстанавливать поврежденную хрящевую ткань.
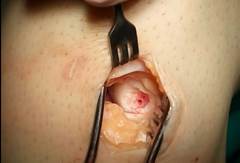 фиг. 1
фиг. 1
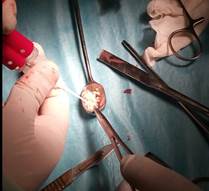 фиг. 2
фиг. 2
 фиг.3
фиг.3
 фиг.4
фиг.4
В результате травм или заболеваний повреждается суставной хрящ, но он обладает очень ограниченной способностью к регенерации. В этой зоне отсутствует васкуляризация и, как следствие, клетки крови и костного мозга, а также хондроциты не могут мигрировать в место дефекта. Поэтому в случае изолированного поражения хряща регенерация выражена слабо. При остеохондральных дефектах происходит повреждение суставного хряща и подлежащей субхондральной кости, вызывающее разрыв кровеносных сосудов и создающее сообщение дефекта с костным мозгом. В этом случае запускается процесс регенерации, начинающийся с образования гематомы, формирующейся из поврежденных кровеносных сосудов или костного мозга. Фибриновая сеть гематомы задерживает тромбоциты, выделяющие, различные биоактивные факторы, стимулирующие в свою очередь, сосудистую инвазию и миграцию недифференцированных мезенхимальных клеток в гематому, постепенно преобразующуюся в фибриновый сгусток. В течение нескольких дней после травмы мезенхимальные клетки размножаются и могут дифференцироваться в хондроциты, синтезирующие коллагеновый матрикс. Получающийся регенерат плохо организован и содержит преимущественно коллаген первого типа [1,7,8].
Независимо от генеза, при отсутствии лечения повреждённого гиалинового хряща, обладающего ограниченной способностью к регенерации, в коленном суставе могут возникать распространённые дегенеративные изменения [7].
Множественные дискуссии и усилия хирургов в сфере восстановления суставного хряща приводят к внедрению широкого спектра хирургических вмешательств. В настоящее время существует три парадигмы пластики хрящевых дефектов. Первая подразумевает стимуляцию развития волокнистой соединительной ткани на месте дефекта в результате вскрытия костных каналов и миграции фибробластов. Вторая предполагает трансплантатацию ауто- или аллогенного хряща с субхондральной костной платиной и подлежащей костью из ненагружаемых участков коленного сустава или от трупа (мозаичная хондропластика). В третьем подходе используются аутокультуры хондроцитов, которые фиксируются к месту дефекта различными коллагеновыми мембранами и гидрогелями. Предложены модификации первого способа, при которых применяются синтетические спейсеры дефекта, в которые из вскрытых костных каналов мигрируют полипотентные клетки (ChondroGuide). Cтруктура и состав спейсеров способствует их дифференциации в хондроциты [3,4,5].
Установлено, что при артропластике в случае наличия дефектов суставных поверхностей воспалительного, травматического или дегенеративного происхождения необходимо их закрывать материалами, изолирующими обнаженную (лишенную хрящевого покрова) кость от полости сустава таким образом, чтобы были возможны свободные движения и скольжение сочленяющихся суставных концов, что лучше всего обеспечивается свойствами нативного гиалинового хряща или способствующими его восстановлению прокладками интерпозиционной артропластикой [2,3]. Предложено более 50 видов прокладок для интерпозиционной артропластики, но ни одна из них не дает искомого результата.
Положительный результат предложенного нами способа достигается тем, что для замещения дефектов хрящевой ткани используется имплантация измельченного аутологичного хряща, смешанного с фибриновым клеем. Трансплантат забирается с хрящевой части ребра практически в любом требуемом объеме, а пропорции смеси для замещения дефекта составляют 20-40 % фибринового клея и 60-80% хрящевой крошки, что позволяет обеспечить нужную консистенцию и прочность фиксации.
Заключение
Таким образом, предлагаемый способ замещения дефектов хрящевой ткани позволяет рассматриваться как эффективный метод оперативного лечения больных с деструктивно-дистрофическими и посттравматическими дефектами гиалинового хряща большого размерного диапазона за счет оптимального соотношения материалов, замещающих дефект, отсутствие дополнительной травматизации пораженного сустава и доступа к депо хрящевой ткани, обладающим высокими регенеративными способностями, – к хрящевой части ребер.
Библиографическая ссылка
Зар В.В., Степанов Е.В. АУТОПЛАСТИЧЕСКОЕ ЗАМЕЩЕНИЕ ДЕФЕКТОВ ХРЯЩА КОЛЕННОГО СУСТАВА // Современные проблемы науки и образования. 2016. № 6. ;URL: https://science-education.ru/ru/article/view?id=25869 (дата обращения: 22.01.2026).
DOI: https://doi.org/10.17513/spno.25869



